- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Классификация неорганических веществ
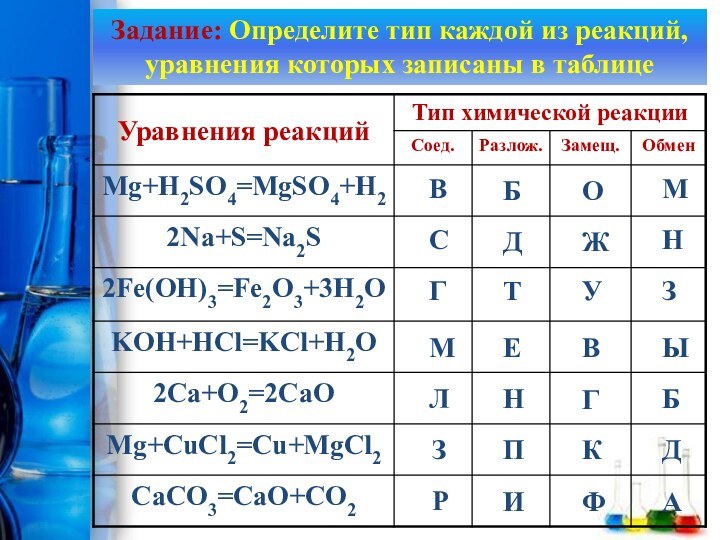
Содержание
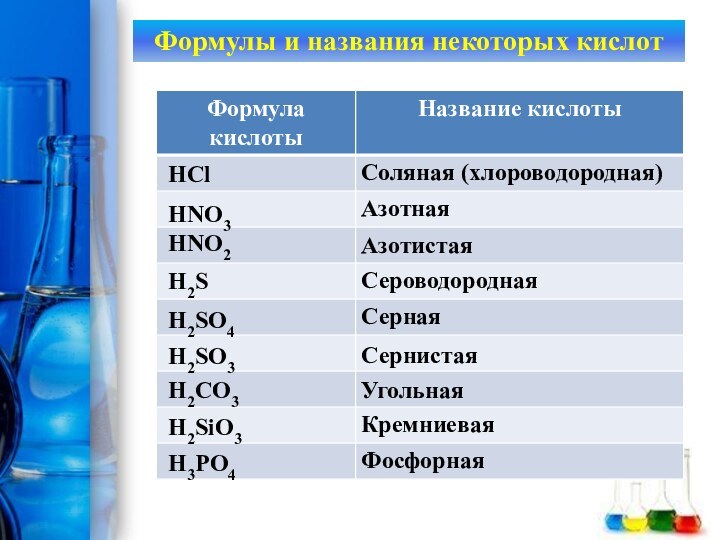
- 2. ВБОМСДЖНГТУЗМЕВЫЛНГБЗПКДРИФАЗадание: Определите тип каждой из реакций, уравнения которых записаны в таблице
- 3. Задание: Из букв правильных ответов определите название
- 4. КИСЛОТЫОрлова В.Н.Учитель химии и биологии МАОУ «Гимназия Тарасовка»
- 5. Цели урокаСформировать понятие о кислотах.Рассмотреть состав, название,
- 6. Кислоты вокруг нас
- 7. Кислоты вокруг нас
- 8. Кислоты вокруг нас
- 9. Кислоты вокруг нас
- 10. Кислоты в организме человекаАскорбиновая кислота – источник
- 11. Формулы и названия некоторых кислотHClHNO3HNO2H2SH2SO4H2SO3H2CO3H2SiO3H3PO4Соляная (хлороводородная)Азотная АзотистаяСероводородная СернаяСернистаяУгольнаяКремниеваяФосфорная
- 12. Кислоты - это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остаткаHxR
- 13. XIHxR
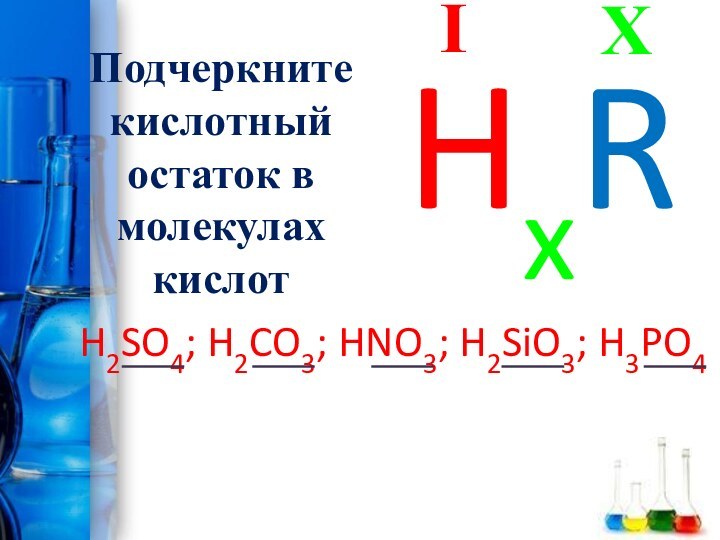
- 14. Подчеркните кислотный остаток в молекулах кислотH2SO4; H2CO3; HNO3; H2SiO3; H3PO4XIHxR
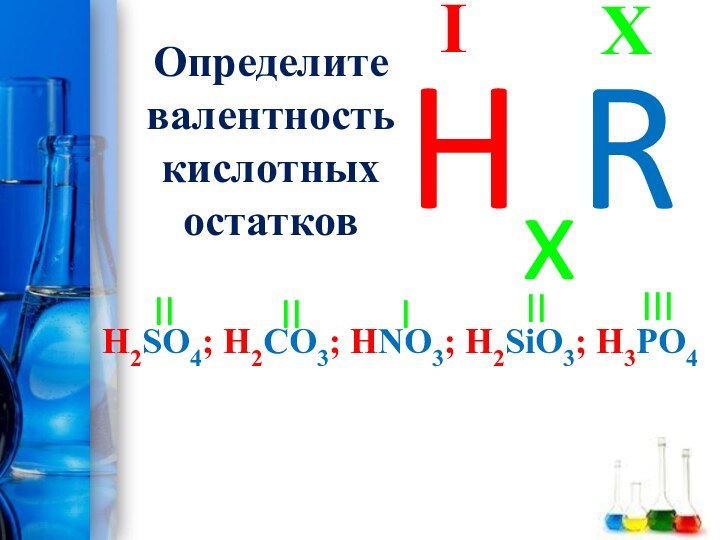
- 15. Определите валентность кислотных остатковH2SO4; H2CO3; HNO3; H2SiO3; H3PO4XIHxRIIIIIIIIII
- 16. Составьте формулы кислот по известным кислотным остаткамCl(I)
- 17. Классификация кислотПо какому признаку кислоты разделены на
- 18. Классификация кислотHNO3, H2SO4, H2CO3кислородсодержащиеHCl, H2S, HF, HBrбескислородные- по составу -
- 19. Классификация кислотHF - фтороводороднаяHCl - хлороводородная
- 20. Классификация кислотHNO3, HCl, HBr одноосновныеHNO3, H2SO4, H2CO3кислородсодержащиеHCl,
- 21. Классификация кислотHNO3, HCl, HBr одноосновныеHNO3, H2SO4, HCl,HI,
- 22. Общие химические свойства кислотОпыт №1. Действие кислот
- 23. Опыт №3. Взаимодействие кислот с оксидами металловКислота
- 24. Опыт №4. Взаимодействие кислот с солямиКислота +
- 25. Это интересно!
- 26. Закрепление!1. Найдите группу формул кислот:2. Выберите формулу
- 27. 3. Даны вещества:Закрепление!CuF2Расположите их в таком порядке, чтобы внизу получилось название индикатора.KClH2SO4 О3HClBaONaOH H3PO4H2CO3CO2HNO3H2H2SO3 БЛОАГВКМИУЕСД
- 28. Домашнее задание:§ 32 упр. 2, 7 ,8 подготовиться к химическому диктанту
- 29. Скачать презентацию
- 30. Похожие презентации









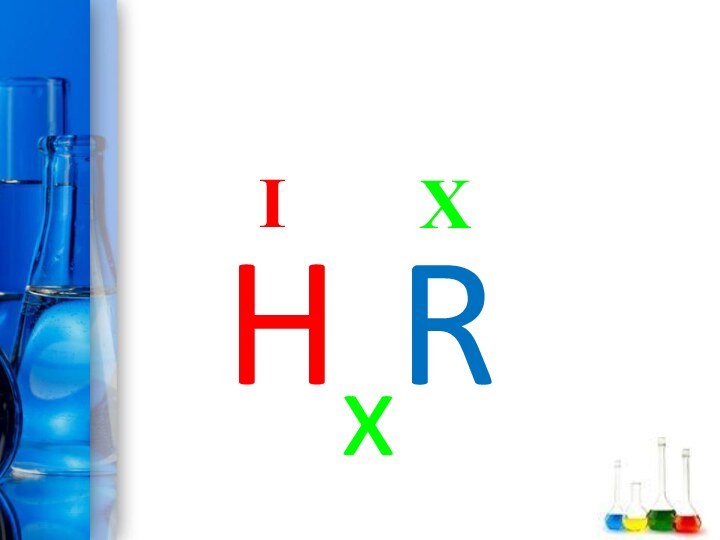












Слайд 2
В
Б
О
М
С
Д
Ж
Н
Г
Т
У
З
М
Е
В
Ы
Л
Н
Г
Б
З
П
К
Д
Р
И
Ф
А
Задание: Определите тип каждой из реакций, уравнения которых
записаны в таблице
Слайд 3
Задание:
Из букв правильных ответов определите название класса
веществ
О С Т Ы Л
К ИК И С Л О Т Ы
Слайд 5
Цели урока
Сформировать понятие о кислотах.
Рассмотреть состав, название, классификацию
кислот.
Познакомиться с представителями неорганических кислот.
Изучить химические свойства кислот
Слайд 10
Кислоты в организме человека
Аскорбиновая кислота – источник витамина
С
Фолиевая кислота – жизненно важный витамин В9
Аминокислоты – строительный
материал жизни
Слайд 11
Формулы и названия некоторых кислот
HCl
HNO3
HNO2
H2S
H2SO4
H2SO3
H2CO3
H2SiO3
H3PO4
Соляная (хлороводородная)
Азотная
Азотистая
Сероводородная
Серная
Сернистая
Угольная
Кремниевая
Фосфорная
Слайд 12
Кислоты
- это сложные вещества, состоящие из одного
или нескольких атомов водорода и кислотного остатка
HxR
Слайд 16
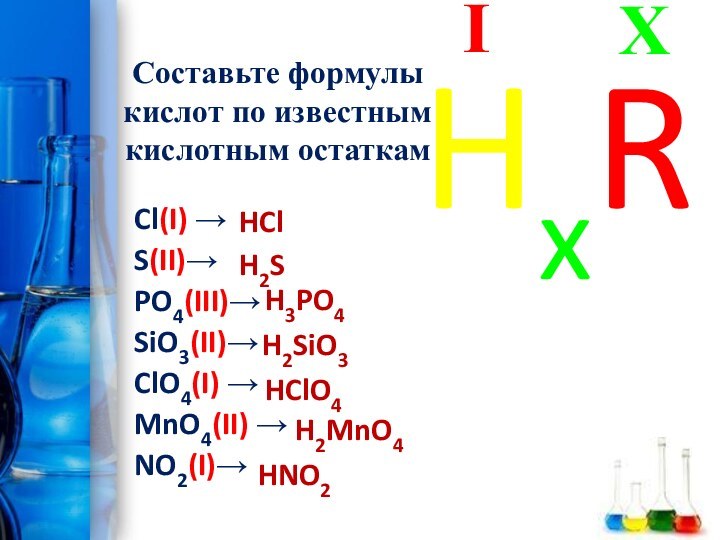
Составьте формулы кислот по известным кислотным остаткам
Cl(I) →
S(II)→
PO4(III)→
SiO3(II)→
ClO4(I) →
MnO4(II) →
NO2(I)→
X
I
HxR
HCl
H2S
H3PO4
H2SiO3
HClO4
H2MnO4
HNO2
Слайд 17
Классификация кислот
По какому признаку
кислоты разделены на группы
HNO3
- азотная
HNO2 - азотистая
HClO4 - хлорная
H2SO4 - серная
H2SO3 -
сернистаяH2CO3 - угольная
H2SiO3- кремниевая
H3PO4 - фосфорная
H3BO3 - борная
HF - фтороводородная
HCl - хлороводородная
HBr - бромоводородная
HI - йодоводородная
H2S - сероводородная
Слайд 18
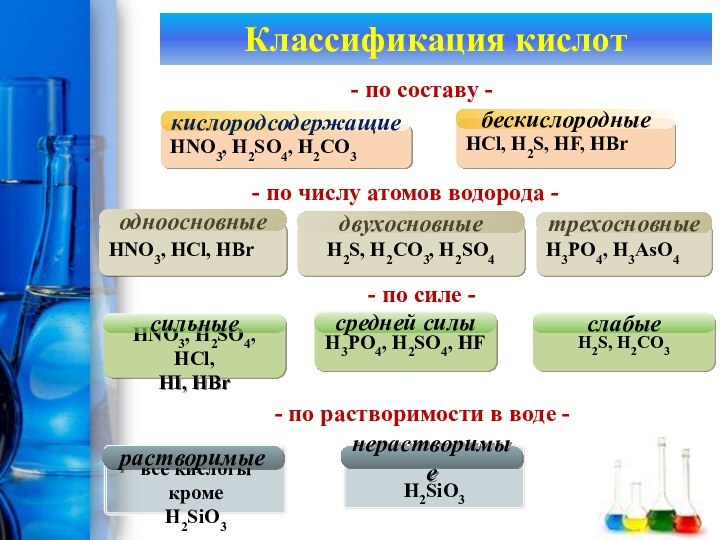
Классификация кислот
HNO3, H2SO4, H2CO3
кислородсодержащие
HCl, H2S, HF, HBr
бескислородные
- по
составу -
Слайд 19
Классификация кислот
HF - фтороводородная
HCl - хлороводородная
HBr
- бромоводородная
HI - йодоводородная
HNO3 - азотная
HNO2 -
азотистаяHClO4 - хлорная
H3PO4 - фосфорная
H3BO3 - борная
H2S - сероводородная
H2SO4 - серная
H2SO3 - сернистая
H2CO3 - угольная
H2SiO3 - кремниевая
По какому признаку
кислоты разделены на группы?
Слайд 20
Классификация кислот
HNO3, HCl, HBr
одноосновные
HNO3, H2SO4, H2CO3
кислородсодержащие
HCl, H2S,
HF, HBr
бескислородные
- по составу -
- по числу атомов водорода
-H3PO4, H3AsO4
H2S, H2CO3, H2SO4
двухосновные
трехосновные
Слайд 21
Классификация кислот
HNO3, HCl, HBr
одноосновные
HNO3, H2SO4, HCl,
HI, HBr
сильные
HNO3, H2SO4, H2CO3
кислородсодержащие
HCl, H2S, HF, HBr
бескислородные
- по составу -
-
по числу атомов водорода -H3PO4, H3AsO4
H2S, H2CO3, H2SO4
двухосновные
трехосновные
- по силе -
H3PO4, H2SO4, HF
средней силы
H2S, H2CO3
слабые
- по растворимости в воде -
все кислоты кроме
H2SiO3
растворимые
H2SiO3
нерастворимые
Слайд 22
Общие химические свойства кислот
Опыт №1. Действие кислот на
индикаторы
Опыт №2. Взаимодействие кислот с основаниями
Кислота + основание =
соль + вода (реакция нейтрализации) H2SO4 + 2NaOH = Na2SO4 + 2H2O
Данная реакция является универсальной, т.к. протекает между любыми кислотами и основаниями.
!
Слайд 23
Опыт №3. Взаимодействие кислот с оксидами металлов
Кислота +
оксид металла = соль + вода
H2SO4 + CuO
= CuSO4 + H2OОбщие химические свойства кислот
Опыт №4. Взаимодействие кислот с металлами
Кислота + металл = соль + водород
H2SO4 + Zn = ZnSO4 + H2↑
Условия протекания данной реакции:
В ряду напряжений металл должен стоять до водорода.
В результате реакции должна получиться растворимая соль.
Нерастворимые кислоты (кремниевая) с металлами не взаимодействуют).
Концентрированный раствор серной кислоты и раствор азотной кислоты взаимодействуют иначе, поэтому уравнения реакций этих кислот с металлами записывают по другой схеме.
Слайд 24
Опыт №4. Взаимодействие кислот с солями
Кислота + соль
= новая соль + новая кислота
H2SO4 + BaCl2 =
BaSO4↓ + 2HClУсловия протекания данной реакции:
В результате реакции должен выделяться газ
В результате реакции новая кислота или новая соль должны выпадать в осадок
2HNO3 + CaCO3 = Ca(NO3)2 +H2O + CO2 ↑
Общие химические свойства кислот
Слайд 26
Закрепление!
1. Найдите группу формул кислот:
2. Выберите формулу «третьего
лишнего» вещества в каждом ряду:
HCl
H2 SO4
HBr
HNO3
H2S
NH3
HCl
KCl
H3PO4
K2O
HCl
H2 SO4
HNO3
H2O
H2CO3
H2 S
H2 SO4
NaOH