- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Общие аспекты регуляции
Содержание
- 2. Метаболизм представляет собой совокупность всех химических реакций,
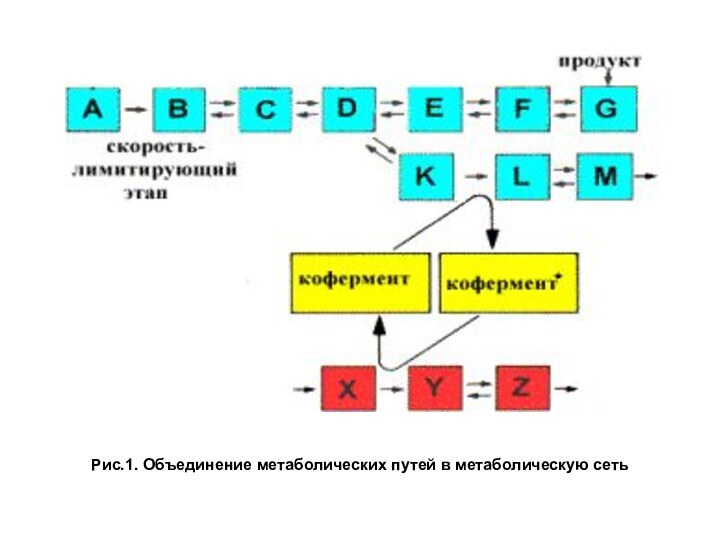
- 3. Рис.1. Объединение метаболических путей в метаболическую сеть
- 4. Анаболизм и катаболизм. В метаболизме можно выделить пути
- 5. Роль АТФ Процессы, протекающие с потреблением и
- 6. Рис.2. Роль АТФ в биоэнергетике
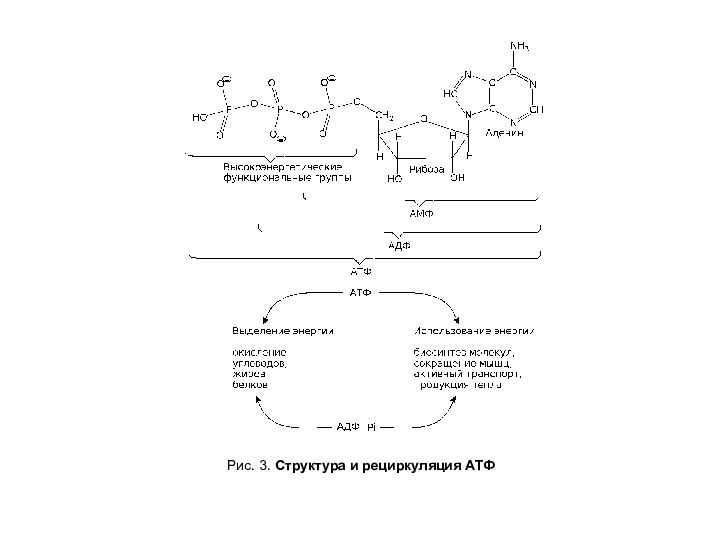
- 7. Рис. 3. Структура и рециркуляция АТФ
- 8. Регуляция метаболизма. Общие аспекты Среди многих ферментов,
- 9. Аллостерическая регуляция ключевых ферментов позволяет получить немедленный ответ
- 10. Отрицательная обратная связь. В простейших саморегулирующихся системах увеличение
- 11. Положительная обратная связь наблюдается, когда метаболит-предшественник активирует стадию, контролирующую
- 12. Индукция или репрессия синтеза ферментов приводит к изменению
- 13. Механизм действия гормонов на метаболизм Гормоны —
- 14. Гормоны обладают высокой биологической активностью. Их действие
- 15. Система вторичных посредников. Появление в клетке вторичного посредника
- 16. Образование цАМФ
- 17. Функционирование системы трансмембранной передачи сигналов обеспечивают белки:
- 18. взаимодействие α-субъединицы с аденилатциклазой приводит к изменению конформации
- 19. Механизм действия гормонов, опосредованный цАМФ
- 20. Активация протеинкиназы А (ПКА) Молекулы цАМФ могут
- 21. Инозитолфосфатная система Инозитолфосфатная система включает 3 основных
- 22. Инозитолфосфатная система Это вызывает диссоциацию комплекса; α-GTPвзаимодействует с
- 23. Инозитолфосфатная система Повышение концентрации Са2+ в цитозоле клетки
- 24. Инозитолфосфатная система Для снижения концентрации Са2+ в клетке
- 25. Инозитолфосфатная система Активность транслоказ Са2+ и Са2+-АТФ-аз может
- 27. Трансдукция сигнала через инсулиновый рецептор Рецептор инсулина
- 28. Активации рецептора инсулина — тирозиновой протеинкиназы
- 29. Трансдукция сигнала через инсулиновый рецептор Каталитический центр ТП
- 30. Скачать презентацию
- 31. Похожие презентации
Метаболизм представляет собой совокупность всех химических реакций, происходящих в организме. Под термином метаболический путь подразумевается последовательность реакций, приводящих к образованию определенного продукта. Соединения, образующиеся в ходе превращений, называют метаболитами. Изучение отдельных путей выделяют для удобства. В действительности метаболические пути





















![Общие аспекты регуляции Инозитолфосфатная система Активность транслоказ Са2+ и Са2+-АТФ-аз может регулироваться:комплексом [кальмодулин][4Са2+];ПКА (фосфорилированием);ПКС (фосфорилированием), а](/img/tmb/15/1426900/4a2adc520fd7bb8a688cd05e317bf55d-720x.jpg)




Слайд 4 Анаболизм и катаболизм. В метаболизме можно выделить пути анаболизма,
которые предназначены для биосинтезов, и пути катаболизма, которые ведут
к расщеплению сложных молекул. Хотя катаболические и анаболические пути во многом различаются, они тесно связаны друг с другом. Связь между ними обеспечивает оптимальный уровень метаболизма. Катаболизм и анаболизм — это сопряженные взаимодополняющие процессы.Энергия и метаболизм. Живые системы требуют постоянного притока энергии для своей жизнедеятельности. В отсутствие энергии клетку можно сравнить с неработающей машиной. Жизнь, рост, целостность клетки зависят от пищи не только как источника углерода, азота, фосфора и других необходимых элементов, но также как источника энергии.
Слайд 5
Роль АТФ
Процессы, протекающие с потреблением и выделением
энергии, связаны между собой. Центральную роль в этой взаимосвязи
выполняет АТФ — основное высокоэнергетическое соединение клетки. Роль АТФ в клеточной энергетике можно определить следующим образом:— химическая энергия, освобождаемая в процессе катаболизма, запасается путем фосфорилирования АДФ с образованием АТФ;
— энергия АТФ затем используется за счет расщепления макроэргических связей АТФ в ходе эндергонических реакций синтеза и других процессов, требующих затрат энергии, например активного транспорта (рис. 1).
АТФ часто рассматривается как энергетическая валюта. Важно понимать, что АТФ — это не вид энергии, а форма запасания энергии, получаемая при деградации сложных молекул. Пример рециркуляции АТФ приведен на рис.2.
Слайд 8
Регуляция метаболизма. Общие аспекты
Среди многих ферментов, обеспечивающих
протекание того или иного метаболического пути со скоростью, необходимой
для удовлетворения физиологических потребностей организма, только некоторые играют ключевую роль в регуляции. Это, во-первых, как правило, ферменты одной из начальных стадий цепи превращений, обязательно необратимой. Во-вторых, регуляторной функцией часто наделены ферменты, находящиеся в точках разветвления метаболических путей.Кроме того, регуляторные ферменты часто катализируют самые медленные (лимитирующие) стадии метаболического пути. Активность ферментов в этих ключевых точках определяет скорость метаболизма и может регулироваться в основном тремя способами.
Слайд 9 Аллостерическая регуляция ключевых ферментов позволяет получить немедленный ответ клетки
на изменения условий среды, выражающиеся в изменении концентрации промежуточных
продуктов или коферментов. Например, увеличение потребности клетки в АТФ приводит к повышению скорости гликолиза в мышечных клетках. Энергетический запас клетки определяется как отношение:Скорость катаболизма глюкозы обратно пропорциональна энергетическому запасу клетки вследствие противоположности влияния АДФ + АМФ или АТФ на регуляторные ферменты гликолиза. Аллостерическая регуляция ферментов является основным способом регуляции метаболических путей.
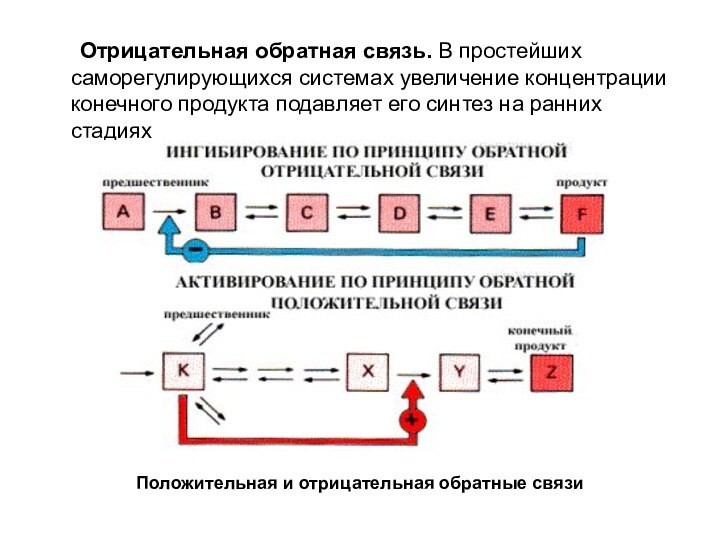
Отрицательная обратная связь. В простейших саморегулирующихся системах увеличение концентрации конечного продукта подавляет его синтез на ранних стадиях
Слайд 10 Отрицательная обратная связь. В простейших саморегулирующихся системах увеличение концентрации
конечного продукта подавляет его синтез на ранних стадиях
Положительная и
отрицательная обратные связи Слайд 11 Положительная обратная связь наблюдается, когда метаболит-предшественник активирует стадию, контролирующую его
дальнейшее превращение, например, переход в запасные вещества. Вещество запасается
только тогда, когда его количество превосходит потребности метаболического пути.Ковалентная модификация ключевых ферментов может осуществляться под влиянием внеклеточных воздействий (гормонов) и приводить как к активации, так и к ингибированию ферментов. В этом случае метаболизм клетки изменяется таким образом, чтобы соответствовать в большей мере потребностям организма, чем потребностям самой клетки. Ковалентная модификация обычно осуществляется путем фосфорилирования — дефосфорилирования. Фосфорилирование катализируют протеинкиназы. Соответствующие им фосфатазы дефосфорилируют фермент и, следовательно, отменяют результаты фосфорилирования. Количество фосфорилированных форм фермента зависит от соотношения активностей киназы и фосфатазы.
Слайд 12 Индукция или репрессия синтеза ферментов приводит к изменению количества
ферментов и, значит, скорости метаболизма. Подобным способом обеспечиваются долговременные,
адаптивные изменения метаболизма. Индукция и репрессия синтеза ферментов могут происходить в клетках в результате влияния на них некоторых гормонов.
Слайд 13
Механизм действия гормонов на метаболизм
Гормоны — это межклеточные
химические посредники (мессенджеры). Они секретируются одним типом клеток в
ответ на определенные стимулы (сигналы) и оказывают воздействие на метаболизм клеток другого типа. Например, клетки островков Лангерганса поджелудочной железы секретируют гормон глюкагон в ответ на снижение концентрации глюкозы в крови. Глюкагон стимулирует распад гликогена в клетках печени и поступление запасенной глюкозы в кровь.Слайд 14 Гормоны обладают высокой биологической активностью. Их действие проявляется
при очень низких концентрациях (10-6 – 10-10 моль/л). С химической точки
зрения гормоны можно разделить на три группы: 1) гормоны — производные аминокислот, 2) белково-пептидные гормоны, 3) стероидные гормоны. Гормоны оказывают свое действие, связываясь со специфическими рецепторами, располагающимися либо на поверхности мембраны клетки, либо в цитозоле. Связывание с рецепторами – обязательный этап в действии гормона. Белково-пептидные гормоны и гормоны — производные аминокислот являются гидрофильными веществами, и проникновение их через плазматическую мембрану, состоящую из липидного бислоя, затруднено или невозможно. Рецепторы таких гормонов находятся на наружной поверхности плазматической мембраны. Гормоны связываются с рецепторными белками тех участков мембран клеток-мишеней,которые контактируют с окружающей средой, что, в свою очередь, активирует ферментную систему, отвечающую за образование вторичного (внутриклеточного) посредника.Слайд 15 Система вторичных посредников. Появление в клетке вторичного посредника является
пусковым моментом для изменения метаболизма, осуществляемого обычно путем фосфорилирования
белков. Роль вторичных посредников могут выполнять цАМФ, цГМФ, инозитолтрифосфат, диацилглицерол, Ca2+. Наиболее распространенным и хорошо изученным вторичным посредником является циклический 3',5'-аденозинмонофосфат (цАМФ). Связывание гормона с рецептором активирует аденилатциклазу и, следовательно, ведет к повышению внутриклеточной концентрации цАМФ, что сопровождается увеличением скорости фосфорилирования белка. Наличие каскада ферментативных реакций между связыванием гормона с рецептором и изменением метаболизма позволяет значительно усилить первичное воздействие гормона. При участии аденилатциклазной системы реализуются эффекты сотни различных по своей природе сигнальных молекул — гормонов, нейромедиаторов, эйкозаноидов.Слайд 17 Функционирование системы трансмембранной передачи сигналов обеспечивают белки: Rs
— рецептор сигнальной молекулы, которая активирует аденилатциклазу, Ri — рецептор сигнальной
молекулы, которая ингибирует аденилатциклазу; Gs — стимулирующий и Gi — ингибирующий аденилатциклазу белок; ферменты аденилатциклаза (АЦ) и протеинкиназа А (ПКА).Последовательность событий, приводящих к активации аденилатциклазы:
связывание активатора аденилатциклазной системы, например гормона (Г) с рецептором (Rs), приводит к изменению конформации рецептора и увеличению его сродства к Gs-белку. В результате образуется комплекс [Г][R][G-ГДФ];
присоединение [Г][R] к G-ГДФ снижает сродство α-субъединицы Gs-белкак ГДФ и увеличивает сродство к ГТФ. ГДФ замещается на ГТФ;
это вызывает диссоциацию комплекса. Отделившаяся субъединица α, связанная с молекулой ГТФ, обладает сродством к аденилатциклазе:
[Г][R][G — ГТФ] → [Г][R] + α-ГTФ+ βγ;
Слайд 18 взаимодействие α-субъединицы с аденилатциклазой приводит к изменению конформации фермента
и его активации, увеличивается скорость образования цАМФ из АТФ;
конформационные
изменения в комплексе [α-ГТФ][АЦ] стимулируют повышение ГТФ — фосфатазной активности α-субъединицы. Протекает реакция дефосфорилирования ГТФ, и один из продуктов реакции — неорганический фосфат (Рi) отделяется от α-субъединицы; скорость гидролиза определяет время проведения сигнала;образование в активном центре α-субъединицы молекулы ГДФ снижает его сродство к аденилатциклазе, но увеличивает сродство к β- и γ-субъединицам. Gs-белок возвращается к неактивной форме;
если рецептор связывается с новой молекулой активатора, например гормоном, цикл функционирования Gs белка повторяется.
Слайд 20
Активация протеинкиназы А (ПКА)
Молекулы цАМФ могут обратимо
соединяться с регуляторными субъединицами ПКА. Присоединение цАМФ к регуляторным
субъединицам (R) вызывает диссоциацию комплекса С2R2 на комплекс цАМФ4 R2 и С + С. Субъединицы С представляют собой активную форму протеинкиназы А.Активная протеинкиназа А фосфорилирует специфические белки по серину и треонину, в результате изменяются конформация и активность фосфорилированных белков, а это приводит к изменению скорости и направления регулируемых процессов в клетке.
Концентрация цАМФ в клетке может изменяться, она зависит от соотношения активностей ферментов аденилатциклазы и фосфодиэстеразы.
Большую роль в регуляции внутриклеточной сигнальной системы играет белок АКАРs. «Заякоренный» белок АКАРs участвует в сборке ферментных комплексов, включающих не только протеинкиназу А, но и фосфодиэстеразу и фосфопротеинфосфатазу.
Слайд 21
Инозитолфосфатная система
Инозитолфосфатная система включает 3 основных мембранных
белка: R (рецептор), фосфолипазу С и Gplc — белок, активирующий
фосфолипазу С, а также белки и ферменты мембран цитозоля, участвующие в связывании и транспорте Са2+.Последовательность событий, приводящих к активации фосфолипазы С:
связывание гормона с R приводит к изменению его конформации и увеличению сродства к Gplc;
образование комплекса [Г][R][ Gplc –ГДФ]приводит к снижению сродстваα-протомераСplc-белкак ГДФ и увеличению сродства к ГТФ. ГДФ заменяется на ГТФ.
Слайд 22
Инозитолфосфатная система
Это вызывает диссоциацию комплекса; α-GTPвзаимодействует с фосфолипазой
С и активирует ее. Субстратом этого фермента является фосфатидилинозитолбисфосфат
(ФИФ2).В результате гидролиза ФИФ2 образуется и выходит в цитозоль гидрофильное вещество инозитолтрифосфат(ИФ-3). Другой продукт реакции, диацилглицерол (ДАГ), остается в мембране и участвует в активации фермента протеинкиназы С (ПКС).
ИФ-3 связывается со специфическими центрами Са2+-каналамембраны ЭР, он изменяет конформацию и канал открывается — Са2+ поступает в цитозоль. В отсутствие в цитозоле ИФ-3 канал закрыт.
Слайд 23
Инозитолфосфатная система
Повышение концентрации Са2+ в цитозоле клетки увеличивает
скорость взаимодействия Са2+ с неактивным цитозольным ферментом протеинкиназой С и
белком кальмодулином, таким образом сигнал, принятый рецептором клетки, раздваивается.Изменение конформации [ПКС][Са2+] увеличивает сродство центров связывания фермента к липидам клеточной мембраны — ДАГ и фосфатидилсерину (ФС). На внутренней стороне мембраны образуется ферментный комплекс — [ПКС][Са2+] [ДАГ] [ФС] — активная протеинкиназа С, которая меняет активность специфических ферментов, фосфорилируя их по серину и треонину.
В клетках тканей присутствует белок кальмодулин, который функционирует как внутриклеточный рецептор Са2+, он имеет 4 центра для связывания Са2+. Комплекс [кальмодулин][4Са2+] не обладает ферментативной активностью, но взаимодействие комплекса с различными белками и ферментами приводит к их активации.
Слайд 24
Инозитолфосфатная система
Для снижения концентрации Са2+ в клетке до
исходного уровня работают системы Са2+-АТФаз и транслоказ (антипорт).
При повышении
в клетке концентрации Са2+ увеличивается активность Са2+-АТФазы (Е):это приводит к активации аутофосфорилирования и образованию фосфорилированной формы Са2+-АТРазы (Е-Р);
аутофосфорилирование вызывает изменение конформации Са2+-АТФазы,снижение ее сродства к Са2+ и высвобождение ионов по другую сторону мембраны.
Слайд 25
Инозитолфосфатная система
Активность транслоказ Са2+ и Са2+-АТФ-аз может регулироваться:
комплексом
[кальмодулин][4Са2+];
ПКА (фосфорилированием);
ПКС (фосфорилированием), а также зависит от структуры и
состава липидного бислоя мембраны.Присутствующие в цитозоле ИФ-3 и ДАГ в мембране могут в результате серии реакций опять превращаться в ФИФ2. Активная ПКС стимулирует образование ФИФ2.
Слайд 27
Трансдукция сигнала через инсулиновый рецептор
Рецептор инсулина представляет
собой тирозиновую протеинкиназу (ТП), то есть протеинкиназу, фосфорилируюшую белки
по ОН-групп амтирозина. Рецептор состоит из 2 α- и 2β-субъединиц, связанных дисульфидными связями и нековалентными взаимодействиями, α- и β-субъединицы являются гликопротеинами с углеводной частью на наружной стороне мембраны. Вне мембраны находятся α-субъединицы. Центр связывания инсулина образуют N-концевые домены α-субъединиц, a β-субъединицы пронизывают мембранный бислой и не участвуют в связывании инсулина.
Слайд 29
Трансдукция сигнала через инсулиновый рецептор
Каталитический центр ТП находится
на внутриклеточных доменах β-субъединиц. Присоединение инсулина к центру связывания на
α-субъединицах активирует аутофосфорилирование β-субъединиц, причем субстратом служит сама ТП. β-субъединицы фосфорилируются по нескольким тирозиновым остаткам. Это, в свою очередь, приводит к способности ТП фосфорилировать и другие внутриклеточные белки. Активация и изменение специфичности обусловлены конформационными изменениями рецептора инсулина после связывания инсулина и аутофосфорилирования.Фосфорилирование внутриклеточных белков, участвующих в регуляции клеточных процессов, меняет их активность.
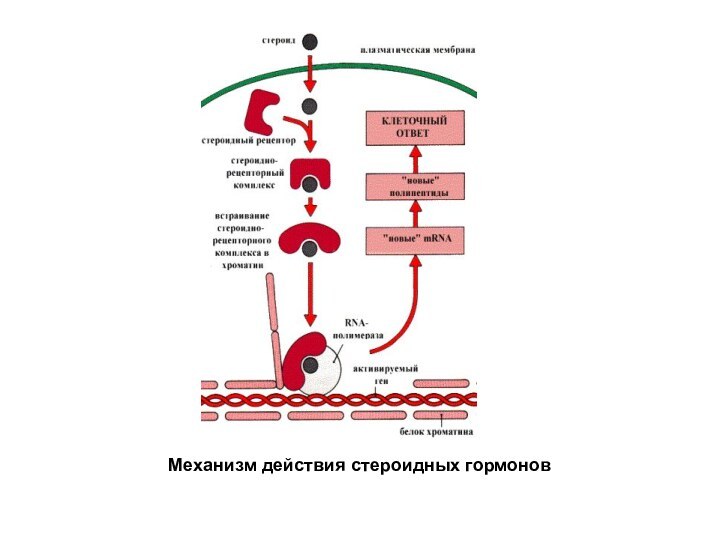
Стероидные гормоны являются веществами гидрофобного характера. Они легко преодолевают фосфолипидный барьер мембран и попадают в цитозоль клетки, где связываются с рецепторами. Образующийся комплекс гормон – рецептор перемещается в ядро, взаимодействует с хроматином и стимулирует или репрессирует транскрипцию определенных генов. Некоторые гормоны взаимодействуют с рецепторами, локализованными в ядре в составе хроматина. Таким образом, эти гормоны регулируют метаболические процессы, изменяя скорость биосинтеза ключевых белков.