Слайд 2
Если сигнал воспринимается мембранными рецепторами, то схему передачи
информации можно представить так:
взаимодействие рецептора с сигнальной молекулой (первичным
посредником);
активация мембранного фермента, ответственного за образование вторичного посредника;
образование вторичного посредника цАМФ, цГМФ, ИФ3, ДАТ или Са2+;
активация посредниками специфических белков, в основном протеинкиназ, которые, в свою очередь, фосфорилируя ферменты, оказьюают влияние на активность внутриклеточных процессов.
Несмотря на огромное разнообразие сигнальных молекул, рецепторов и процессов, которые они регулируют, существует всего несколько механизмов трансмембранной передачи информации: с использованием аденилатциклазной системы, инозитолфосфатной системы, каталитических рецепторов, цитоплазматических или ядерных рецепторов.

Рецепторы
По локализации различают мембранные, цитоплазматические и
ядерные рецепторы. По другой классификации все рецепторы можно разделить на быстроотвечающие (в пределах миллисекунд) и медленноотвечающие, в пределах нескольких минут или даже часов, что характерно для гормонов, передающих сигнал на внутриклеточные рецепторы. Рецепторы первого типа - интегральные олигомерные белки, содержащие субъединицу, имеющую центр для связывания сигнальной молекулы и центральный ионный канал (рис. 5-29).
Рецепторы второго типа, локализованные в мембранах и не связанные с каналами, подразделяют на 2 большие группы: каталитические рецепторы, обладающие собственной тирозин-киназной или гуанилатциклазной активностью, и рецепторы, взаимодействующие через G-белок с мембранным ферментом. Связывание ли-ганда (например, гормона) с рецептором на наружной стороне клеточной мембраны приводит к изменению активности цитоплазматического фермента, который, в свою очередь, инициирует клеточный ответ, т.е. через мембрану переносится информация, а не заряды или какие-либо растворённые молекулы.
В случае цитоплазматических рецепторов через мембрану проходит гормон, а информация о присутствии гормона в клетке с помощью рецептора передаётся в ядро.
Различные клетки организма в зависимости от выполняемых ими функций имеют определённый набор рецепторов. В мембране одной клетки может быть более десятка разных типов рецепторов. Взаимодействуя с рецептором, внеклеточные химические посредники оказывают влияние на метаболизм и функциональное состояние (пролиферация, секреция и т.д.) клеток-мишеней.
Слайд 4
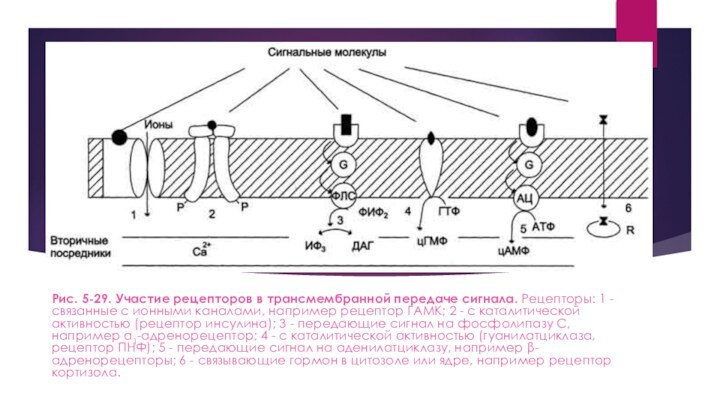
Рис. 5-29. Участие рецепторов в трансмембранной передаче сигнала. Рецепторы:
1 - связанные с ионными каналами, например рецептор ГАМК;
2 - с каталитической активностью (рецептор инсулина); 3 - передающие сигнал на фосфолипазу С, например α1-адренорецептор; 4 - с каталитической активностью (гуанилатциклаза, рецептор ПНФ); 5 - передающие сигнал на аденилатциклазу, например β-адренорецепторы; 6 - связывающие гормон в цитозоле или ядре, например рецептор кортизола.
Слайд 5
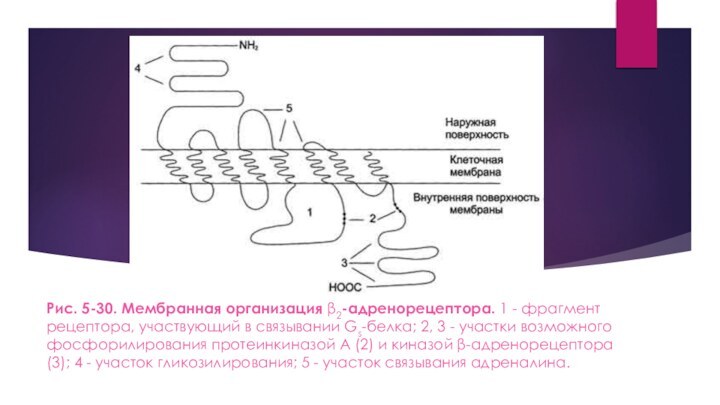
Рис. 5-30. Мембранная организация β2-адренорецептора. 1 - фрагмент рецептора, участвующий
в связывании Gs-белка; 2, 3 - участки возможного фосфорилирования
протеинкиназой А (2) и киназой β-адренорецептора (3); 4 - участок гликозилирования; 5 - участок связывания адреналина.
Слайд 6
Рецепторы адреналина - адренорецепторы
Адренорецепторы различают по распределению в

организме - центральные и периферические. Центральные адренорецепторы, локализованные в
различных областях мозга, участвуют в регуляции функций ЦНС, периферические - контролируют работу внутренних органов.
Все адренорецепторы классифицируют на два типа - α- и β-, но каждый тип имеет несколько подтипов, наиболее распространённые из них - α1-, α2-, β1, - и β2-рецепторы. В зависимости от своего анатомического расположения клетки одного типа, например гладко-мышечные клетки сосудов или адипоциты, содержат разные типы рецепторов.
Несмотря на значительное подобие между α- и β-рецепторами и их подтипами, они кодируются разными генами. Адренорецепторы принадлежат к семейству белков, имеющих 7 трансмембранных α-спиралей (которые принято называть доменами). Длина N- и С-концов, а также длина 1-4 доменов различается у разных типов и подтипов рецепторов
Адренорецепторы - гликопротеины, включающие в свой состав различные углеводные фрагменты. Гликозилированию подвергаются расположенные в области N-конца остатки аспарагиновой кислоты.
Слайд 7
β-Адренорецепторы встречаются практически во всех тканях организма. Количество β-адренорецепторов,
приходящееся на клетку, варьирует от 300 до 4000.
Центр связывания
адреналина образован аминокислотными остатками третьего, пятого и шестого доменов. Другой функционально важный центр - область взаимодействия с G-белками, участвующими в формировании клеточного ответа. Остатки серина и треонина в области третьего внутреннего домена и С-конца адренорецептора могут фосфорилироваться под действием протеинкиназы А или специфической киназой р-адренорецептора. Фосфорилирование приводит к изменению конформации рецептора и снижению сродства к G-белку или препятствует связыванию с G-белком.
α-Ацренорецепторы различают по локализации (например, гепатоциты имеют α1-рецепторы, адипоциты - α2-адренорецепторы) и механизму трансформации биологического сигнала. Эффекторные системы, связанные с α1- и α2-адренорецепторами, включают G-белки разного типа
Слайд 8
Рецепторы с тирозинкиназной активностью
Тирозиновые протеинкиназы - ферменты, фосфорилирующие
специфические белки по тирозину, подразделяют на 2 типа -
мембранные (рецепторные) и цитоплазматические. Внутриклеточные тирозиновые протеинкиназы принимают участие в процессах передачи сигнала в ядро. Рецепторные тирозиновые протеинкиназы участвуют в трансмембранной передаче сигналов.
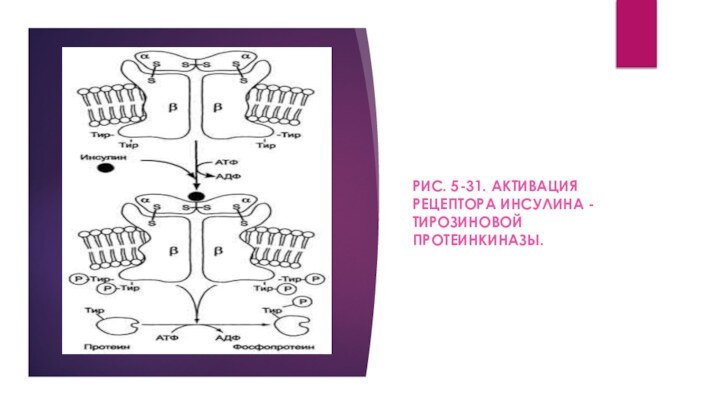
Примером рецепторной тирозиновой протеинкиназы может служить рецептор инсулина (рис. 5-31). Рецептор инсулина - тирозиновая протеинкиназа, фосфорилирующая белки по ОН-группам тирозина.
Рецептор состоит из двух α- и двух β-субъединиц, связанных дисульфидными связями и нековалентными взаимодействиями, α- и β-Субъединицы - гликопротеины с углеводной частью на наружной стороне мембраны. Вне мембраны на её поверхности находятся α-субъединицы. Центр связывания инсулина образован N-концевыми доменами α-субъединиц. β-Субъединицы пронизывают мембранный бислой и не участвуют в связывании инсулина.
Слайд 9
Каталитический центр тирозиновой протеинкиназы находится на внутриклеточных доменах
β-субъединиц. В отсутствие гормона инсулиновые рецепторы не проявляют тирозинкиназной
активности. Присоединение инсулина к центру связывания на α-субъединицах активирует фермент, причём субстратом служит сама тирозиновая протеинкиназа (β-субъединицы), т.е. происходит фоСфорилирование β-субъединицы по нескольким тирозиновым остаткам. Фосфорилирование β-субъединиц происходит по механизму межмолекулярного трансфосфорилирования, т.е. одна β-цепь фосфорилирует другую β-цепь той же молекулы рецептора. Это, в свою очередь, приводит к изменению субстратной специфичности тирозиновой протеинкиназы; теперь она способна фосфорилировать другие внутриклеточные белки. Активация и изменение специфичности обусловлены конформационными изменениями рецептора инсулина после связывания гормона и аутофосфорилирования.
Ключевой белок, фосфорилируемый тирозиновой протеинкиназой, - субстрат инсулинового рецептора-1
Слайд 10
РИС. 5-31. АКТИВАЦИЯ РЕЦЕПТОРА ИНСУЛИНА - ТИРОЗИНОВОЙ ПРОТЕИНКИНАЗЫ.
Слайд 11
Рецепторы с гуанилатциклазной активностью
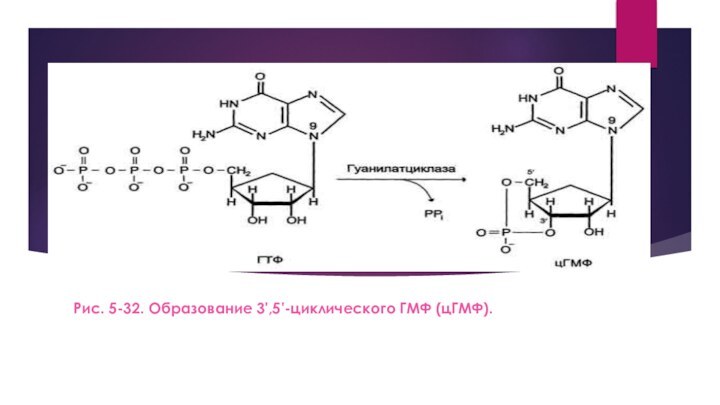
Гуанилатциклаза катализирует образование цГМФ из
ГТФ, одного из важных посредников внутриклеточной передачи сигнала (рис.
5-32, 5-33). Гуанилатциклаза находится в клетке, как в мембранносвязанном состоянии, так и в цитозольном.
Соотношения этих двух форм фермента в различных тканях разное. Например, в клетках тонкого кишечника 90% гуанилатциклазы находится в мембранах, а в лёгких и печени - лишь 20%. Цитозольная и мембранносвязанная гуанилатциклазы различаются не только по локализации, но и по молекулярной массе, активности, способу регуляции.
Цитозольная форма гуанилатциклазы состоит из двух субъединиц (α и β) и содержит в своём составе простетическую группу - гем. В области гема связывается активатор этой формы гуанилатциклазы - оксид азота (NO), образующийся из аргинина под действием фермента синтазы оксида азота
Слайд 12
Рис. 5-32. Образование 3',5'-циклического ГМФ (цГМФ).
Слайд 13
РИС. 5-33. РЕГУЛЯЦИЯ АКТИВНОСТИ МЕМБРАННОЙ (1) И ЦИТОЗОЛЬНОЙ
(2) ГУАНИЛАТЦИКЛАЗЫ.
Слайд 14
Мембраннсювязанная гуанилатциклаза - трансмембранный гликопротеин. Внутриклеточный домен гуанилатциклазы

проявляет каталитическую активность, внеклеточный домен служит рецептором. Присоединение активатора
к рецептору вызывает изменение конформации в мембранном и цитозольном доменах и, как следствие, активацию гуашиатциклазы. В тканях человека присутствуют 3 типа мембранносвязанных гуанилатциклаз, в активации которых принимают участие специфические регуляторы - предсердный натрийуретический фактор (ПНФ), натрийурети-ческий пептид из мозга и кишечный пептид гуанилин.
В клетках тканей выявлены 3 основных типа внутриклеточных рецепторных белков, с которыми взаимодействует цГМФ: цГМФ-зависимая протеинкиназа (протеинкиназа G), цГМФ-регулируемые ионные каналы и цГМФ-регулируемая фосфодиэстераза, специфичная к цАМФ (катализирует превращение цАМФ в АМФ).
цГМФ играет важную роль в регуляции Са2+-гомеостаза в различных типах клеток. Повышение концентрации цГМФ приводит к понижению концентрации Са2+ как в результате активации Са2+-АТФ-аз, так и за счёт подавления рецепторзависимого поступления этого иона в цитоплазму клетки. Эти эффекты опосредованы действием протеинкиназы G на мембранные белки, участвующие в обмене Са2+.
Слайд 15
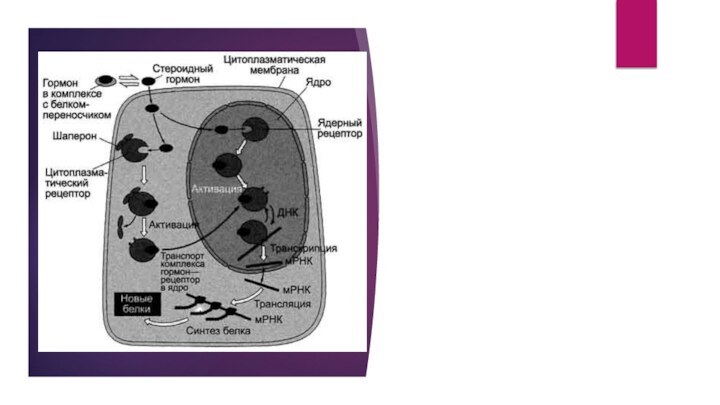
Передача сигнала с помощью внутриклеточных рецепторов
Передача сигнала липидорастворимых
стероидных гормонов и тироксина возможна только при прохождении этих
гормонов через плазматическую мембрану клеток-мишеней (рис. 5-43).
Рецепторы гормонов могут находиться в цитозоле или в ядре. Цитозольные рецепторы связаны с белком-шапероном (часто это группа белков-шаперонов). Ядерные и цитозольные рецепторы стероидных и тиреоидных гормонов содержат ДНК-связывающий домен, характеризующийся наличием двух структур "цинковых пальцев".
Слайд 17
Последовательность событий, приводящих к активации транскрипции:
гормон проходит через
двойной липидный слой клеточной мембраны.
взаимодействие гормона с рецептором (R)
приводит к изменению конформации рецептора и снижению сродства к белкам-шаперонам, отделяющимся от комплекса гормон-рецептор.
комплекс гормон-рецептор проходит в ядро, взаимодействует с регуляторной нуклеотид-ной последовательностью в ДНК - энхансером или сайленсером.
увеличивается (при взаимодействии с энхансером) или уменьшается (при взаимодействии с сайленсером) доступность промотора для РНК-полиМеразы.
соответственно увеличивается или уменьшается скорость транскрипции структурных генов.
увеличивается или уменьшается скорость трансляции.
изменяется количество белков, которые могут влиять на метаболизм и функциональное состояние клетки.
Слайд 18
Цитокины — небольшие пептидные информационные молекулы. Цитокины имеют молекулярную массу, не
превышающую 30 кD.
Цитокин выделяется на поверхность клетки А и
взаимодействует с рецептором находящейся рядом клетки В. Таким образом, от клетки А к клетке В передается сигнал, который запускает в клетке В дальнейшие реакции.
Их основными продуцентами являются лимфоциты.
Кроме лимфоцитов их секретируют макрофаги, гранулоциты, ретикулярные фибробласты, эндотелиальные клетки и другие типы клеток.воздействия.
Они регулируют межклеточные и межсистемные взаимодействия, определяют выживаемость клеток, стимуляцию или подавление их роста, дифференциацию, функциональную активность и апоптоз, а также обеспечивают согласованность действия иммунной, эндокринной и нервной систем в нормальных условиях и в ответ на патологические
Слайд 19
Группировка цитокинов по механизму действия позволяет разделить цитокины
на следующие группы:
провоспалительные, обеспечивающие мобилизацию воспалительного ответа
противовоспалительные, ограничивающие
развитие воспаления
регуляторы клеточного и гуморального иммунитета — (естественного или специфического), обладающие собственными эффекторными функциями (противовирусными, цитотоксическими).
Слайд 20
Факторы роста
В поддержании жизни высших организмов ключевую роль
играет контроль пролиферации ,дифференцировки и направленного движения клеток . Нормальное протекание этих процессов обеспечивает
правильные развитие и защитные реакции организма. Постоянно регенерирующие ткани (например эпителий или клетки крови) также требуют строгой регуляции пролиферации стволовых клеток. Утрата или ослабление контроля могут быть причиной тяжелых заболеваний, включая рак иатеросклероз . Необходимая регуляция клеточной пролиферации, дифференцировки и клеточной подвижности осуществляется с помощью различных механизмов. Одним из них является взаимодействие клетки с ростовыми факторами.