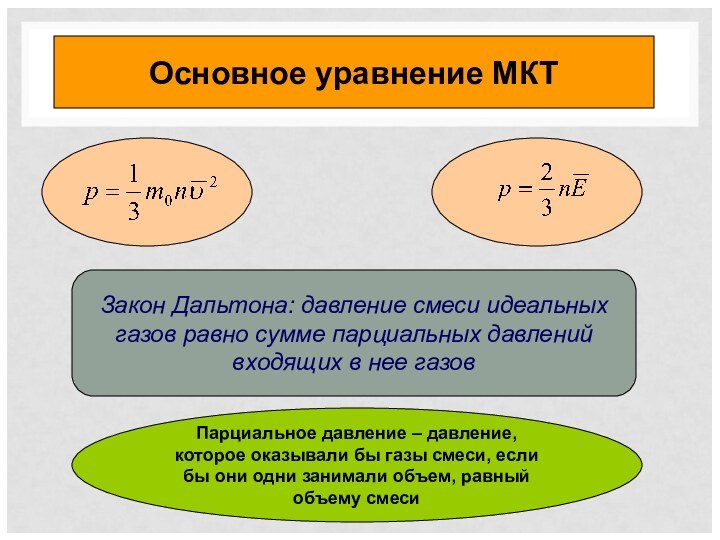
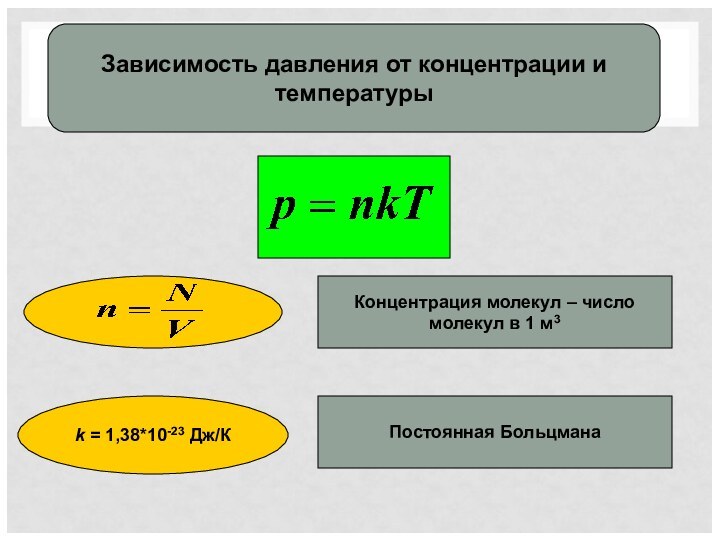
уравнение МКТ идеального газа. Связь давления со средней кинетической
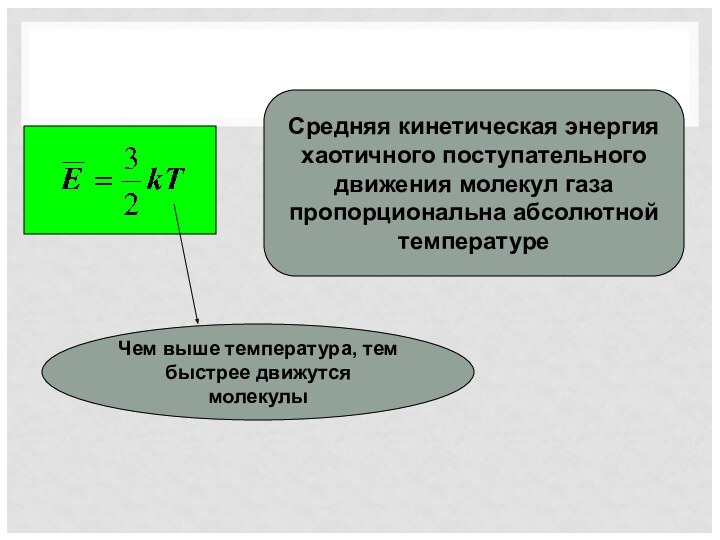
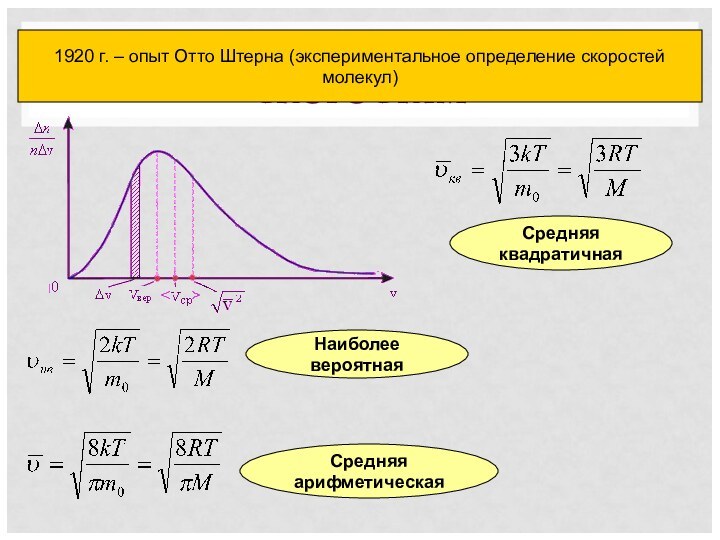
энергией. Закон ДальтонаАбсолютная температура как мера средней кинетической энергии частиц
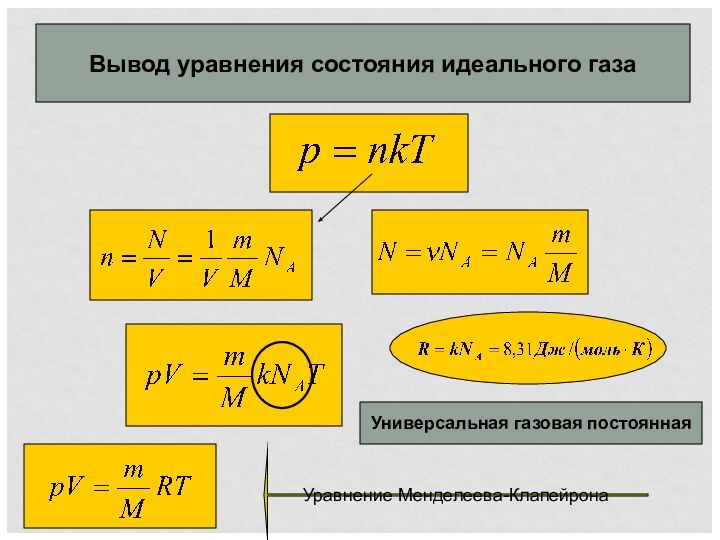
Уравнение состояния
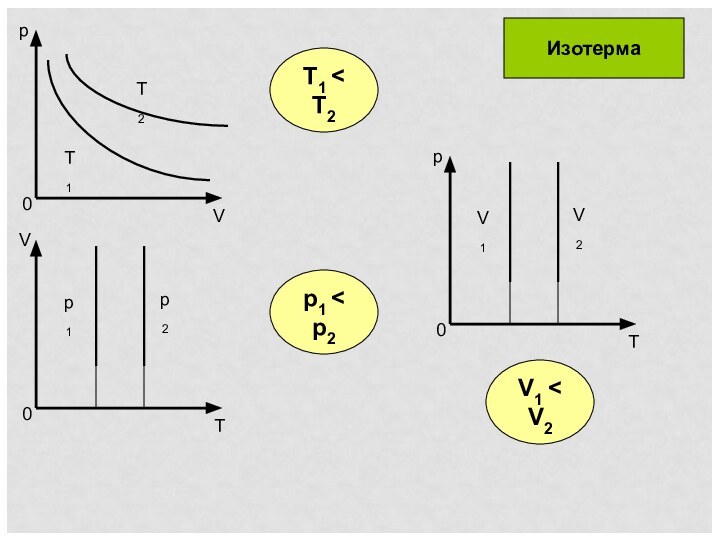
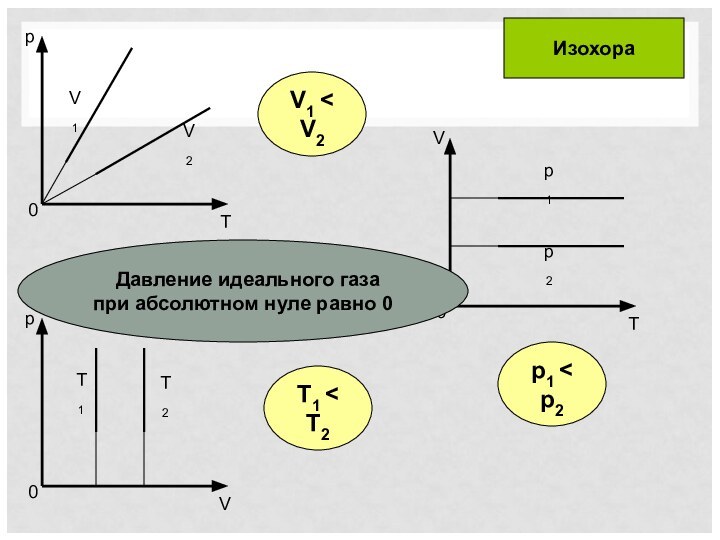
Изопроцессы
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


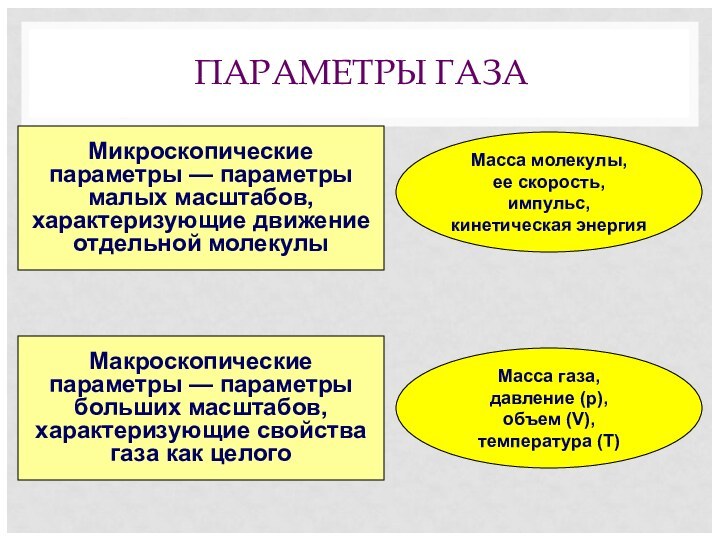



Масса газа,
давление (p),
объем (V), температура (T)
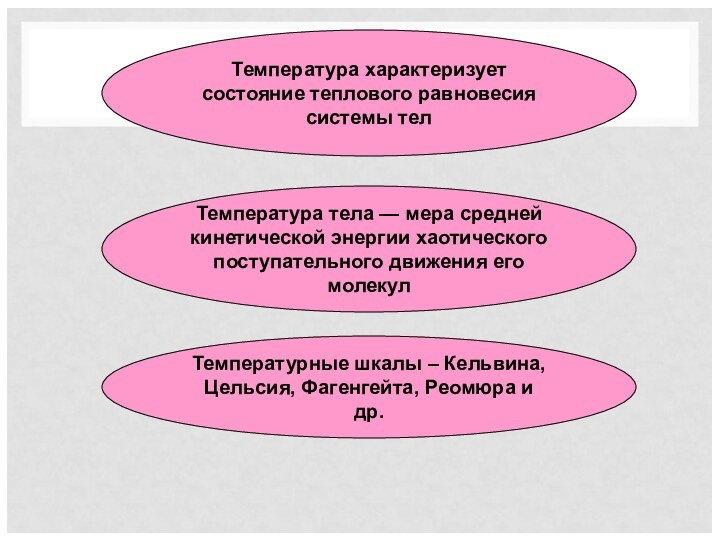
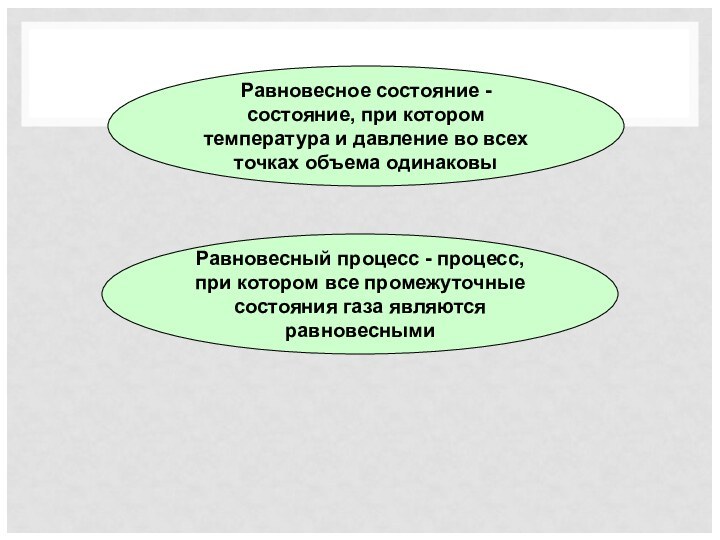
Тепловым равновесием называют такое состояние тел, при котором все макроскопические параметры сколь угодно долго остаются неизменными
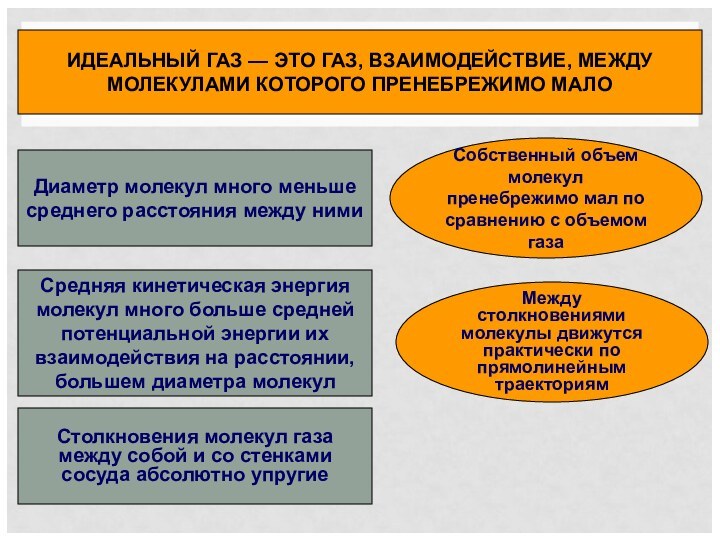
Собственный объем молекул пренебрежимо мал по сравнению с объемом газа
Средняя кинетическая энергия молекул много больше средней потенциальной энергии их взаимодействия на расстоянии, большем диаметра молекул
Столкновения молекул газа между собой и со стенками сосуда абсолютно упругие
Между столкновениями молекулы движутся практически по прямолинейным траекториям
Температурные шкалы – Кельвина, Цельсия, Фагенгейта, Реомюра и др.
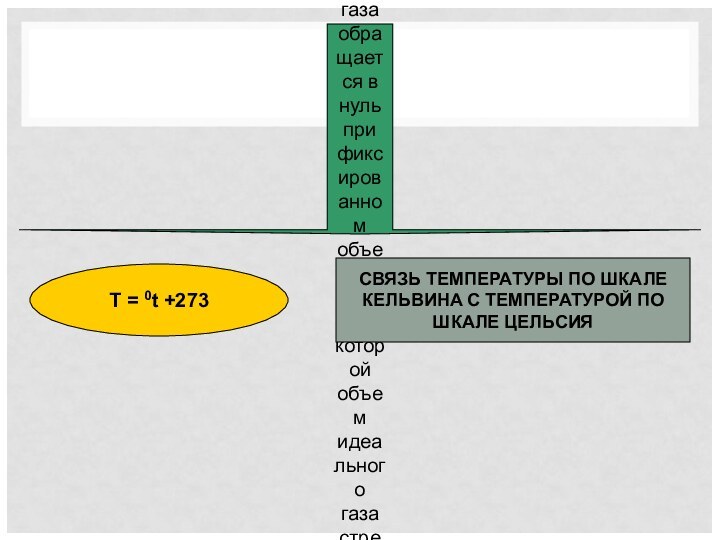
T = 0t +273
СВЯЗЬ ТЕМПЕРАТУРЫ ПО ШКАЛЕ КЕЛЬВИНА С ТЕМПЕРАТУРОЙ ПО ШКАЛЕ ЦЕЛЬСИЯ
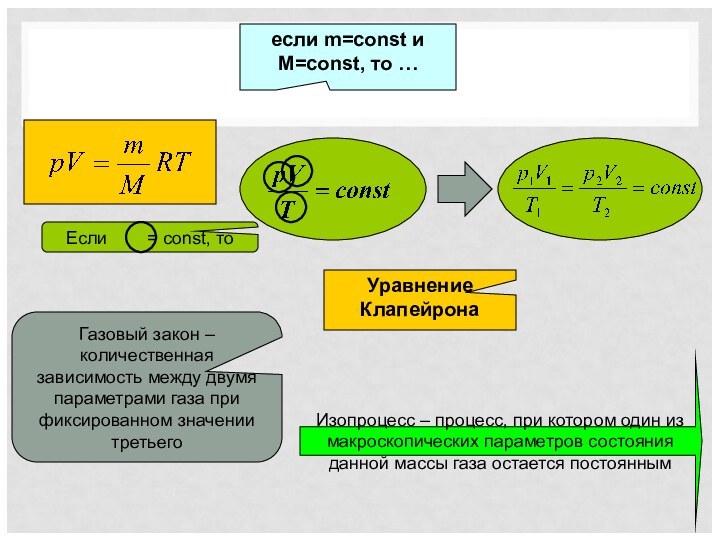
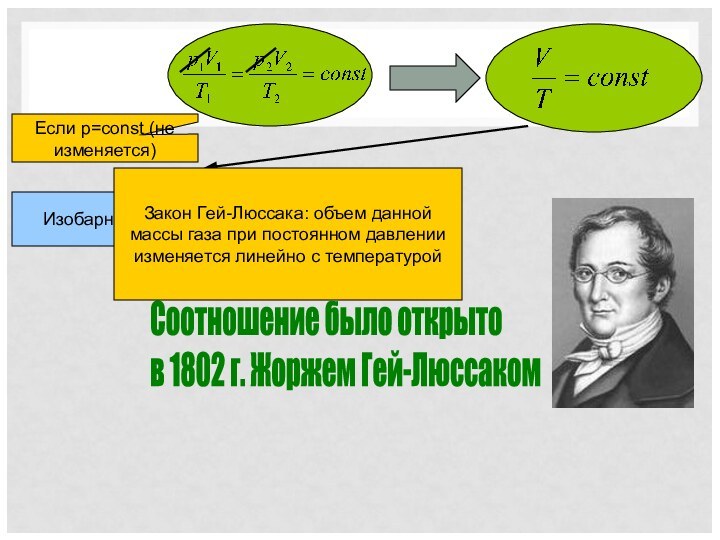
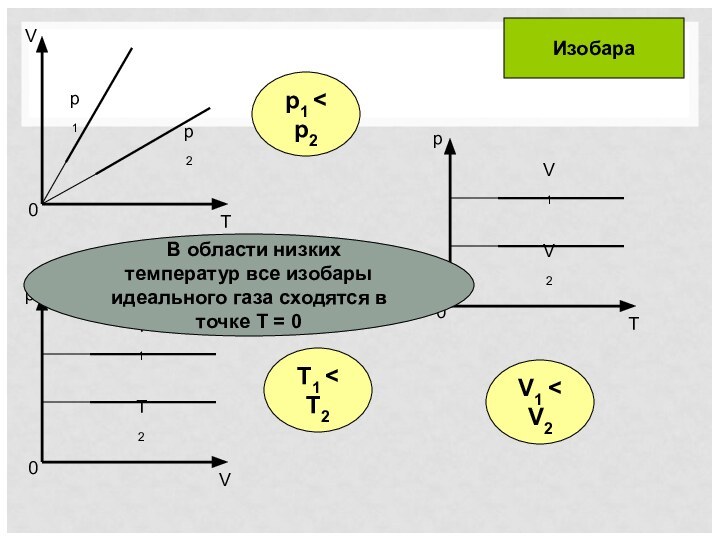
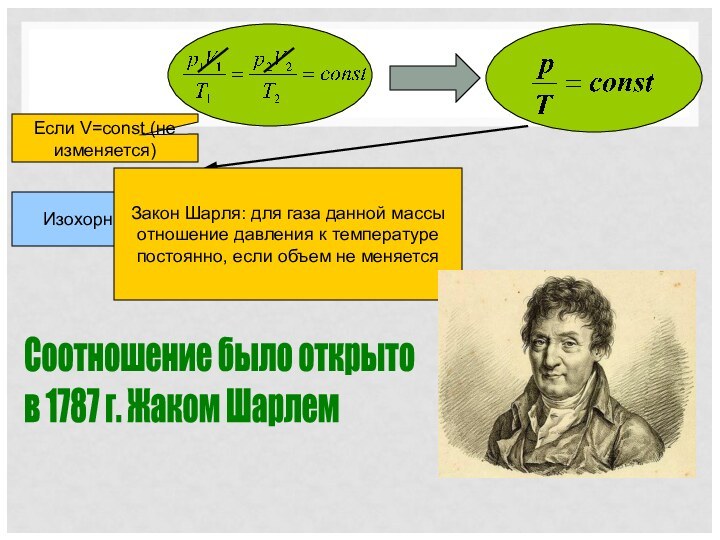
Изопроцесс – процесс, при котором один из макроскопических параметров состояния данной массы газа остается постоянным
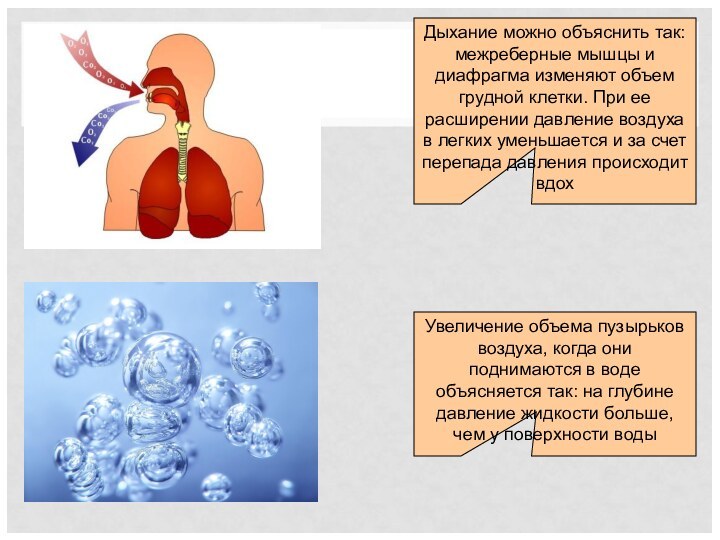
Увеличение объема пузырьков воздуха, когда они поднимаются в воде объясняется так: на глубине давление жидкости больше, чем у поверхности воды