Слайд 2
I. Введение
I. Электрический ток в растворах электролитов
Вещества, растворы

которых проводят электрический ток, называются электролитами. Электрический ток в
жидких проводниках—в растворах электролитов (растворах солей, кислот, щелочей и др.) представляет собой поток заряженных частиц вещества — ионов. Ионы возникают в растворе вследствие взаимодействия молекул растворяемого вещества с молекулами растворителя (воды).
Ионы в растворах электролитов, как и свободные электроны в металлах, движутся беспорядочно. Но когда электроды присоединяют к полюсам источника тока, в растворе возникает электрическое поле. Под воздействием поля ионы, сохраняя хаотическое движение, одновременно начинают двигаться в определенном направлении. Положительные ионы направляются к электроду, соединенному с отрицательным полюсом источника (катоду), а отрицательные ионы — к электроду, соединенному с положительным полюсом (аноду). Дойдя до соответствующих электродов, ионы отдают им свои заряды и, став атомами или молекулами, выделяются на электродах или вступают в химические реакции.
При растворении электролита в жидкости, например хлорида натрия в воде, взаимодействие молекул жидкости с молекулами электролита ослабляет связь между частями молекул электролита, и некоторые из них разделяются на положительные и отрицательные ионы. Разделение молекул электролита на ионы происходит за счет энергии теплового движения молекул. В электрическом поле ионы электролита приходят в движение: положительные ионы движутся к катоду, отрицательные — к аноду. Так возникает электрический ток в электролите.
При повышении температуры кинетическая энергия движения молекул возрастает, что приводит к увеличению числа пар образующихся ионов, то есть к увеличению концентрации электролита. Из-за увеличения концентрации ионов значение электрического сопротивления электролита с повышением температуры уменьшается.
В данной исследовательской работе проводились опыты по определению зависимости силы тока от напряжения в водных растворах в зависимости от температуры, концентрации электролита и рода вещества раствора.
Цель данной работы – выяснить, насколько используемая человеком вода является чистой, и сделать сравнительный анализ используемой воды.
Слайд 3
II. Исследование электропроводности водных растворов.
Условия проведения опыта
Для проведения
опытов использовались дождевая, речная и водопроводная вода, раствор поваренной
соли (NaCl).
Электрическое поле в растворе создавалось с помощью выпрямителя В24, прибора для электролиза (вместо угольных стержней использовались медные электроды).
Силу тока измеряли школьным лабораторным миллиамперметром.
Температуру измеряли лабораторным термометром.
Слайд 4
1).Исследование зависимости электропроводности от рода вещества
Слайд 5
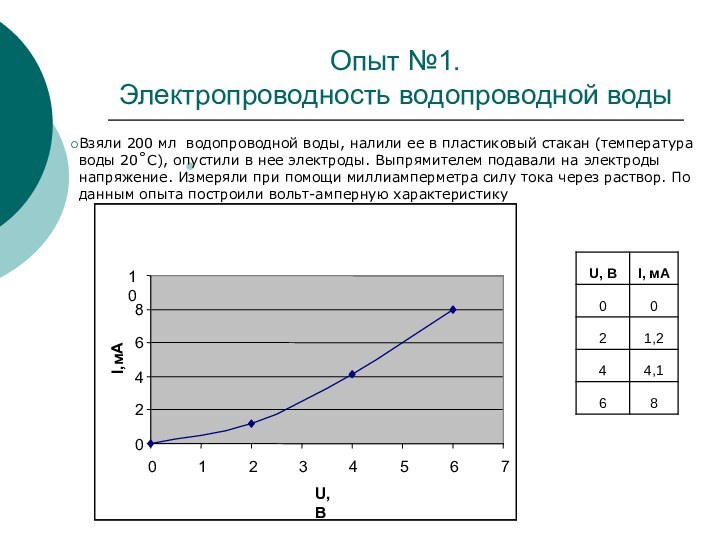
Опыт №1.
Электропроводность водопроводной воды
Взяли 200 мл водопроводной воды, налили ее в пластиковый стакан (температура воды 20˚С), опустили в нее электроды. Выпрямителем подавали на электроды напряжение. Измеряли при помощи миллиамперметра силу тока через раствор. По данным опыта построили вольт-амперную характеристику
Слайд 6
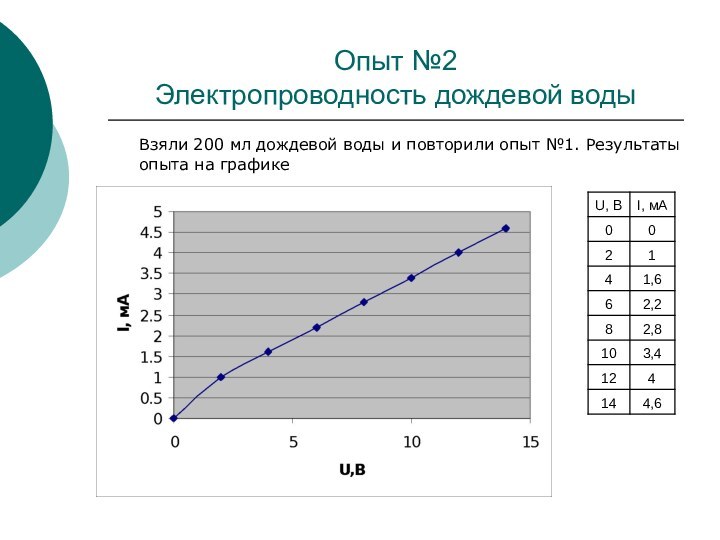
Опыт №2
Электропроводность дождевой воды
Взяли 200 мл дождевой
воды и повторили опыт №1. Результаты опыта на графике
Слайд 7
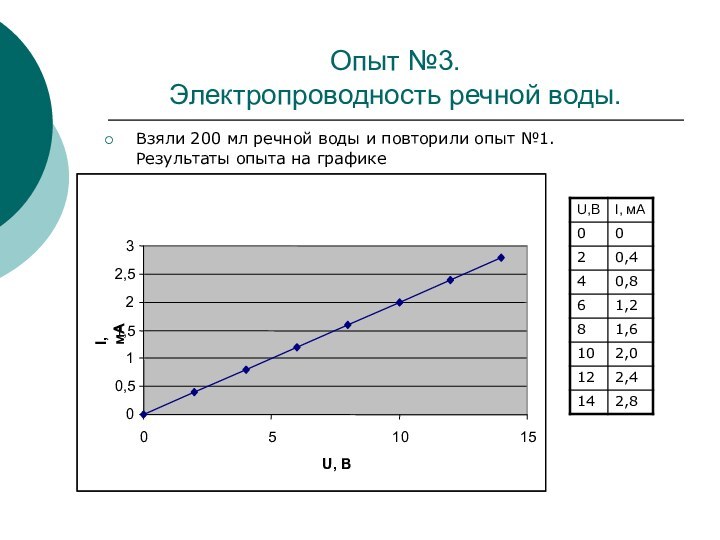
Опыт №3.
Электропроводность речной воды.
Взяли 200 мл речной воды
и повторили опыт №1. Результаты опыта на графике
Слайд 8
Выводы о зависимости электропроводности от рода вещества
По результатам
этих опытов делаем выводы:
вода исследуемых видов не является
чистой, так как обладает определенной электропроводностью.
наибольшей электропроводностью обладает водопроводная вода; средней электропроводностью -дождевая вода, а наименьшую электропроводность имеет речная вода.
Слайд 9
2) Исследование зависимости
электропроводности от
концентрации электролита.
Слайд 10
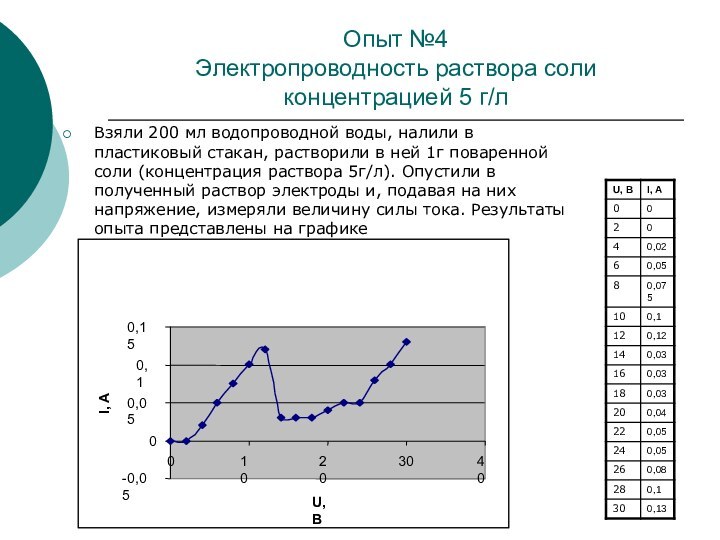
Опыт №4
Электропроводность раствора соли концентрацией 5 г/л
Взяли
200 мл водопроводной воды, налили в пластиковый стакан, растворили
в ней 1г поваренной соли (концентрация раствора 5г/л). Опустили в полученный раствор электроды и, подавая на них напряжение, измеряли величину силы тока. Результаты опыта представлены на графике
Слайд 11
В последующих опытах увеличивали концентрацию раствора от 5
г/л до 20 г/л. Результаты этих опытов представлены соответственно
на графиках №№5, 6, 7.
Слайд 12
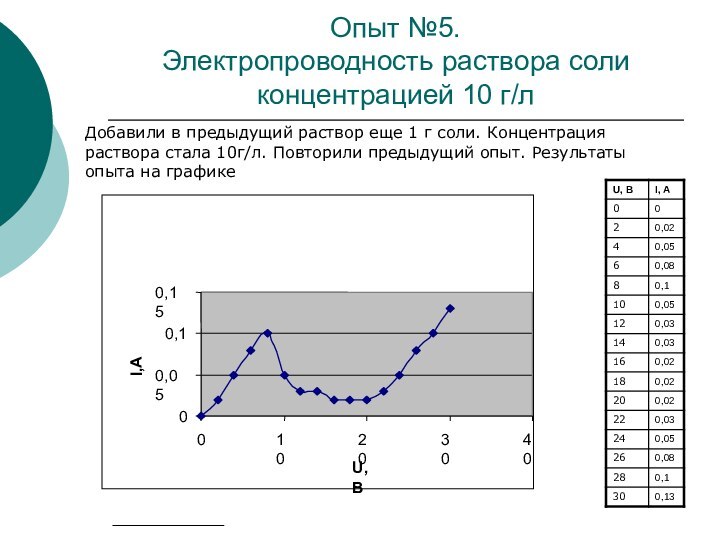
Опыт №5.
Электропроводность раствора соли концентрацией 10 г/л
Добавили
в предыдущий раствор еще 1 г соли. Концентрация раствора
стала 10г/л. Повторили предыдущий опыт. Результаты опыта на графике
Слайд 13
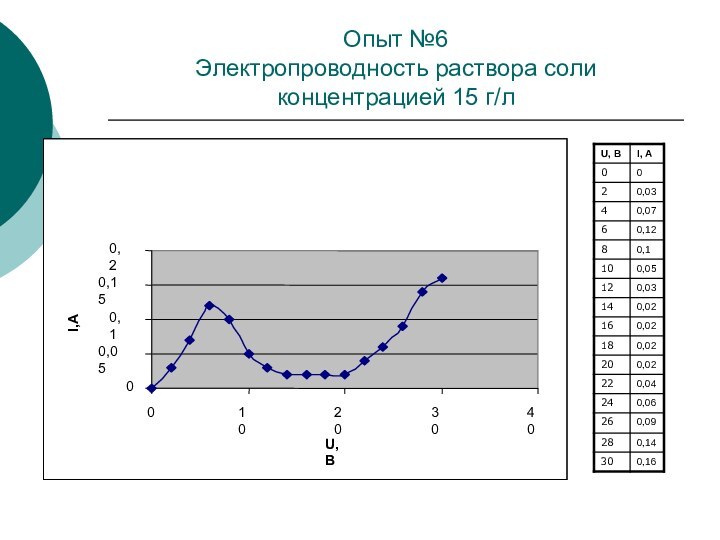
Опыт №6
Электропроводность раствора соли концентрацией 15 г/л
Слайд 14
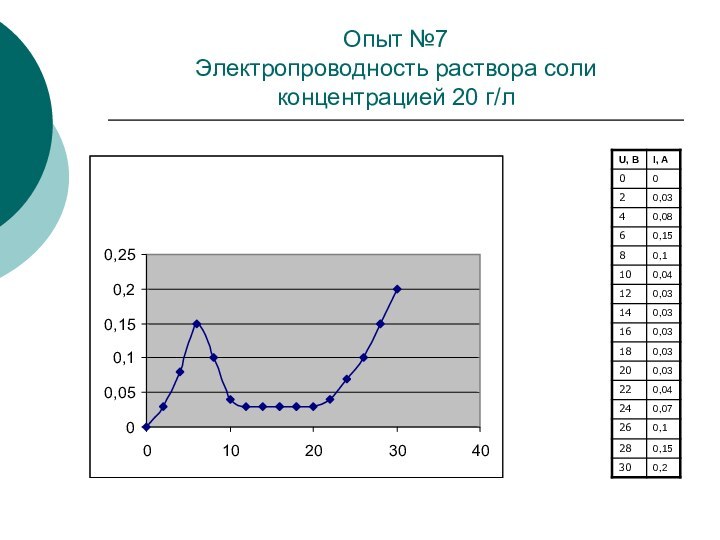
Опыт №7
Электропроводность раствора соли концентрацией 20 г/л
Слайд 15
Выводы о зависимости электропроводности от концентрации электролита
По результатам
опытов 4 – 7 делаем вывод:
при повышении концентрации
электролита электропроводность раствора возрастает.
При проведении этих опытов обнаружено интересное явление – при концентрации 25 г/л электропроводность раствора может резко увеличиваться даже при неизменном подаваемом напряжении.
Слайд 16
3) Исследование зависимости
электропроводности от температуры
Слайд 17
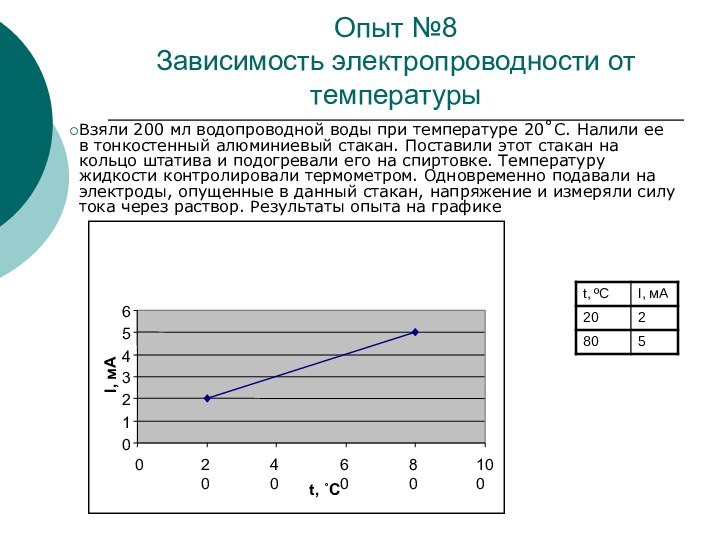
Опыт №8
Зависимость электропроводности от температуры
Взяли 200 мл
водопроводной воды при температуре 20˚С. Налили ее в тонкостенный
алюминиевый стакан. Поставили этот стакан на кольцо штатива и подогревали его на спиртовке. Температуру жидкости контролировали термометром. Одновременно подавали на электроды, опущенные в данный стакан, напряжение и измеряли силу тока через раствор. Результаты опыта на графике
Слайд 18
Выводы о зависимости электропроводности от температуры
при повышении температуры
электропроводность раствора возрастает
Слайд 19
III. Заключение.
Данная работа показала, что абсолютно чистой воды
в природе не существует. Любая вода в той или
иной степени содержит в себе растворы других веществ, это обуславливает ее электропроводность. Хотя в сравнении с металлами эта электропроводность невелика.
Результаты работы подтверждают необходимость соблюдения ТБ при выполнении работ с электроприборами: нельзя выполнять данные работы мокрыми руками или в сырых помещениях, так как существует опасность поражения электрическим током.