Слайд 2
Цели и задачи
1. Познакомить учащихся с взглядами на
строение атома, существовавших до начала XIX века.
2. Рассказать о
ядерной модели атома Резерфорда
3.Показать, чем отличаются друг от друга атомы различных химических элементов.
4. Показать строение атомов водорода, дейтерия, трития.
Слайд 3
Взгляды учёных на строение атома
В начале XIX века
в физике бытовали самые разные и часто фантастические представления
о строении атома.
Например, ректор Мюнхенского университета Фердинанд Линдеман в 1905 году утверждал, что « атом кислорода имеет форму кольца, а атом серы – форму лепёшки».
Слайд 4
Модель атома по Дж. Томсону.
Дж.
Томсон в 1898 году предложил модель атома в виде
положительно заряженного шара радиусом 10-10 м, в котором « плавают» отрицательные электроны, размеры которых 10-13 м. Сам Томсон относился к своим моделям без энтузиазма.
Слайд 5
Русские физики
Вопрос о строении атома изучали и русские
физики:
Пётр Николаевич Лебедев
И известный учёный – народник
Николай Морозов
Слайд 6
Атом, атомная физика, атомный век…
Мы
чуть не с пелёнок слышим со всех сторон: атом,
атомная физика, атомная энергия, атомная электростанция, атомная подводная лодка, атомный век…
Известно, что атомы – это крошечные частички, из которых состоит всё на свете: воздух, вода, земля, еда, Солнце, звёзды…
Слайд 7
Опыты Резерфорда.
В 1911 году Резерфорд со своими
сотрудниками провёл ряд опытов по исследованию состава и строения
атомов.
Слайд 8
Строим модель атома. Как выглядит атом? Что у
него внутри?
Если изобразить «детали» из которых состоит атом, пластилиновыми
шариками:
Красный – протон,
зелёный – нейтрон,
синий - электрон
Слайд 9
Модель самого простого атома.
Возьмём красный шарик - протон
и синий – электрон и соединим их ниткой.
Протон –
частица неповоротливая, он в две тысячи раз тяжелее электрона. Неудивительно, что протон «сидит»в центре атома, а легкий и непоседливый электрон крутится вокруг него, словно спутник вокруг Земли.
Слайд 10
Модель атома самого лёгкого газа.
Самый лёгкий газ –
водород. Он в 15 раз легче воздуха, поэтому наполненный
водородом дирижабль всплывает в воздушном океане, словно поплавок
Слайд 11
« Воздушные шарики»
Шары, которые подняли в воздух одного
из героев сказки Юрия Олеши «Три толстяка», были наполнены
водородом…
Слайд 12
Дейтерий
Лёгкий водород можно сделать потяжелее, если присоединить к
протону нейтрон. Вот теперь в атоме все три детали:
протон, нейтрон и электрон. Это тяжёлый водород - дейтерий.
Слайд 13
Тритий
Но можно сделать водород ещё тяжелее, присоединив
к протону не один, а два нейтрона – получаем
сверхтяжёлый водород – тритий.
Слайд 14
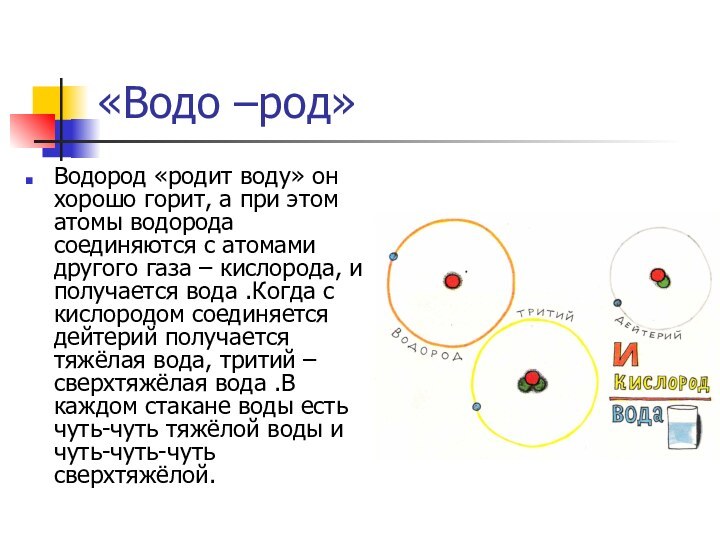
«Водо –род»
Водород «родит воду» он хорошо горит, а
при этом атомы водорода соединяются с атомами другого газа
– кислорода, и получается вода .Когда с кислородом соединяется дейтерий получается тяжёлая вода, тритий – сверхтяжёлая вода .В каждом стакане воды есть чуть-чуть тяжёлой воды и чуть-чуть-чуть сверхтяжёлой.
Слайд 15
Модель атома гелия
Если теперь в ядре атома будет
два протона, два нейтрона, а вокруг них будут вращаться
два электрона, то получим модель атома совсем другого газа – гелия.
Слайд 17
Чем отличаются приведённые модели атомов?