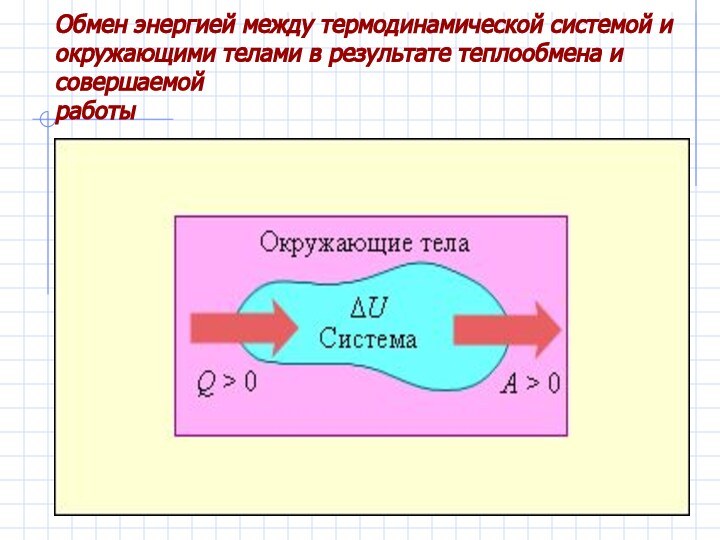
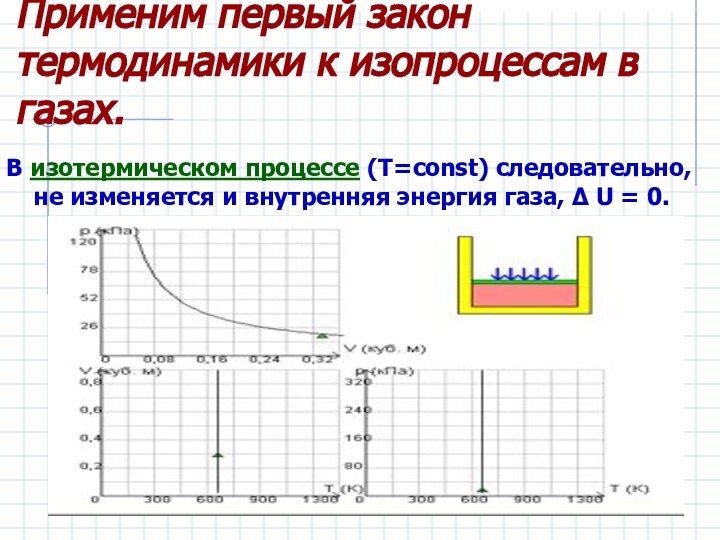
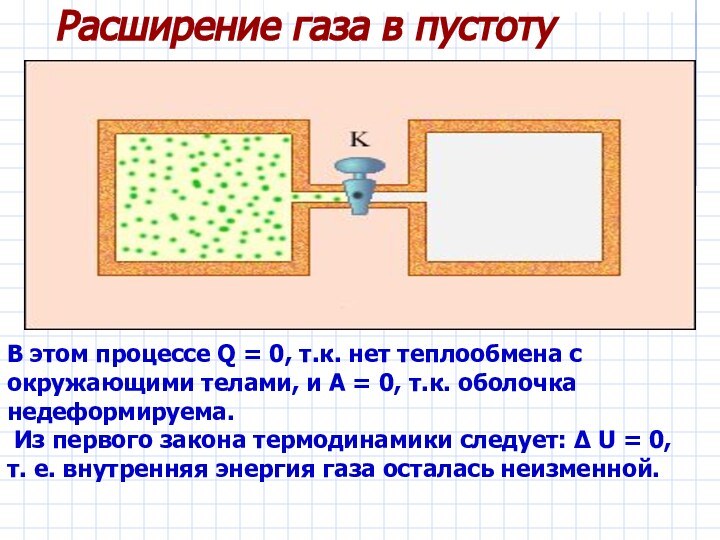
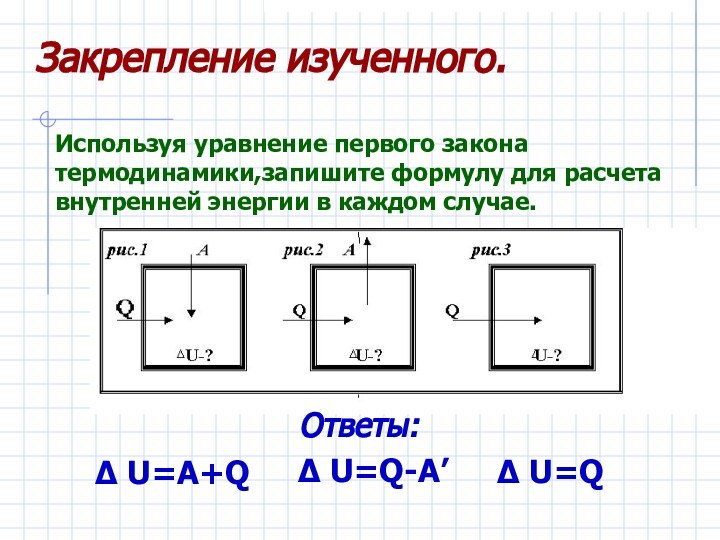
– первый закон термодинамики.
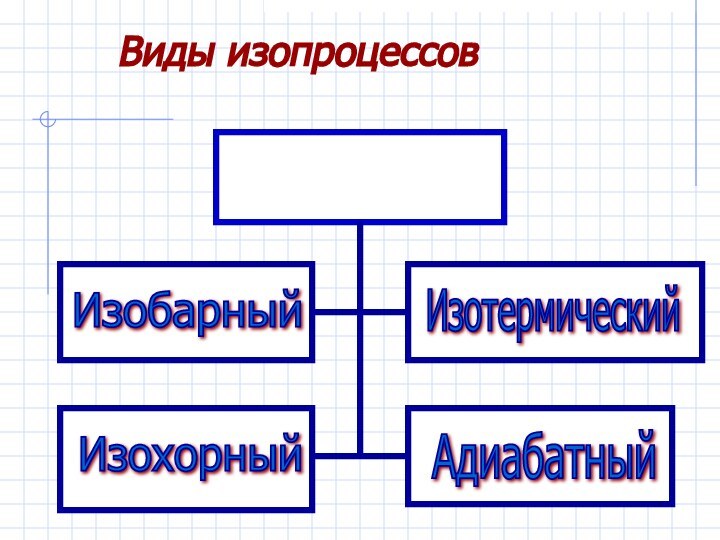
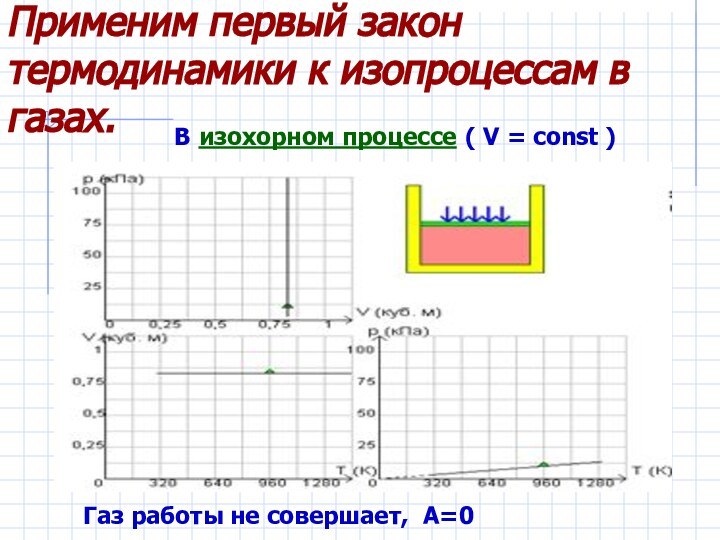
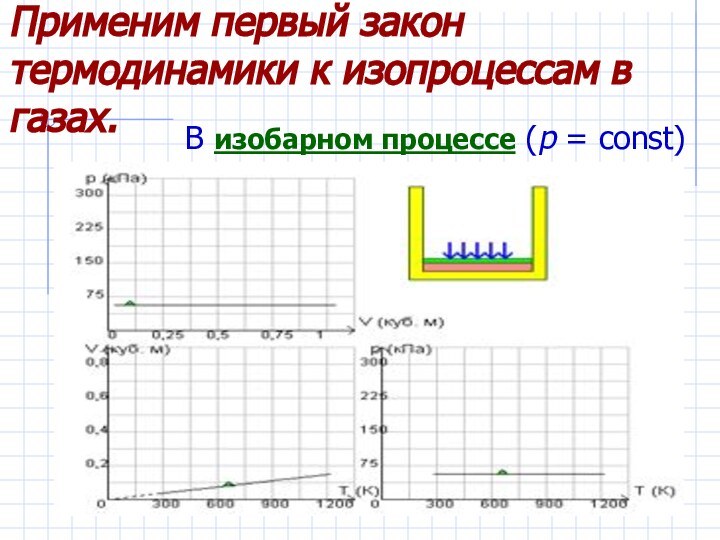
Рассмотреть изопроцессы в газах с энергетической
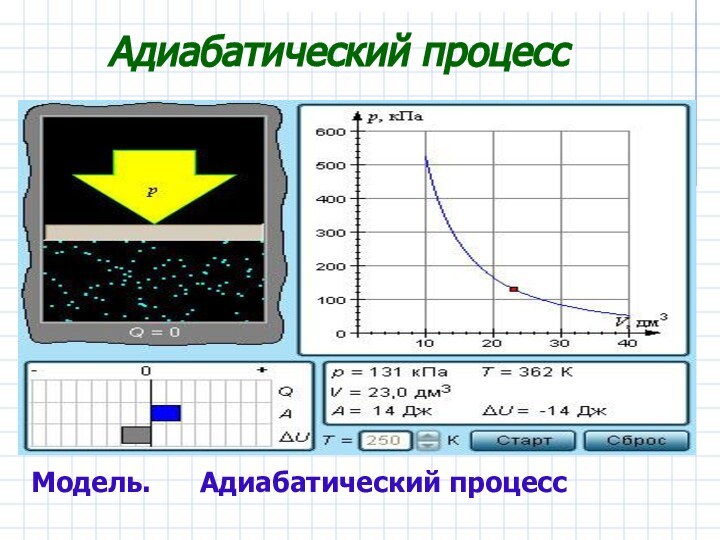
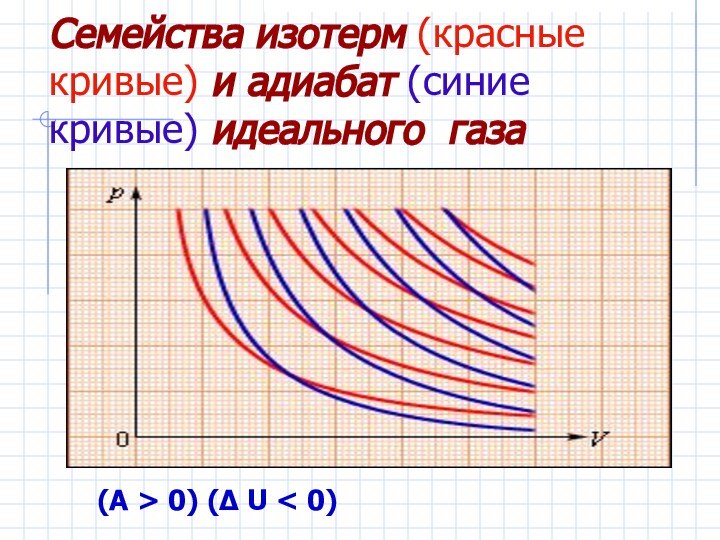
точки зрения, примененив к ним первый закон термодинамики.Дать понятие адиабатического процесса.
Цели