Слайд 2
Жидкостное травление
Травлением в жидких средах (или химичес-
ким
травлением) называется процесс перено-
са вещества из твёрдой фазы в
жидкую, т.е.
растворение вещества подложки или техно-
логических слоев химическими реактивами
(щелочами, кислотами и их солями), называе-
мыми травителями.
Слайд 3
Цели процессов химического травления
удаление с поверхности полупроводниковой под-ложки
механически нарушенного слоя;
снятие с полупроводниковой подложки слоя ис-ходного материала
определённой толщины;
локальное удаление материала подложки или технологического слоя с определённых участков поверхности;
создание определённых электрофизических свойств обрабатываемой поверхности подлож-ки;
выявление структурных дефектов кристалли-ческой решётки полупроводниковой подложки;
получение мезаструктур.
Слайд 4
Методы травления полупроводников
- Изотропное травление;
- Анизотропное травление;
- Селективное
травление;
- Локальное травление;
- Послойное травление.
Слайд 5
Изотропное травление – растворение полупроводника с
одинаковой скоростью
травления по всем направлениям мо-
нокристаллической подложки. Применяют для удаления
на-
рушенного поверхностного слоя и полирования поверхности.
Анизотропное травление – растворение полупроводника
с различной скоростью по разным направлениям монокрис-
таллической подложки. Используют для выявления струк-
турных поверхностных и объёмных дефектов.
Селективное травление – растворение полупроводника с
различной скоростью на разных участках поверхности с од-
ной и той же кристаллографической ориентацией (либо с
различными скоростями травления слоёв разного химичес-
кого состава в избирательных травителях). Позволяет вы-
являть дефекты и несовершенства кристаллической струк-
туры подложек (дислокации, дефекты упаковки, границы зе-
рен и др.), а также p–n–переходы и различные фазовые вклю-
чения;
Слайд 6
Локальное травление – удаление материала со строго
ограниченных
и заданных участков подложки. Обеспечи-
вает получение элементов требуемой конфигурации
и за-
данного рельефа на поверхности подложек. Позволяет
создавать необходимый рисунок микросхемы (создавать
заданную конфигурацию технологических слоёв, прово-
дить мезатравление). Для локального химического трав-
ления используют изотропные и анизотропные травите-
ли.
Послойное травление – равномерное последовательное
снятие тонких поверхностных слоёв полупроводника.При-
меняют для изучения поверхностных и объёмных дефек-
тов кристаллической структуры подложек и эпитакси-
альных слоёв. Используют полирующие травители с ма-
лой скоростью травления (менее 0,1 мкм/мин).
Слайд 7
Типы растворения вещества
По характеру взаимодействия с веществом химическое

трав-
ление является реакцией растворения. Различают три типа
растворения.
1. Молекулярное
растворение – химическая формула раство-
ряемого вещества в исходном состоянии и в растворе полнос-
тью идентична. После удаления (испарения) растворителя рас-
творенноё вещество может быть выделено в химически неиз-
менном виде.
2. Ионное растворение – исходное состояние вещества и его
состояние в растворе не идентичны. В растворе происходит
растворение ионного кристалла на катионы и анионы, которые
окружены сольватационными оболочками (например, полярны-
ми молекулами воды), которые обеспечивают устойчивость
таких растворов. После удаления растворителя растворённоё
вещество может быть получено в химически неизменном виде.
3. Реактивное растворение - растворение сопровождается
химическим взаимодействием между растворённым вещест-
вом и растворителем, в растворе существуют продукты реак-
ции, химически отличные от исходного состояния системы.
Удаление остатков растворителя не позволяет получить рас-
творённое вещество в исходном состоянии.
Слайд 8
Кинетика процессов травления
Все процессы травления полупроводниковых
ма-
териалов являются реактивными. При этом про-
цесс травления может быть
представлен в виде
пяти стадий:
1. Перенос молекул (ионов) травителя из объё-
ма раствора к поверхности полупроводника;
2. Адсорбция молекул травителя на поверхнос-
ти полупроводника;
3. Кинетическая стадия процесса;
4. Десорбция продуктов реакции с поверхности полупроводника.
5. Удаление продуктов реакции с поверхности полупроводника в объём раствора.
Слайд 9
1. Перенос молекул (ионов) из
объёма раствора
В начальный момент травления за счёт ин-
тенсивной реакции вблизи
поверхности плас-
тины полупроводника образуется слой, обед-
ненный молекулами травителя. Это приво-
дит к возникновению градиента концентра-
ции травителя и возникновению диффузион-
ного потока этих молекул к поверхности по-
лупроводника.
Слайд 10
2. Адсорбция молекул травителя
На данной стадии
молекулы травителя всту-
пают в контакт с поверхностью полупроводни-
ка. Этот
контакт может являться либо хими-
ческой адсорбцией, либо физической адсорбцией.
В случае химической адсорбции в зависимости
от типа поверхности и адсорбированных ком-
понентов между молекулами травителя и по-
верхностью полупроводника возникают либо си-
лы обменного взаимодействия, либо силы куло-
новского притяжения. В случае физической ад-
сорбции молекулы травителя удерживаются на
поверхности силами Ван–дер–Ваальса.
Слайд 11
3. Кинетическая стадия процесса.
Данная стадия представляет собой
собст-
венно химическое взаимодействие адсорби-
рованных молекул травителя с полупровод-
ником. Происходит
разрыв химических связей
между атомами, расположенными в объёме
и поверхностными атомами полупроводника
с последующим переходом последних в раст-
вор.
Слайд 12
4. Десорбция продуктов реакции
В ходе кинетической стадии на
поверхнос-
ти полупроводника накапливаются продук-
ты реакции, которые могут быть химичес-
ки
или физически связаны с ней. Прежде чем
перевести их в раствор, необходимо эти свя-
зи разрушить.
Слайд 13
5. Удаление продуктов реакции в
объём раствора
Вблизи поверхности
полупроводника накаплива-
ются продукты реакции, концентрация которых в
объёме раствора
существенно меньше, чем на гра-
нице полупроводник – раствор. Возникает градиент
концентрации продуктов травления, обусловливаю-
щий возникновение диффузионного потока молекул
этих продуктов, направленного от поверхности по-
лупроводника в объём раствора. Данная стадия яв-
ляется аналогичной стадии 1 с той лишь разницей,
Что происходит диффузионный перенос в объём рас-
твора не молекул травителя, а продуктов его взаи-
модействия с полуроводником подложки.
Слайд 14
Травление с диффузионным контролем
В данном случае скорость процесса
травления никак
не связана со свойствами поверхности полупроводни-
ка. Поэтому
травление должно протекать изотроп-
но, независимо от кристаллографического направле-
ния, а поверхность полупроводника должна быть глад-
кой.
Травители являются интегральными, а процесс – по-
лирующим. Усилить полирующие свойства травите-
лей можно уменьшением скорости протекания в них
диффузионных процессов за счёт увеличения вязкости
раствора (путём добавки гликолей, глицерина, поли-
спиртов), либо за счёт уменьшения температуры рас-
твора.
Интенсивное перемешивание раствора, наоборот,
снимает диффузионное ограничение и ухудшает поли-
рующие свойства травителя.
Слайд 15
Травление с кинетическим контролем
Скорость травления будет

различной для плоскостей крис-таллов с различной плотностью упаковки
атомов, а само травление будет анизотропным. Для полупроводников с ал-мазоподобной кристаллической решёткой (Si, Ge), как прави-ло, наблюдается следующее соотношение скоростей травле-ния: υ(100)> υ(110)> υ(111).
Если на поверхности подложки имеются дефекты, то в этих местах происходит локальное увеличение скорости травле-ния. «Дефектное» место растравливается с образованием фигуры (ямки) травления, форма которой определяется крис-таллографической ориентацией поверхности подложки. Поэ-тому в данном случае гладкую поверхность получить не уда-ётся. Травители с кинетическим контролем называют диф-ференциальными, а процесс травления – селективным.
С увеличением времени процесса даже селективные трави-тели проявляют тенденцию к выравниванию поверхности. Кроме того, в начальный момент времени процесса травле-ния отсутствует диффузионное ограничение, т.е. все трави-тели работают селективно.
Слайд 16
Механизмы травления полупроводников
При отсутствии электрического поля трав-
ление полупроводников
в жидких средах мо-
жет происходить по двум принципиально раз-
ным
механизмам:
- химическому;
- электрохимическому.
Слайд 17
Особенности химического механизма травления
При химическом механизме травления на
по-
верхности полупроводника протекают окисли-
тельно–восстановительные реакции, обуслов-
ленные непосредственным, чисто химическим
взаимодействием
молекул травителя с поверх-
ностными атомами. При этом все продукты ре-
акции в виде растворимых комплексов полупро-
водника образуются в травителе одновремен-
но.
Процесс травления полупроводников по данно-
му механизму подчиняется законам химической
кинетики гетерогенных реакций.
Слайд 18
Травление кремния в щёлочи
Si + 2H2O → SiO2
+ 2H2↑; (1)
SiO2 + xH2O → SiO2 · xH2O; (2)
SiO2 ·
xH2O + 2KOH → K2SiO3 + (x+1)H2O. (3)
Процесс травления кремния в щёлочи включа-
ет в себя реакции окисления кремния до его дио-
ксида и восстановления воды при нагревании до
молекулярного водорода (1). Наряду с этими
процессами в системе происходит гидратация
SiO2 (2) и взаимодействие со щёлочью гидра-
тированного SiO2 с образованием метасилика-
тов (метасиликата калия) (3).
Слайд 19
Особенности электрохимического механизма травления
При электрохимическом механизме травле-
ния на
поверхности полупроводника протека-
ют две сопряжённые реакции: анодного окис-
ления полупроводника
и катодного восста-
новления окислителя. Электрическая связь
между анодами и катодами осуществляется
через раствор травителя
Пример: травление кремния в смеси кислот
HNO3 – HF.
Слайд 20
Анодные реакции
На микроанодах поверхности протекает анодная
реакция окисления
кремния, а также комплексооб-
разование и перевод в раствор атомов
кремния в
виде устойчивых комплексных анионов.
Схема анодной реакции:
Si + 2H2O + ne+ → SiO2 + 4H+ +(4 – n)e–, (4)
SiO2 + 6HF → H2SiF6 + 2H2O, (5)
где n – эффективная валентность саморастворе-
ния кремния (количество ковалентных связей, удер-
живающих поверхностный атом), которая в зави-
симости от условий протекания реакции может
изменяться от 2 до 4, e+ – дырки, e– – электроны. Анодная реакция сопровождается разрывом кова-
лентных связей поверхностных атомов, при учас-
тии дырок, которые создаются при протекании ка-
тодной реакции.
Слайд 21
Катодные реакции
На микрокатодах поверхности протекает катодная реак-
ция восстановления
основного окислителя (HNO3):
HNO3 + 2H+ + 2e– → HNO2
+ H2O. (6)
Реакция (31.6) протекает в несколько этапов:
HNO3 + HNO2 → 2NO2 + H2O; (7)
NO2 → NO2– + e+; (8)
NO2– + H+ → HNO2 (9)
Наименее медленной стадией является реакция (7),в хо-
де которой из молекул HNO3 регенерируются молекулы диок-
сида азота NO2. Для начала реакции необходимо присутст-
вие в растворе некоторого количества молекул азотистой
кислоты HNO2. Затем происходит её накопление в растворе
согласно реакции (9). В ходе реакции (8) происходит генера-ция дырок за счёт захвата электронов из валентной зоны кремния. Эти дырки затем расходуются в анодном про-
цессе и ответственны за отрыв атомов кремния от поверх-
ности.
Слайд 22
Режимы электрохимического травления
В зависимости от самой медленной стадии
различают
травление под катодным контролем и анодным контролем
Катодный контроль. Скорость
реакции связана только со
стадией восстановления, определяемой интенсивностью
доставки молекул окислителя к катодным участкам и не за-
висит от свойств полупроводника. Катодный контроль яв-
ляется полным аналогом диффузионного ограничения реак-
ции. Травители с катодным контролем работают как поли-
рующие.
Анодный контроль. Анодный процесс связан с отрывом
атомов полупроводника в раствор. Скорость анодной реак-
ции определяется энергией связи поверхностных атомов с
решёткой и зависит от плотности упаковки атомов, на-
личия дефектов, примесей и т.д. Скорость травления при
анодном контроле анизотропна. Анодный контроль явля-
ется аналогом кинетического ограничения. Травители с
анодным контролем работают селективно, поэтому под-
бор их состава в основном определяется свойствами полу-
проводникового материала.
Слайд 23
Материалы, подвергаемые травлению
В качестве материалов, наиболее
часто под-
вергаемых травлению «мокрыми» процесса-
ми, выступают различные функциональные
слои
ИИЭ из:
- диоксида кремния;
- алюминия и его сплавов;
вспомогательные технологические слои из:
- нитрида кремния;
- фоторезиста.
Слайд 24
Травление слоёв SiO2
Для химического травления слоев SiO2 используют,

как пра-
вило, травители на основе HF. Однако в технологии
ИИЭ вод-
ные растворы HF используются, как правило, только для про-
цессов открытого травления SiO2 (полное или частичное уда-
ление слоя SiO2, удаление с поверхности кремния естествен-
ного слоя SiO2 непосредственно перед нанесением металлиза-
ции – т. н. освежение контактов. Это обусловлено интенсив-
ным газовыделением SiF4, приводящим к отслаиванию маски
резиста и искажению геометрии функциональных слоев ИИЭ.
Для локального травления функциональных слоев ИИЭ че-
рез фоторезистивную маску используют так называемые бу-
ферные травители, получаемые добавлением в растворы HF
фторида аммония NH4F. Травление слоев SiO2 в буферном тра-
вителе описывается следующими реакциями:
6HF + SiO2 → H2SiF6 + 2H2O, (10)
H2SiF6 + NH4F → (NH4)2SiF6 + HF. (11)
Добавление NH4F к HF увеличивает скорость травления бла-
годаря образованию бифторид ионов HF2–, обладающих более
высокой реакционной способностью по сравнению с HF.
Слайд 25
Травление нитрида кремния
Химическое травление применяют для полного
удаления
слоев Si3N4 после процессов локального
окисления. Для данной целью
используют плавико-
вую и ортофосфорную кислоты либо их смеси. Химические реакции при удалении Si3N4 данными
травителями :
Si3N4 + 18HF → H2SiF6 + 2(NH4)2SiF6, (12)
3Si3N4 + 27H2O + H3PO4 → 4(NH4)3PO4 + 9H2SiO3. (13)
Слайд 26
Травление плёнок алюминия
Жидкостное химическое травление алюминиевых
слоев осуществляют,
как правило, в травителе, сос-
тоящем из концентрированной азотной, ортофос-
форной,
уксусной кислоты и воды. Процесс травления
состоит из двух стадий - формирования Al3+ и обра-
зования AlPO4 согласно схеме:
(3.19)
Вода в ортофосфорной кислоте препятствует
растворению Al2O3 и способствует растворению
AlPO4. Скорость процесса ограничена скоростью рас-
творения Al2O3 в H3PO4.
В качестве конечных продуктов реакции выделя-
ется газ, состоящий из смеси H2, NO и NO2.
Слайд 27
Жидкостное удаление фоторезиста
Выбор метода снятия резиста и параметров
про
цесса определяется исходя из следующих факторов:
1) чувствительности поверхности нижележащего
слоя
к воздействию растворителя (окисление, корро-
зия, загрязнение ионами, полное растворение);
2) стоимости удаления;
3) типа резиста;
4) предшествующей последовательности опера-
ций формирования слоя резиста, включая характе-
ристики нижележащего слоя, параметры термооб-
работки после экспонирования, задубливания, трав-
ления, ионной имплантации.
Слайд 28
Удаление фоторезиста в
кислотных составах
На стадиях формирования активной
структуры
ИИЭ в фотолитографическом процессе участвуют
химически неактивные слои:
моно-Si, SiO2, Si3N4, поли-
Si. Для снятия фоторезиста в данном случае исполь-
зуют кислотные составы.
Кислотные составы для удаления фоторезиста,
содержат сильные кислоты и сильные окислители,
преобразуют полимерную пленку фоторезиста в
эмульгированную или растворимую форму.
Наиболее широкое распространение для снятия
фоторезиста получила смесь H2SO4 и H2O2 (10:1)-тра-
витель КАРО. Механизм удаления фоторезиста в
смеси КАРО аналогичен механизму удаления органи-
ческих загрязнений.
Слайд 29
Удаление фоторезиста в органических растворителях
На заключительных стадиях изготовления
ИИЭ
(формирование металлических слоев, вскрытие кон-
тактных окон в межслойном
диэлектрике и пасси-
вирующем покрытии) использование кислотных сос-
тавов неприемлемо. Для снятия фоторезиста на
данных этапах используют органические раствори-
тели. Как правило, в данных случаях фоторезист
снимают в растворе диметилформамида при тем-
пературе 130 –150 °С.
Недостатки использование органических раство-
рителей :
- высокая стоимость растворителей,
- необходимость сбора и обезвреживания отходов, - высокая взрыво– и пожароопасность,
- высокая токсичность.
Слайд 30
Недостатки жидкостного
химического травления
– капиллярные процессы в тонких
щелях и про-
колах;
– проблемы адгезии фоторезистивных масок и
их
стойкости к травителям;
– ускоренный характер травления по грани-
цам зерен;
– необходимость применения различных тра-
вителей для травления многослойных и многоу-
ровневых структур;
– трудность контроля в процессе травления.
Слайд 31
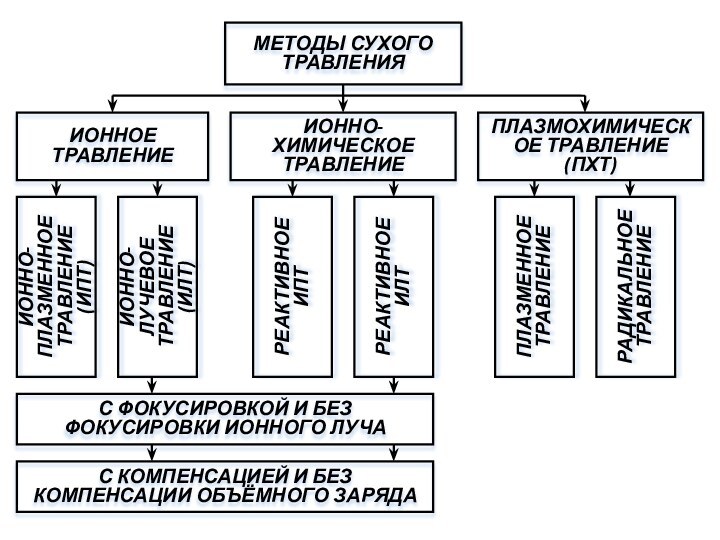
МЕТОДЫ СУХОГО ТРАВЛЕНИЯ
ИОННОЕ ТРАВЛЕНИЕ
ИОННО-ХИМИЧЕСКОЕ ТРАВЛЕНИЕ
ПЛАЗМОХИМИЧЕСКОЕ ТРАВЛЕНИЕ (ПХТ)
ИОННО-ПЛАЗМЕННОЕ ТРАВЛЕНИЕ
(ИПТ)
ИОННО-ЛУЧЕВОЕ ТРАВЛЕНИЕ (ИЛТ)
РЕАКТИВНОЕ ИЛТ
РЕАКТИВНОЕ ИПТ
ПЛАЗМЕННОЕ ТРАВЛЕНИЕ
РАДИКАЛЬНОЕ ТРАВЛЕНИЕ
С ФОКУСИРОВКОЙ И
БЕЗ ФОКУСИРОВКИ ИОННОГО ЛУЧА
С КОМПЕНСАЦИЕЙ И БЕЗ КОМПЕНСАЦИИ ОБЪЁМНОГО ЗАРЯДА
Слайд 32
Особенности ионного травления
При ионном травлении для удаления мате-
риала
используется кинетическая энергия ио-
нов инертных газов, т.е. имеет место
физи-
ческое распыление материала ионами.
Ионно–плазменное травление (ИПТ) образ-
цы помещаются на отрицательный электрод
разрядного устройства и подвергаются бом-
бардировке ионами, вытягиваемыми из плаз-
мы.
Ионно–лучевое травление (ИЛТ), образцы явля-
ются мишенью, бомбардируемой ионами, вытя-
гиваемыми из автономного ионного источника.
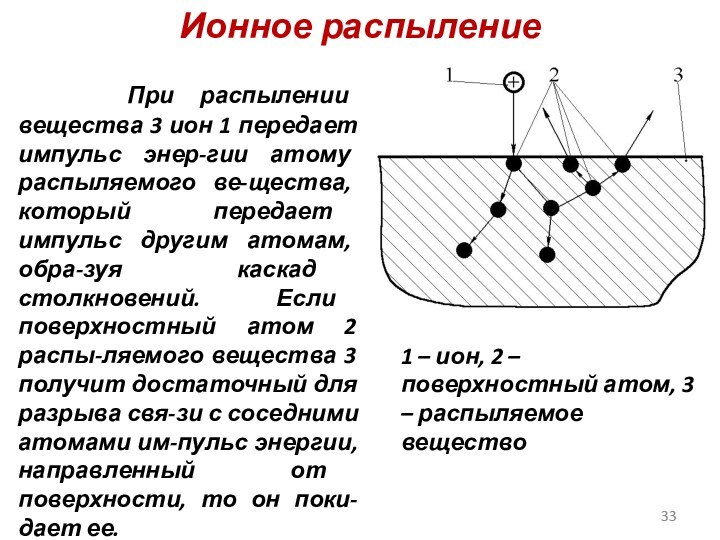
Слайд 33
Ионное распыление
При распылении вещества 3 ион
1 передает импульс энер-гии атому распыляемого ве-щества, который передает
импульс другим атомам, обра-зуя каскад столкновений. Если поверхностный атом 2 распы-ляемого вещества 3 получит достаточный для разрыва свя-зи с соседними атомами им-пульс энергии, направленный от поверхности, то он поки-дает ее.
1 – ион, 2 – поверхностный атом, 3 – распыляемое вещество
Слайд 34
Коэффициент распыления
Эффективность процесса ионного распыления характери-
зуется коэффициентом распыления,
который определяется
числом удаленных частиц распыляемого вещества, приходя-
щихся на
один ион:
S – коэффициент распыления, к – константа, учитывающая состояние поверхности, mI, mA – масса иона и атома мише-ни, EI – энергия первичного иона, θ – угол между направлением движения иона и нормалью к поверхности, λ – средняя длина пробега иона в мишени:
dI,A – диаметр столкновения иона и атома, n0 – концентра-ция атомов мишени.
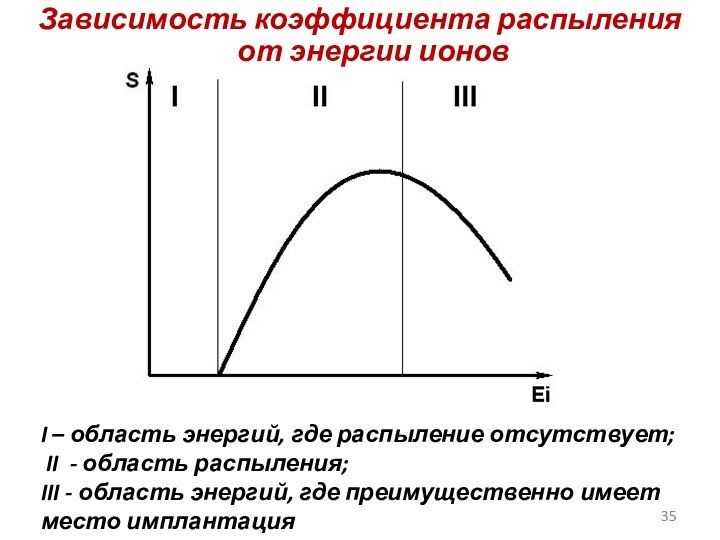
Слайд 35
Зависимость коэффициента распыления от энергии ионов
I – область
энергий, где распыление отсутствует;
II - область распыления;
III
- область энергий, где преимущественно имеет место имплантация
Слайд 36
Особенности ионно-химического травления
При ионно–химическом травлении исполь-
зуется как кинетическая
энергия ионов хими-
чески активных газов, так и энергия их
хими-
ческих реакций с атомами или молекулами
материала.
Слайд 37
Особенности плазмохимического травления
При ПХТ для удаления материала используется
энергия хи-
мических реакций между ионами и радикалами активного газа
и
атомами (или молекулами) обрабатываемого вещества с
образованием стабильных летучих соединений.
В зависимости от среды, в которую помещаются образцы, (ПХТ) подразделяется на:
– Плазменное травление: образцы помещаются в плазму
химически активных газов;
– Радикальное травление: образцы помещаются в вакуум-
ную камеру, отделенную от химически активной плазмы пер-
форированными металлическими экранами, или электричес-
кими или магнитными полями, а травление осуществляется
химически активными частицами (свободными атомами и ра-
дикалами), поступаюшими из плазмы.
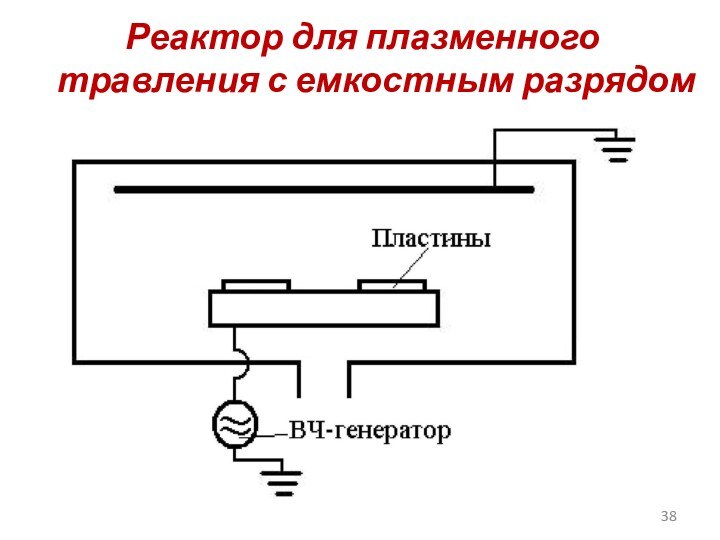
Слайд 38
Реактор для плазменного травления с емкостным разрядом
Слайд 39
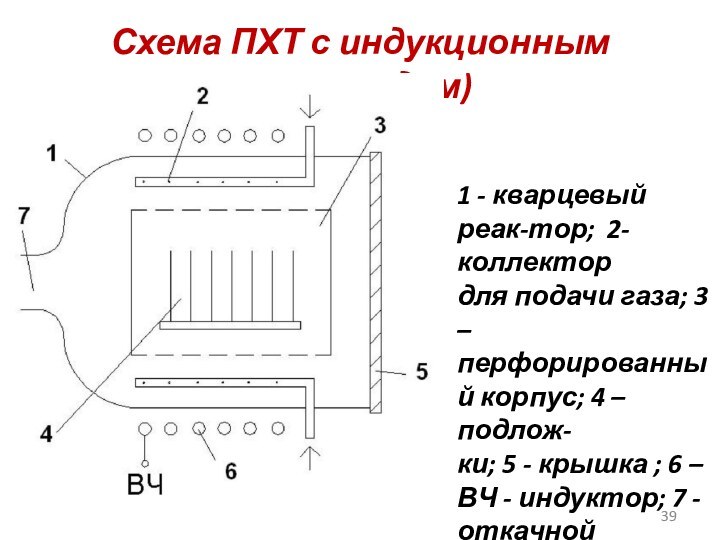
Схема ПХТ с индукционным (разрядом)
1 - кварцевый реак-тор;
2-коллектор
для подачи газа; 3 –
перфорированный корпус; 4 –
подлож-
ки; 5 - крышка ; 6 – ВЧ - индуктор; 7 - откачной патрубок
Слайд 40
Процессы, протекающие в плазме
Процессы, протекающие в плазме
очень
сложны и состоят из элементарных реак-
ций между следующими
частицами:
- электронами и молекулами;
- электронами и радикалами;
- электронами и ионами;
- ионами и молекулами;
- ионами и ионами.
Слайд 41
Явления в газовых разрядах
Возникновение ионов, атомов, радикалов
Простая
ионизация: Ar + e → Ar+ + 2e;
O2 +
e → O2+ + 2e;
Диссоциативная ионизация: CF4 +e → CF3+ + F + 2e;
Диссоциативная ионизация с прилипанием:
CF4 +e → CF3+ + F- + e;
Молекулярная диссоциация:
O2 + e → 2O + e → O + O-;
CF3Cl + e → CF3 + Cl + e;
C2F6 + e2 → CF3 +e.
Потеря электронов
Диссоциативная рекомбинация: e + O2 → 2O ;
Диссоциативное прилипание: e + CF4 → CF3+ + F-.
Слайд 42
Кинетика ПХТ
В общем случае кинетика состоит
из следующих
стадий:
1. Доставка молекул активного газа в
зону раз-
ряда;
2. Превращение этих молекул в активные ради-
калы;
3. Доставка радикалов к поверхности обраба-
тываемых материалов;
4. Взаимодействие радикалов с активными
центрами обрабатываемого материала;
4.1 Адсорбция радикалов на поверхности;
4.2 Химическая реакция;
4.3 Десорбция продуктов реакции;
5. Удаление продуктов реакции из разрядной камеры.
Слайд 43
Основные параметры процессов травления
Скорость травления
Равномерность травления
Селективность
травления
Анизотропия травления
Слайд 44
Скорость травления
d0 - исходная толщина слоя;
d1 -
конечная толщина слоя;
t - время травления.
Слайд 45
Равномерность травления
Скорость травления, как правило, неоднородна по
площади
пластины и лежит в пределах ,
где υf - средняя
скорость травления, φf – безразмер-
ный параметр.
С учетом неравномерности толщины удаляемого
слоя общее время, необходимое для полного его вы-
травливания должно составлять:
,
где hf – средняя толщина удаляемого слоя, δ – неод-
нородность толщины.
Слайд 46
Селективность травления
На практике все материалы, контактиру-
ющие с травителем,
характеризуются ко-
нечным временем травления.
Селективность (избирательность) – отно-
шение скоростей
травления различных ма-
териалов.
Слайд 47
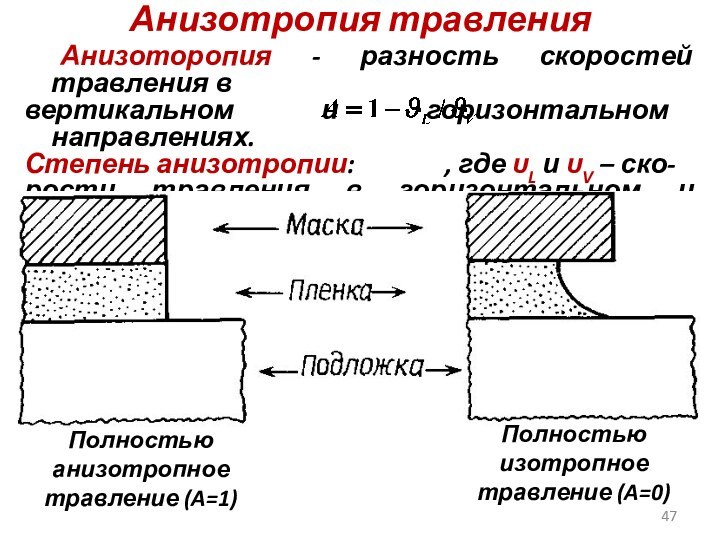
Анизотропия травления
Анизоторопия - разность скоростей травления в
вертикальном и
горизонтальном направлениях.
Степень анизотропии: , где υL и υV
– ско-
рости травления в горизонтальном и вертикаль-
ном направлениях соответственно.
Полностью анизотропное травление (A=1)
Полностью изотропное травление (A=0)
Слайд 48
Сравнительные характеристики методов сухого травления
Слайд 49
Пути повышения анизотропии ПХТ
Чистое ПХТ
при отсутствии каких-либо кристал-лографических эффектов является изотропным.
Для получения анизотропии процесса травление
стимулируют бомбардировкой положительными ионами. Известны два механизма стимуляции ани-
зотропного травления ионной бомбардировкой:
1. Создание радиационных нарушений.
2. Формирование пассивирующего слоя на боковых
стенках.
Слайд 50
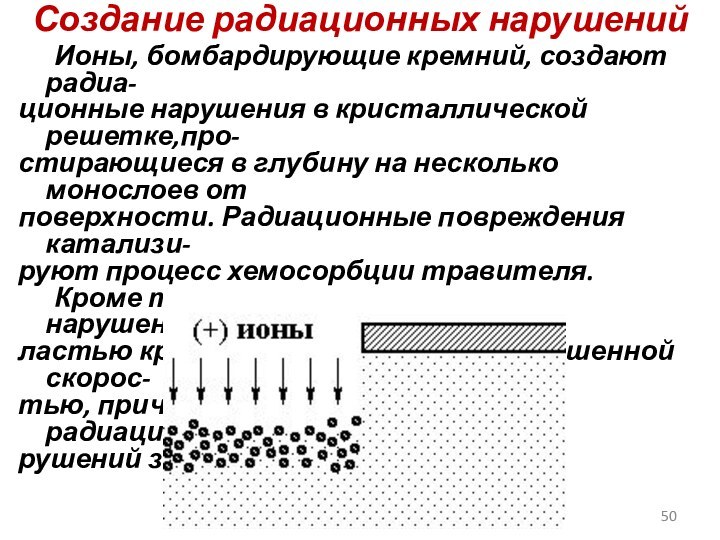
Создание радиационных нарушений
Ионы, бомбардирующие кремний, создают радиа-
ционные нарушения
в кристаллической решетке,про-
стирающиеся в глубину на несколько монослоев от
поверхности. Радиационные повреждения катализи-
руют процесс хемосорбции травителя.
Кроме того, химическая реакция с нарушенной об-
ластью кристалла протекает с повышенной скорос-
тью, причем глубина и количество радиационных на-
рушений зависят от энергии ионов.
Слайд 51
Формирование пассивирующего слоя
на боковых стенках
Определенные газы (например,
CHF3, CClF3) или смеси
газов (CF4-H2) распадаются в плазме, образуя
элемен-
ты с ненасыщенными связями и радикалы, способные к
полимеризации. Эти элементы, взаимодействуя с по-
верхностью, формируют адсорбированный слой, а в
некоторых случаях - сплошную пленку. Адсорбированный слой замедляет травление, адсор-
бируя элементы травителя либо препятствуя досту-
пу частиц травителя к подложке. Ионная бомбарди-
ровка поверхности удаляет покрытие из ингибиторов,
что вызывает анизотропию травления
Слайд 52
БОШ – процесс
Для глубокого анизотропного травления ис-
пользуют так
называемый БОШ–процесс, ко-
торый представляет собой чередование двух
стадий:
-
изоторопного ПХТ;
- осаждения полимера.
Достоинства:
- высокая скорость травления (до 20 мкм/мин); - возможность управления степенью анизотропии;
- высокая воспроизводимость процесса.
Слайд 53
Травление кремния
Плазмохимическое травление кремния осущест-
вляют во фторсодержащей плазме.
Атомы фтора
реагируют с кремнием n и p типа
проводимости, а
также с SiO2 и Si3N4, образуя летучие соединения.
В качестве источников фтора могут служить
молекулы: F2, CF4, C2F6, C3F8, SF6, SiF4, NF3, ClF3, кото-
рые при диссоциации в плазме могут образовывать
атомарный фтор, а также различные фторсодер-
жащие радикалы. В результате химических реакций
с кремнием образуются летучие продукты такие,
как SiF2 и SiF4.
Для улучшения эффективности процесса в плазму
добавляют кислород, который в атомарном сос-
тоянии окисляет углерод до СО и СО2.
Слайд 54
ПХТ слоёв SiO2
Используемые газы: C3F8, CHF3, O2,

He.
C3F8 диссоциирует, образуя химически активные радикалы
CFX, а также
атомарный фтор: C3F8 + e → 2CFX + 2F + e. Ради-
калы CFX (главным образом CF3+) взаимодействуют с SiO2 с об-
разованием таких летучих продуктов, как SiF4, CO, CO2, COF2:
CFX + SiO2 → SiF4 + (CO, CO2 COF2).
Кислород способствует лучшему удалению из зоны трав-
ления нелетучих углеродсодержащих соединений за счет об-
разования таких газов, как COF2, CO и CO2.
CHF3 при диссоциации образует радикалы CF3+, а также ато-
марный водород, связывающий атомы фтора:CHF3 → CF3+ + H,
H + F → HF. При добавлении в газовую смесь CHF3 происходит
увеличение скорости травления SiO2 за счет увеличения кон-
центрации радикалов CF3+ и уменьшения скорости травления
чистого кремния из-за уменьшения концентрации атомов
фтора. Это позволяет обеспечить селективность травления
SiO2 по отношению к Si на уровне 10:1.
Добавка в газовую смесь гелия позволяет эффективно ох-
лаждать стенки реактора и пластину во время, и после тра-
вления, что необходимо для сохранения геометрии фоторе-
зистивной маски.
Слайд 55
ПХТ слоёв Si3N4
Используемые газы: SF6, He.
Травление осуществляется атомами
фто-
ра, которые освобождаются в плазме гекса-
фторида серы. Поскольку атомы
фтора быс-
трее вступают в реакцию с Si3N4, чем с SiO2,
то данный процесс характеризуется селек-
тивностью травления Si3N4 по отношению к
SiO2. Добавка гелия выполняет функцию хла-
доагента.
Слайд 56
ПХТ алюминия
Используемые газы: BCl3, Cl2, SiCl4, He.
Травление алюминия
осуществляется в плазмооб-
разующей смеси BCl3 + Cl2 согласно схеме:
Al2O3
+ 12 эВ → разрушение решетки;
2Al2O3 + 6 Cl2 → 4 AlCl3(тв.) + 3O2(газ.) ;
Al – Al > 6 эВ → разрушение решетки;
Al(тв.) + 3Cl → AlCl3(тв.) ;
AlCl3(тв.) → Al2Cl6(газ.).
Таким образом, чистый хлор обеспечивает удале-
ние оксида алюминия, который всегда содержится
на поверхности пленки алюминия, а также по грани-
цам кристаллических зерен.
Слайд 57
Улучшение эффективности удаления Al2O3
Процесс травления проводится в две
стадии:
- первые 60 секунд процесса (индукционный период)
происходят при
более высокой мощности. Это обус-
ловливает увеличение ионной составляющей плазмы
и дополнительное травление поверхности пленки
физическим распылением, характеризующимся ма-
лой селективностью травления Al по отношению к
Al2O3.
- вторая стадия (травление слоя) проводится с
уменьшенной мощностью для более высокой селек-
тивности процесса
Слайд 58
Анизотропия процесса
Добавка в газовую смесь SiCl4 производится для
ис-
ключения бокового подтравливания под маску фото-
резиста. После разложения в
плазме SiCl4 образуют-
ся атомы хлора, участвующие в реакции травления
Al, а освободившийся кремний осаждается на боко-
вых стенках и дне канавки травления. Осажденный
кремний удаляется со дна канавки бомбардировкой
положительными ионами, в то время как на боко-
вых стенках этого не происходит из–за малого угла
их падения.
Таким образом, кремний, осажденный на боковых
стенках, блокирует реакцию с алюминием, посколь-
ку не образует в плазме летучих соединений с хло-
ром
Слайд 59
Удаление фоторезиста
Основным газом для «сухого» удаления резиста в
плазме является кислород. При микроволновом воз-
буждении кислорода образуются различные
нейт-
ральные и заряженные частицы: O3, O+, O2+, O–, O2–,
атомарный кислород и синглетный кислород. Физическая химия процесса сравнима с химией го-
рения с образованием летучих соединений (CO2, CO,
H2O и радикалов).
Для стабилизации кислородной плазмы в нее обычно добавляют инертный газ.