Слайд 2
Сублимацией (возгонкой) называется процесс перехода вещества из твердого

состояния в газообразное. Обратный процесс перехода газа в твердое
состояние называется десублишцией.
При парообразовании в неограниченном пространстве вся жидкость может превратиться в пар. Если процесс парообразования происходит в закрытой емкости; то между процессами парообразования и обратного перехода пара в жидкость может наступить равновесие. Пар в таком состоянии принимает максимальную плотность при данной температуре и давлении и называется насыщенным. Следовательно, насыщенный пар это пар, находящийся в равновесном состоянии с жидкостью, из которой он получается. При изменении температуры жидкости равновесие нарушается, что приводит к соответствующему изменению плотности и давления насыщенного пара.
При испарении всей жидкости получается сухой насыщенный пар, который не содержит частиц жидкой фазы. Температура и объем сухого насыщенного пара являются функциями давления, поэтому его состояние определяется лишь одним параметром – давлением или температурой.
Насыщенный пар, который содержит мельчайшие капельки жидкости, называется влажным насыщенным паром.
Слайд 3
Отношение массы сухого насыщенного пара тс, содержащегося во

влажном паре, к общей массе (пар + жидкость) влажного
насыщенного пара тс + тж называется степенью сухости пара (паросодержанием) х, т.е.
,
где тв = тс + тж – масса влажного пара; тж – масса жидкости во влажном паре.
Таким образом, степень сухости определяет долю сухого насыщенного пара во влажном паре.
Массовая доля жидкости во влажном паре называется степенью влажности пара и обозначается (1–х).
Степень сухости х может меняться в пределах от нуля до единицы. Например, для кипящей жидкости при температуре насыщения (температуре кипения при данном давлении) х=0, а для сухого насыщенного пара х=1.
Если к сухому насыщенному пару подводить теплоту, то температура его будет возрастать и пар становится перегретым. Разность между температурой tп перегретого пара и температурой ts сухого насыщенного пара называется степенью перегрева. Перегретый пар является ненасыщенным. При данном давлении его плотность меньше плотности сухого насыщенного пара, а удельный объем больше. Чем выше степень перегрева, тем больше по своим свойствам перегретый пар приближается к газу.
Слайд 4
5.2. ТЕРМОДИНАМИЧЕСКАЯ ФАЗОВАЯ рТ – ДИАГРАММА. УРАВНЕНИЕ КЛАПЕЙРОНА
– КЛАУЗИУСА
Вещество в зависимости от температуры и давления
может находиться в твердой, жидкой и газообразной фазе.
Фазовым переходом называется процесс, сопровождающийся затратой теплоты и изменением объема, в котором происходит изменение агрегатного состояния вещества. Переход из одного агрегатного состояния в другое удобно рассматривать на рТ– диаграмме (рис.5.1).
Если в качестве независимого параметра взять температуру, то на рТ – диаграмме будут иметь место три характерные линии
Рис. 5.1.
Эти линии представляют собой геометрическое место точек, в которых находится в равновесном состоянии любая пара из трех агрегатных состояний вещества.
Линия р = f1(T) (линия АК на рис.5.1.) соответствует равновесному состоянию жидкой и газообразной (парообразной) фаз. Эту линию еще называют линией испарения (или по обратному процессу – линией конденсации). Линия р = f2 (Т) (линия АС) соответствует равновесному состоянию твердой и газообразной фаз. Это линия сублимации (или по обратному процессу – десублимации). На линии р = f3(T) (линия АВ) находятся в равновесии твердая и жидкая фазы. Эта линия называется линией плавления (или по обратному процессу – затвердевания).
Слайд 6
Кривая, на которой в зависимости от температуры и

давления происходит переход из жидкого состояния в газообразное, заканчивается
в точке К, называемой критической точкой. В этой точке исчезает физическое различие между жидким и газообразным состоянием вещества. Обоснование наличия критической точки наиболее наглядно можно проследить на pV – диаграмме водяного пара (рис.5.2.).
Увеличение давления приводит к увеличению температуры кипения. При этом объем V" газообразной фазы уменьшается, а объем жидкой фазы V′ возрастает. При некотором давлении (р=ркр=22,12 МПа – для воды) эти два объема оказываются одинаковыми, что и наблюдается в критической точке, которой соответствует определенная для каждого вещества критическая температура (для воды Tкр = 374,16 °С). Следовательно, в критической точке сухой пар имеет такую же плотность, что и кипящая вода и, таким образом, исчезает различие между жидкой и паровой фазами.
Все три кривые равновесного состояния различных фаз вещества пересекаются в некоторой определенной для каждого вещества точке, называемой тройной точкой (точка А на рис.5.1). В этой точке в термодинамическом равновесии находятся три различные фазы вещества – твердая, жидкая и газообразная, т.е. пропадает различие между этими тремя фазами.
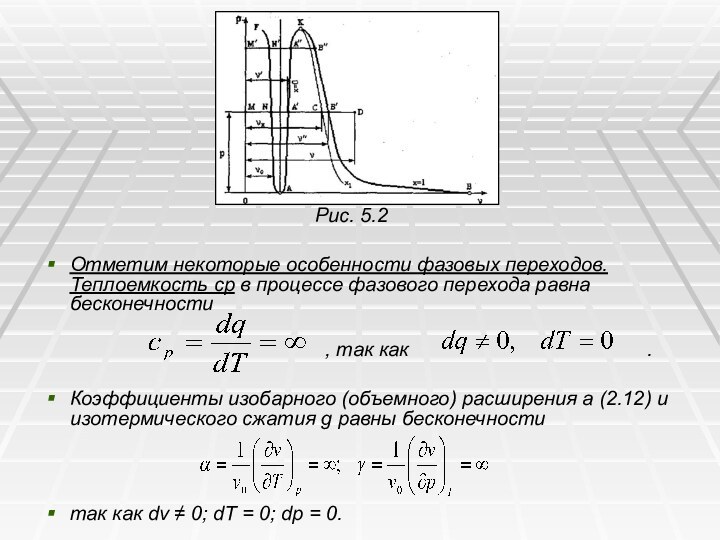
Рис. 5.2
Отметим некоторые особенности фазовых переходов. Теплоемкость ср в процессе фазового перехода равна бесконечности
, так как .
Коэффициенты изобарного (объемного) расширения a (2.12) и изотермического сжатия g равны бесконечности
так как dv ≠ 0; dT = 0; dp = 0.
Слайд 8
Значительный интерес представляет уравнение Клапейрона – Клаузиуса, связывающее
термические величины (температуру, давление, удельный объем) с калорическими (теплотой
фазового перехода). Это уравнение имеет вид
,
где q – теплота фазового перехода; v' – удельный объем жидкости или твердого тела; v" – удельный объем пара; dp/dT – производная от давления по температуре, взятая на кривой фазового перехода.
Слайд 9
5.3. pV– ДИАГРАММА ВОДЯНОГО ПАРА
На рис. 5.2.

представлена фазовая pV – диаграмма, которая представляет собой график
зависимости удельного объема воды и водяного пара от давления.
Кривая АF представляет зависимость удельного объема воды от давления при температуре t = 0°С, т.е. это есть изотерма воды при нулевой температуре. Область, заключенная между этой изотермой и осью ординат, является областью равновесного сосуществования жидкой и твердой фаз. Кривая AF почти параллельна оси ординат, так как вода практически несжимаемая жидкость. Поэтому удельный объем v0 воды в процессе сжатия изменяется незначительно.
При нагреве воды при некотором постоянном давлении р удельный объем будет увеличиваться и при достижении температуры кипения в точке А' удельный объем v' жидкости становится максимальным. С увеличением давления температура кипения возрастает и удельный объем v' в точке А" будет больше, чем в точке А'.
Зависимость удельного объема v' от давления на pv – диаграмме изображается кривой АК, называемой пограничной кривой жидкости. Всюду на этой кривой степень сухости x=0.
Слайд 10
Дальнейший подвод к жидкости теплоты при неизменном давлении

приводит к процессу парообразования (линия А'В'), который заканчивается в
точке В'. Пар в этой точке будет сухим, насыщенным с удельным объемом v". Процесс A'В' является одновременно изобарным и изотермическим.
Зависимость удельного объема v" от давления представлена кривой KB, которая называется пограничной кривой пара. На этой кривой степень сухости х=1.
Если в состоянии, характеризуемом точкой В' (или В" при большем давлении), к пару подводить теплоту, то его температура и удельный объем будут увеличиваться. Линия В'Д представляет процесс перегрева пара.
Таким образом, кривые АК и KB делят область диаграммы на три части. Левее кривой АК расположена область жидкости. Между кривыми АК и KB расположена область двухфазной системы, включающей пар и жидкость (пароводяная смесь). Правее кривой KB и выше точки К расположена область перегретого пара.
Точка К называется критической точкой. Параметры критической точки для воды: tк= 374,16°С; рк = 22,12 МПа; vк = 0,0032 м3/кг; iк = 2095,2 кДж/(кг∙К).
Слайд 11
Точка А характеризует состояние кипящей жидкости в тройной
точке. Температура кипения воды в этой точке t0 =
0,001°С ≈ 0°С. Если в состоянии, характеризуемом тройной точкой, к жидкости подводить теплоту, то процесс кипения будет происходить по изобаре являющейся одновременно нулевой изотермой, которая при выбранном масштабе изображения кривых практически совпадает с осью абсцисс.
Между кривыми х=0 и х=1 расположены кривые промежуточных степеней сухости. Все они исходят из точки К. Одна из таких кривых со степенью сухости х=х1 приведена на рис.5.2.
Удельное количество работы , полученной в процессе или цикле, на pv – диаграмме изображается соответствующей площадью под кривой процесса или внутри цикла.
Слайд 12
5.4. Ts – ДИАГРАММА ВОДЯНОГО ПАРА
Процесс нагрева
воды от 0,01°С = 273,16 К до температуры кипения
при давлении р1=const характеризуется линией АаА1. Линия А1В1 является процессом парообразования и линия В1Д1 – процессом перегрева пара (рис. 5.3.). Если нанести на Ts – диаграмме ряд таких изобарных процессов и соединить точки, в которых начинается и заканчивается процесс кипения, то получим две пограничные кривые АК – кривая начала кипения (х=0) и КB – кривая окончания кипения (кривая сухого пара х=1), которые сходятся в критической точке К.
Рис. 5.3
Слайд 13
Точка А здесь является тройной точкой, которой соответствует

изобара p0 = 0,611 кПа и изотерма t0 =
0,01°С = 273,16 К.
Пограничные кривые АК и KB делят область диаграммы на три части. Левее кривой АК расположена область жидкости. Между кривыми АК и ВК – область влажного пара (пароводяной смеси). Правее кривой KB и выше точки К находится область перегретого пара. Кривая АК берет свое начало в тройной точке А, расположенной на оси ординат, т.е. считается, что удельная энтропия при температуре 273,16°С близка к нулю.
Изобары нагрева воды АаА1, Аа1А2 до температуры кипения соответственно при давлениях р1 и р2 даны как для нормальной жидкости, т.е. без учета аномальности воды, имеющей максимальную плотность при температуре t = 4°С. Это допущение незначительно влияет на точность при расчетах. Давлению в тройной точке р = 0,611 кПа соответствует изобара АВ.
сухости x1, x2, x3, x4. Все эти кривые сходятся в критической точке К, где исчезает различие между жидкой и паровой фазами, т.е. сухой пар и кипящая вода имеют одинаковую плотность.
Слайд 14
Удельное количество теплоты

,
сообщаемое
рабочему телу, на Ts – диаграмме изображается площадью под кривой процесс. Удельная работа обратимого цикла
также может быть найдена в виде площади цикла. Таким образом,
с помощью Ts – диаграммы достаточно просто можно найти термический кпд обратимого цикла.
Удобство Ts – диаграммы в том, что она позволяет проследить изменение температуры рабочего тела и находить количество теплоты, участвующее в процессе. К неудобствам диаграммы следует отнести необходимость измерения соответствующих площадей. Ts – диаграмма широко применяется при исследовании паросиловых и холодильных установок, обеспечивая наиболее наглядное изображение процессов.
Удобство Ts – диаграммы в том, что она позволяет проследить изменение температуры рабочего тела и находить количество теплоты, участвующее в процессе. К неудобствам диаграммы следует отнести необходимость измерения соответствующих площадей. Ts – диаграмма широко применяется при исследовании паросиловых и холодильных установок, обеспечивая наиболее наглядное изображение процессов.
Слайд 15
5.5. ОСНОВНЫЕ ПАРАМЕТРЫ ВОДЫ И ВОДЯНОГО ПАРА
Ввиду
практической несжимаемости воды можно допустить, что удельный объем воды
при 0°С не зависит от давления и равен v'0= 0,001 м3/кг. При температуре 0°С и соответствующем давлении насыщения р = 0,000611 МПа внутренняя энергия, энтальпия и энтропия условно принимаются равными нулю.
.
Количество теплоты, которое требуется для нагрева воды от 0 оС до температуры кипения при постоянном давлении, определяется по формуле (5.1) или при t0=0 ,
где ср – средняя теплоемкость воды в интервале температур от 0 оС до температуры кипения ts при данном давлении (ср = 4,1865 кДж/(кг∙К)).
Первый закон термодинамики для изобарного процесса подогрева воды имеет вид , (5.2)
где и' – внутренняя энергия воды при температуре кипения; и′0 = 0; l′ – работа расширения воды при ее нагреве, определяемая по формуле
,
где v′0 – удельный объем воды при температуре 0°С; v' – удельный объем при температуре кипения.
Слайд 16
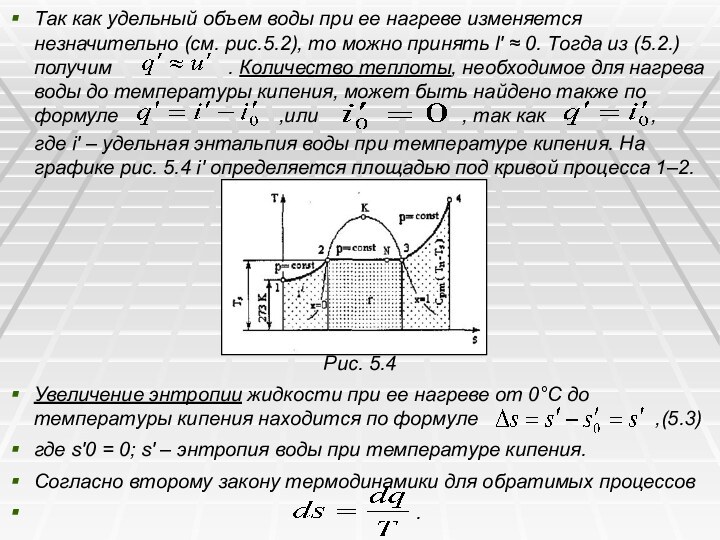
Так как удельный объем воды при ее нагреве
изменяется незначительно (см. рис.5.2), то можно принять l' ≈
0. Тогда из (5.2.) получим . Количество теплоты, необходимое для нагрева воды до температуры кипения, может быть найдено также по формуле ,или , так как ,
где i' – удельная энтальпия воды при температуре кипения. На графике рис. 5.4 i' определяется площадью под кривой процесса 1–2.
Рис. 5.4
Увеличение энтропии жидкости при ее нагреве от 0°С до температуры кипения находится по формуле ,(5.3)
где s'0 = 0; s′ – энтропия воды при температуре кипения.
Согласно второму закону термодинамики для обратимых процессов
.
, то
,(5.4) где сp=4,1865 кДж/(кг∙К).
Учитывая (6.4),
формула (6.3) будет .
Количество теплоты, затрачиваемое на превращение в пар 1 кг воды, нагретой до температуры кипения, называется удельной теплотой парообразования и обозначается r. Теплота парообразования зависит от температуры и давления и с их возрастанием она уменьшается, обращаясь в ноль в критической точке.
По первому закону термодинамики ,где и" – внутренняя энергия сухого насыщенного пара; l" = p(v" – v') – работа расширения в процессе парообразования (работа против внешних сил).
Разность энергий и"– и' называется внутренней теплотой парообразования. Таким образом, теплота парообразования затрачивается на работу против внутренних и внешних сил.
Так как процесс парообразования идет при постоянном давлении, то
,
где i"– энтальпия сухого насыщенного пара.
Слайд 18
Теплота парообразования r в Ts – координатах определяется
площадью под линией процесса 2–3 (рис.6.5).
Удельная энтропия сухого насыщенного
пара определяется по
формуле , или .
Количество теплоты, затрачиваемое для перевода сухого насыщенного пара (рs = const) в перегретый с температурой Tп, называется теплотой перегрева, определяемой по формуле
, или ,
где сpm – средняя массовая изобарная теплоемкость перегретого пара. Величина qп в Ts – диаграмме определяется площадью под кривой 3–4 (рис. 5.4). Формула для энтальпии перегретого пара
будет .
Слайд 19
Эта величина называется полной теплотой перегретого пара.
Теплоту перегрева
qп можно также найти по первому закону термодинамики
, где uп – и" – изменение внутренней энергии в процессе перегрева; l = p(vп – v") – работа расширения в изобарном процессе расширения пара.
Изменение энтропии в процессе перегрева пара будет
.
Отсюда, учитывая, что ,
получим .
Все рассмотренные выше параметры влажного, сухого насыщенного и перегретого паров в зависимости от температуры и давления приводятся в специальных таблицах водяного пара.
Слайд 20
5.6. ВЛАЖНЫЙ ВОЗДУХ. АБСОЛЮТНАЯ ВЛАЖНОСТЬ, ВЛАГОСОДЕРЖАНИЕ И ОТНОСИТЕЛЬНАЯ

ВЛАЖНОСТЬ ВОЗДУХА
В атмосферном воздухе всегда есть влага в
виде водяного пара. Смесь сухого воздуха с водяным паром называется влажным воздухом. Водяной пар в воздухе может быть в насыщенном или перегретом состоянии. Соответственно этому влажный воздух бывает:
1. Насыщенным влажным воздухом – смесь сухого воздуха с насыщенным водяным паром.
2. Ненасыщенным влажным воздухом – смесь сухого воздуха с перегретым водяным паром.
Температура, до которой нужно охладить ненасыщенный влажный воздух, чтобы он стал насыщенным, называется температурой точки росы. При дальнейшем охлаждении влажного воздуха происходит конденсация пара.
Абсолютной влажностью называется масса пара, содержащегося в 1 м3 влажного воздуха. Так как влажный воздух представляет собой газовую смесь, то объем пара в смеси равен объему всей смеси. Следовательно, абсолютная влажность может быть выражена через плотность пара rп в смеси при своем парциальном давлении pп
, где Мп – масса пара.
Слайд 21
Для нахождения состояния
влажного воздуха в части его насыщенности влагой пользуются понятием
влагосодержания. Под влагосодержанием d понимается величина отношения массы пара, содержащегося во влажном воздухе, к массе сухого воздуха
, кг/кг или г/кг.
Выведем формулу для определения влагосодержания через парциальное давление пара рп и давление влажного воздуха р. Для этого воспользуемся уравнениями состояния для сухого воздуха и водяного пара, содержащихся в V м3 влажного воздуха.
Разделив почленно первое уравнение на второе, получим
.
Учитывая, что рв = р – рп, находим .(а)
Если парциальное давление водяного пара равно давлению
насыщения , то.
Слайд 22
где d' – максимальное влагосодержание, т.е. максимальное количество
пара, которое может находиться в 1 кг сухого воздуха.
Кроме
абсолютной влажности пользуются еще понятием относительной влажности. Под относительной влажностью j понимают отношение действительной абсолютной влажности ненасыщенного воздуха к максимально возможной абсолютной влажности воздуха при
той же температуре
Относительная влажность изменяется в пределах от j = 0 (сухой воздух) до j = 1 (воздух, насыщенный влагой).
Из уравнения Клапейрона следует,
что .(b)
Таким образом, если влажный воздух считать идеальным газом, то относительная влажность равна отношению парциального давления водяного пара в нем к максимально возможному давлению водяного пара при одинаковой температуре смеси.
Из уравнений (а) и (b) следует .
Отсюда можно заключить, что при р = рmax относительная влажность зависит только от влагосодержания d.
Слайд 23
5.7. ТЕПЛОЕМКОСТЬ И ЭНТАЛЬПИЯ ВЛАЖНОГО ВОЗДУХА
Изобарную теплоемкость
ср обычно относят к 1 кг сухого воздуха или
к (1+d) кг влажного воздуха. Она равна сумме теплоемкостей 1 кг сухого воздуха и d кг пара , где срв – удельная
изобарная теплоемкость сухого воздуха; срп – удельная изобарная теплоемкость водяного пара.
Можно принять срв ≈ 1 кДж/(кг∙К) = const; срп = 1,96 кДж/(кг∙К).
Тогда .
Энтальпия влажного воздуха определяется как энтальпия газовой смеси, состоящей из 1 кг сухого воздуха и d кг водяного пара
, где – энтальпия сухого воздуха;
– энтальпия водяного пара,
находящегося во влажном воздухе в перегретом состоянии; t – температура влажного воздуха; r – скрытая теплота парообразования; срвод =4,19 кДж/(кг∙К) – удельная изобарная теплоемкость воды; ts – температура насыщения при парциальном давлении пара в смеси.
Слайд 24
5.8. id–ДИАГРАММА ВЛАЖНОГО ВОЗДУХА
Параметры влажного воздуха можно

определить графически, пользуясь id – диаграммой влажного воздуха, предложенной
Л.К.Рамзиным в 1918 г. (рис. 5.5).
На этой диаграмме вертикальные линии – линии влагосодержания d (г/кг); линии, наклоненные к вертикальным линиям под углом 45°, являются линиями постоянных энтальпий. Кроме того, на диаграмме имеются линии постоянных температур влажного воздуха, кривые относительной влажности j воздуха, кривая парциальных давлений pп = f(d). Диаграмма обычно строится для какого-либо среднего барометрического давления.
По id – диаграмме, зная температуру t и относительную влажность j, можно определить энтальпию i, влагосодержание d и парциальное давление pп. По температурам сухого и мокрого термометров можно определить температуру точки росы, т.е. температуру, при которой воздух насыщен водяным паром (j = 100%).
Процесс нагрева влажного воздуха на id – диаграмме изображается вертикальной прямой линией (линия АВ) при d = const. Процесс охлаждения также протекает при d = const и изображается вертикальной прямой (линия МО). Этот процесс справедлив только до состояния полного насыщения (j = 100%). При дальнейшем охлаждении воздух будет пересыщен влагой, и она будет выпадать в виде росы.