Слайд 2
Воды на Земле содержится примерно 1500 млн. км3,
причём пресные воды составляют порядка 10% общего планетарного запаса
воды. Большая часть воды находится не в открытых водоемах, а в земной коре: 110—190 млн. км3. Эти воды подразделяются на два типа в соответствии с глубиной их залегания – подземные и поверхностные воды.
Источники воды на Земле
Слайд 3
Мировой океан,
солёные воды
1120-1300
Атмосфера 0,013
Подземные воды 60-100
Почвенные воды 50-90
Ледники 20-30
Воды озёр и рек 1-4
Воды в растениях и животных 0,006
Распределение вод на земном шаре
(единица измерения — миллион кубических километров)
Слайд 4
Подземные воды глубокого залегания расположены в десятках-сотнях метрах
от поверхности земли, они пропитывают пористые горные породы, а
также образуют гигантские подземные бассейны, окруженные водонепроницаемыми слоями. Вода в таких подземных резервуарах находится под давлением.
Другой тип подземных вод поверхностные, расположенные в почве и верхних слоях земной поверхности на глубине нескольких метров. Недостаток: эти воды гораздо активнее контактируют с поверхностью земли и поэтому они слабее защищены от загрязнений, чем воды глубокого залегания. Преимущество этих вод заключается в том, что они более доступны и легко накапливаются в колодцах и поверхностных резервуарах.
Слайд 5
массив пресных вод (20—30 млн. км3) сосредоточен в
ледниках Антарктиды, Гренландии и островов Северного Ледовитого океана.
Пресную воду
из атмосферы (около 13 тыс. км3) мы получаем в виде осадков — дождя и снега.
Мировой океан содержит большие запасы воды, которая может быть опреснена различными физико-химическими методами.
Основной запас пресной воды, употребляемой человеком, сосредоточен в озерах и реках. Одно из крупнейших российских озерных хранилищ воды — озеро Байкал содержит около 20 тыс. км3 воды.
Другой источник воды – живые организмы. В растениях и животных, состоящих на две трети из воды, содержится 6 тыс. км3 воды.
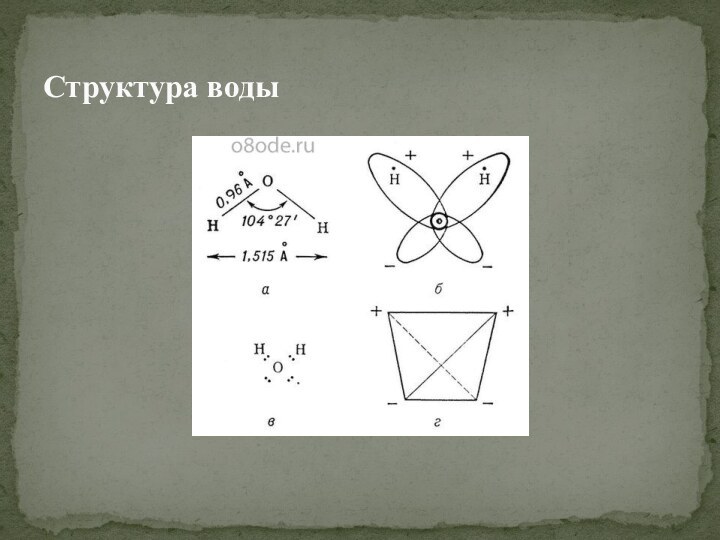
Слайд 7
Молекула воды представляет собой маленький диполь, содержащий положительный
и отрицательный заряды на полюсах. Так как масса и
заряд ядра кислорода больше чем у ядер водорода, то электронное облако стягивается в сторону кислородного ядра. Около ядер водорода имеется недостаток электронной плотности, а на противоположной стороне молекулы, около ядра кислорода, наблюдается избыток электронной плотности. Именно такая структура и определяет полярность молекулы воды. Если соединить прямыми линиями эпицентры положительных и отрицательных зарядов получится объемная геометрическая фигура - правильный тетраэдр.
Слайд 8
В настоящее время вода широко используется в различных
областях промышленности в качестве теплоносителя. Она имеет широкое распространение
в природе и особые термодинамические свойства: большую теплоту фазового перехода при парообразовании, высокие теплоемкость и теплопроводность.
Современные ТЭС и АЭС используют воду с содержанием примесей в пределах 0,1 - 1,0 мг/кг. Качество обработки воды на ТЭС и АЭС связано с надежностью и экономичностью эксплуатации котлотурбинного оборудования, с безопасностью ядерных энергетических установок.
Примеси природных и технологических вод
Слайд 9
Вода является исходным сырьем, которое используется для следующих
целей:
а) в качестве исходного вещества для получения пара
в котлах, парогенераторах, ядерных реакторах, испарителях;
б) для конденсации отработавшего в паровых турбинах пара;
в) для охлаждения различных аппаратов и агрегатов ТЭС и АЭС;
г) в качестве теплоносителя в тепловых сетях и системах горячего водоснабжения.
Слайд 10
Природные воды классифицируют по ряду признаков:
солесодержание воды:
пресная вода- солесодержание до 1 г/л;
солоноватая - солесодержание 1-10г/л; соленая - солесодержание более 10 г/л.
различаются по преобладающему в них аниону: гидрокарбонатный класс вод с преобладающим анионом НСОз , сульфатные воды (SО4), хлоридные воды (Сl).
По преобладающему катиону классы делятся на три группы, кальциевую (Са), магниевую (Mg) и натриевую (Na). Группы в свою очередь подразделяются на типы, учитывающие соотношения между ионами, мг-экв/л.
Слайд 11
Примеси природных вод по степени дисперсности
подразделяют на:
истинно - растворенные,
распределенные в воде в виде отдельных ионов, молекул;
коллоидно -
дисперсные с размером частиц от 1 до 100нм,
грубодисперсные с размером частиц более 100 нм.
Слайд 12
По химическому составу примеси природных
вод можно разделить на два типа: минеральные и органические.
К минеральным примесям
воды относятся растворенные газы N2, О2, С02, NН3, СН4, H2S, а также, вносимые сточными водами, различные соли, кислоты, основания, в значительной степени находящиеся в диссоциированной форме.
К органическим примесям природных вод относят гумусовые вещества, вымываемые из почв и торфяников, а также органические вещества различных типов, поступающие в воду совместно с сельскохозяйственными стоками и другими типами недостаточно очищенных стоков.
Слайд 13
Минеральные примеси различных природных вод по качественному составу примерно
постоянны и отличаются лишь концентрациями, установление которых и входит
в задачу анализа природных вод. Важнейшие показатели качества воды, определяющие применимость для паротурбинных установок и методов ее обработки, - это концентрация грубодисперсных примесей (взвешенные вещества), концентрация ионов Na++K+, Ca 2+, Mg+, Fe2+, NH4- , НСО3-,Cl-, SO42- NO3-, N02-, рН воды, удельная проводимость, технологические показатели (например, сухой и прокаленный остаток, щелочность, жесткость, кремнесодержание, окисляемость), концентрация растворенных газов O2 и СO2.
Физико - химические показатели качества воды
Слайд 14
Содержание грубодисперсных веществ выражают в (мг/л) и определяют фильтрованием 1л
пробы воды через бумажный фильтр, который затем высушивают при
температуре 105-110°С до постоянной массы.
Прозрачность воды определяют с помощью методов шрифта и креста, Для первого способа применяют градуированный на сантиметры стеклянный цилиндр высотой 30 см, под дно которого подложен определенный шрифт. Столб воды в сантиметрах, через который еще можно прочесть текст, и определяет прозрачность воды. Прозрачность по кресту определяют по той же методике, используя трубку длиной 350 см, диаметром 3,0 см, на дно которой помещают бумажный круг с крестом, имеющим ширину линий в 1 мм.
Слайд 15
Мутность воды, пропорциональную содержанию в воде взвешенных частиц,
определяют, сравнивая анализируемую пробу с определенным эталоном мутности.
Концентрацию основных
ионов - примесей природных вод определяют методами химического анализа и выражают в единицах миллиграмм на килограмм (мг/кг) или миллиграмм - эквивалент на килограмм (мг - экв/кг).
Показатель концентрации водородных ионов (рН) воды характеризует реакцию воды (кислая, щелочная, нейтральная) и учитывается при всех видах обработки воды.
Слайд 16
Удельная электрическая проводимость растворов, характеризуемая электрической проводимостью 1см3 (1м3)
и выражаемая в Ом/см (Ом/м). является важным показателем, указывающим
на суммарную концентрацию ионогенных примесей. Удельная проводимость воды, не содержащей примесей, при 25°С составляет 0,063 мкОм/см
Слайд 17
Технологические показатели качества воды
Сухой остаток определяют, упаривая 1л профильтрованной
воды, подсушивая остаток при 105 °С и взвешивая его.
Сухой остаток нужно рассматривать как показатель, лишь приближенно характеризующий загрязненность воды и дающий порядок его величины.
Плотный осадок, определяют, подсушивая при 105°С упаренный остаток нефильтрованной воды, содержащей также и грубодисперсные примеси, концентрацию которых можно найти по разности плотного и сухого остатков воды.
Слайд 18
Общей щелочностью воды, (Що), мг-экв/кг, называют сумму миллинормальных
концентраций всех анионов слабых кислот и гидроксильных ионов за
вычетом концентрации ионов водорода:
В зависимости от типа анионов, обусловливающих щелочность, различают щелочность
бикарбонатную - ЩБ (НСО3-),
карбонатную - ЩК(CO3-),
силикатную - ЩС(SiO32-),
гидратную - ЩГ (ОН-),
фосфатную - ЩФ(Н2Р04, -, РО4-3 ,НР042- )
ЩO=ЩБ+ЩК+ЩС+ЩФ+ЩГ
Слайд 19
Жесткость воды - один из важнейших показателей ее
качества, Общей жесткостью (ЖO)называют суммарную концентрацию ионов кальция и магния,
выраженную в эквивалентных единицах (мг - экв/кг, а при очень малых значениях - в мкг-экв/кг). Общую жесткость воды подразделяют на кальциевую и магниевую. Часть ЖO (в предельном случае при ЩO > ЖO вся жесткость), эквивалентная содержанию бикарбонатов, называется карбонатной жесткостью; разность между общей и карбонатной жесткостями называется некарбонатной жесткостью.
Процесс выделения из воды ионов Са2 и Mg2 получил название умягчения воды. Воды с высокой жесткостью, дают плотные отложения на теплопередающих поверхностях.
Слайд 20
Окисляемость воды - это показатель, имеющий условное значение
и представляющий собой расход какого-либо сильного окислителя, необходимого для
окисления в определенных условиях органических примесей, которые содержатся в 1 л воды. Обычно для этих целей применяют перманганат калия (КМnO4) или бихромат калия (К2Сг2О7), различая соответственно перманганатную и бихроматную окисляемость.
Концентрация растворенных газов в воде зависит от их природы, температуры воды и парциального давления, типа и концентрации минеральных и органических примесей воды, рН воды и т.п
Слайд 21
Вода - среда для развития многочисленных форм вирусов,
бактерий, простейших и сложных организмов. К числу бактериальных и
вирусных водных инфекций относятся дизентерия, брюшной тиф, холера, полиомиелит и др.
Для определения чистоты воды в качестве критерия выбрана кишечная палочка. Кишечные палочки отмирают в воде медленнее многих болезнетворных бактерий, поэтому уничтожение кишечных палочек в процессе обеззараживания воды гарантирует в значительной мере отсутствие болезнетворных бактерий. Количество кишечных палочек в воде выражается коли-титром (к - т).
Биологические показатели качества воды
Слайд 22
В поверхностных водоемах находится также большое количество водорослей
и микроорганизмов. Питьевая вода не должна содержать продуктов обмена
веществ и распада клеток этих организмов. Обеспечение этого условия осложняется при так называемом цветении воды, т. е. массовом развитии планктона. В отечественной практике водоподготовки цветность воды принято определять сравнением со стандартной платиново - кобальтовой шкалой и выражать результат измерения в градусах этой шкалы. Запах и вкус оцениваются количественно по пятибалльной системе.