- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему урока Водород
Содержание
- 2. Цель урока: активизировать и систематизировать знания о
- 3. В диссертации М.В.Ломоносова «О металлическом блеске» в
- 5. Водород самый легкий из всех элементов. Он
- 8. Химические свойства водорода.Атом водорода имеет один электрон.
- 9. Щелочные и щелочноземельные металлыЛегко отдают электроны водороду:2Na
- 10. Взаимодействие с неметалламиБолее характерны соединения водорода, в
- 13. Применение.Водород является ценным сырьем для химической промышленности.
- 15. Проверочная работаВыберите верное определение. Физические свойства водорода:А)газ
- 16. Скачать презентацию
- 17. Похожие презентации
Цель урока: активизировать и систематизировать знания о нахождение в природе. Физические свойства. Химические свойства водорода: реакции с неметаллами и металлами. Реакции водорода с оксидами металлов. Получение водорода в лаборатории и промышленности. Применение водорода.















Слайд 3 В диссертации М.В.Ломоносова «О металлическом блеске» в 1745г.
впервые было описано получение водорода действием кислоты на железо
и другие металлы и была выдвинута гипотеза о том, что водород (горючий пар) представляет собой флогистон.Слайд 5 Водород самый легкий из всех элементов. Он входит
в состав воды, которая покрывает около ¾ земной поверхности,
в состав многих минералов и горных пород, а также всех органических соединений. В свободном состоянии водород встречается в небольших количествах в верхних слоях атмосферы и в некоторых природных горючих газах.
Слайд 8
Химические свойства водорода.
Атом водорода имеет один электрон. При
образовании химических соединений он почти всегда отдает электрон, приобретая
заряд +1. Из-за малого заряда ядра атом водорода сравнительно слабо притягивает электроны и может присоединить их только тогда, когда другой элемент легко их отдает. В этом случае атом водорода образует устойчивую двухэлектродную оболочку инертного газа гелия.
Слайд 9
Щелочные и щелочноземельные металлы
Легко отдают электроны водороду:
2Na +
H2 = 2Na H – гидрид натрия
Ca + H2
= CaH2 – гидрид натрия
Слайд 10
Взаимодействие с неметаллами
Более характерны соединения водорода, в которых
он проявляет положительную степень окисления, он взаимодействует почти со
всеми неметаллами, причем в зависимости от активности неметалла реакция протекает с различной скоростью. Так, с фтором водород взаимодействует всегда со взрывом:H2 + F 2 = 2HF
С хлором он взаимодействует более спокойно. Водород хорошо горит в атмосфере хлора:
H2 + Cl = 2HCl
Слайд 13
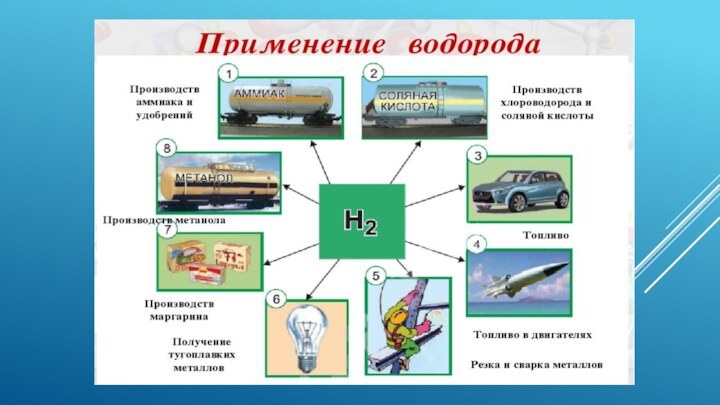
Применение.
Водород является ценным сырьем для химической промышленности. Его
используют для получения аммиака и синтетического метилового спирта, для
гидрогенизации твердого топлива и жиров. Значительное количество водорода используется для получения различных металлов и неметаллов (германий, галлий, вольфрам, молибден и др.) в промышленности путем восстановления их оксидов или галогенидов. Используя высокую температуру горения водорода в кислороде, его применяют при резке и сварке металлических конструкций.
Слайд 15
Проверочная работа
Выберите верное определение. Физические свойства водорода:
А)газ без
цвета и запаха.
Б) он в 16,4 раз легче воздуха.
В)
растворим в воде.2. Дайте названия изотопам водорода:
1Н -
2Н -
3Н -
3. Вставите пропущенные слова.
Атом водорода имеет один _________. При образовании химических соединений он почти всегда ______ электрон, приобретая заряд ___. Из-за ______ заряда ядра атом водорода сравнительно ______ притягивает _______ и может присоединить их только тогда, когда другой элемент легко их отдает. В этом случае ________ водорода образует устойчивую двухэлектродную оболочку ________ _________ _______.





























