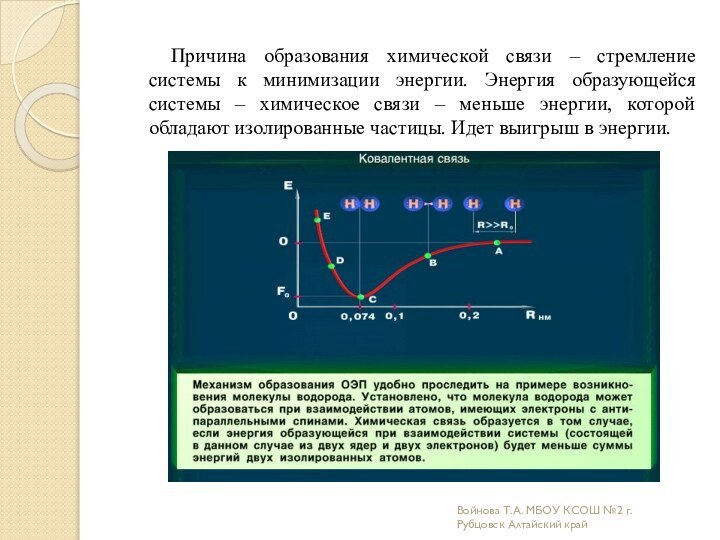
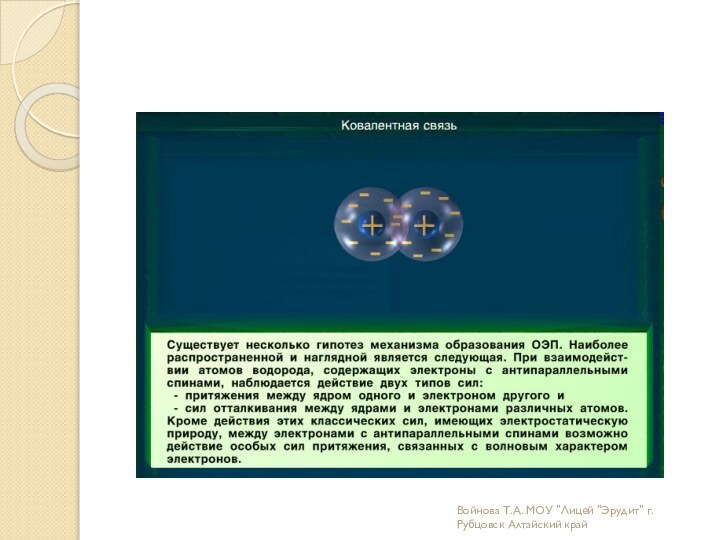
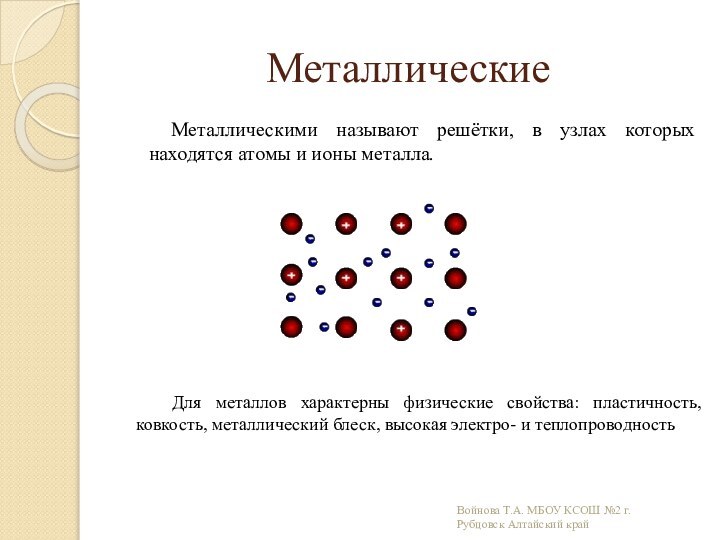
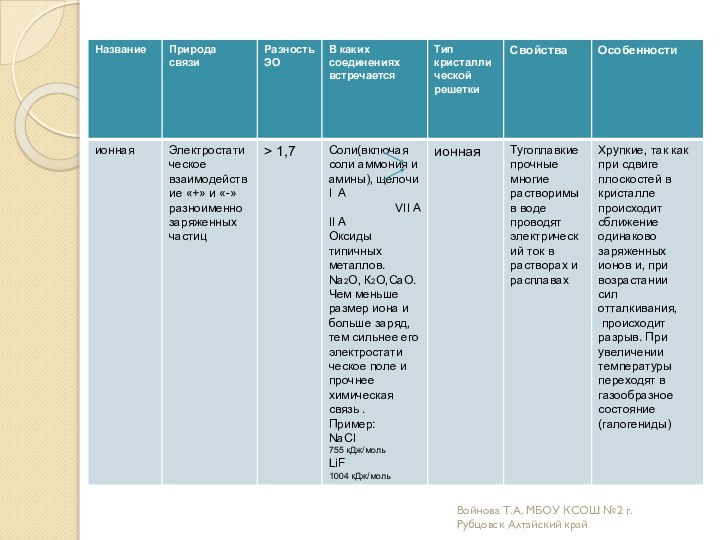
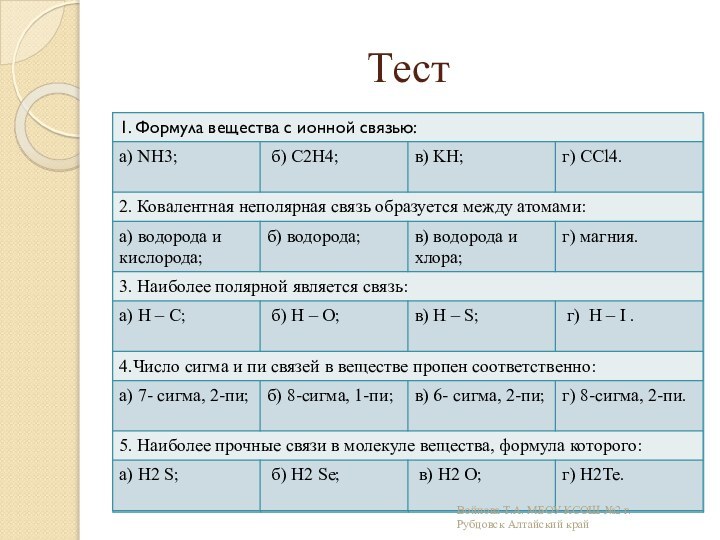
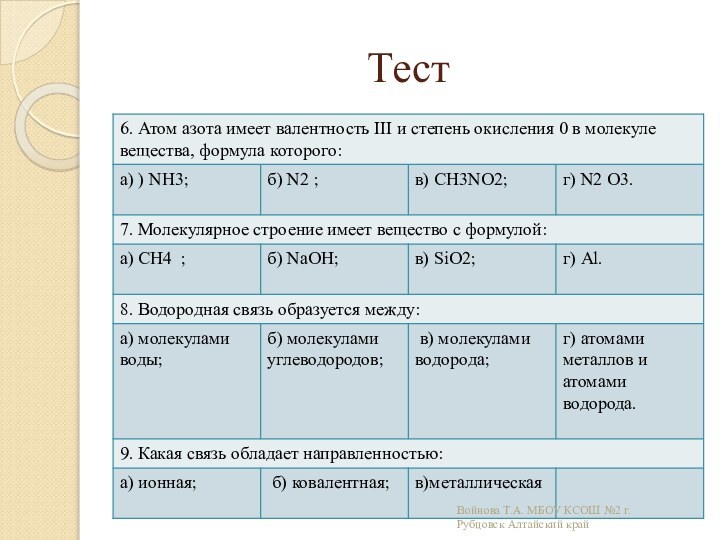
связи
Задачи.
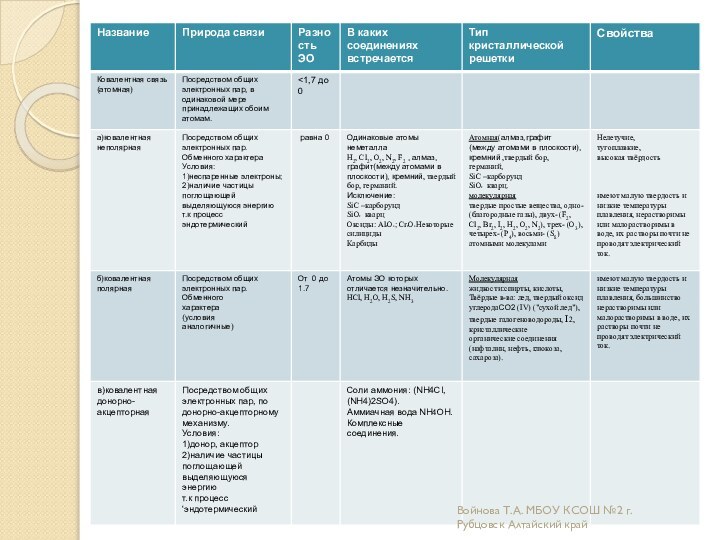
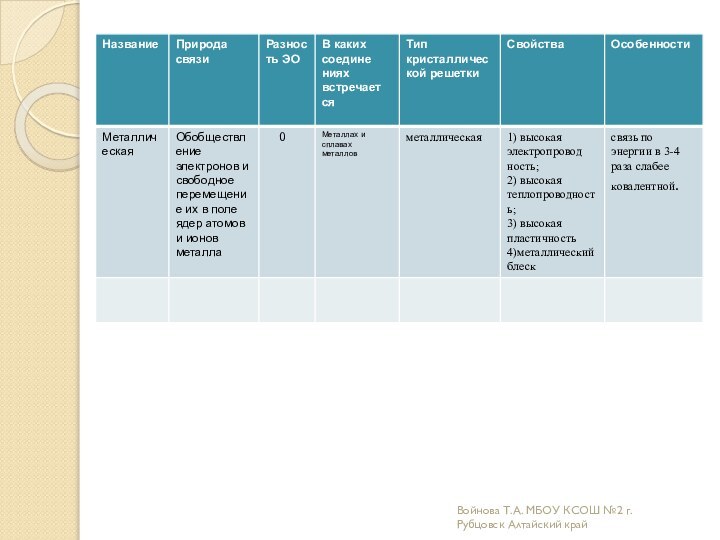
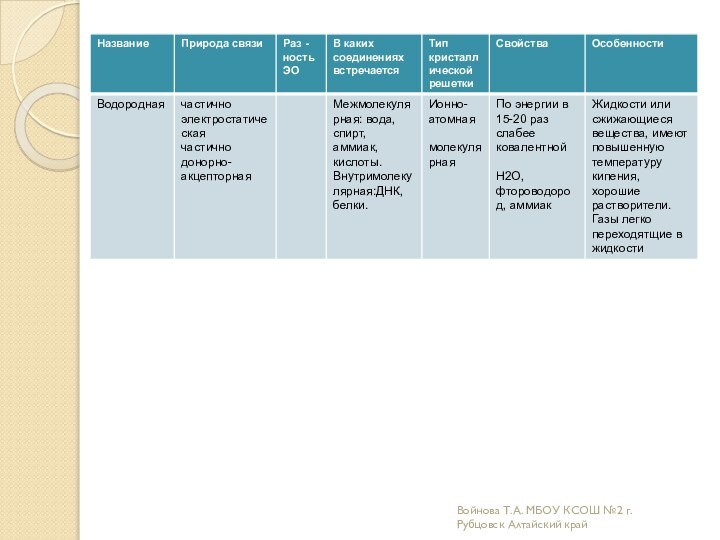
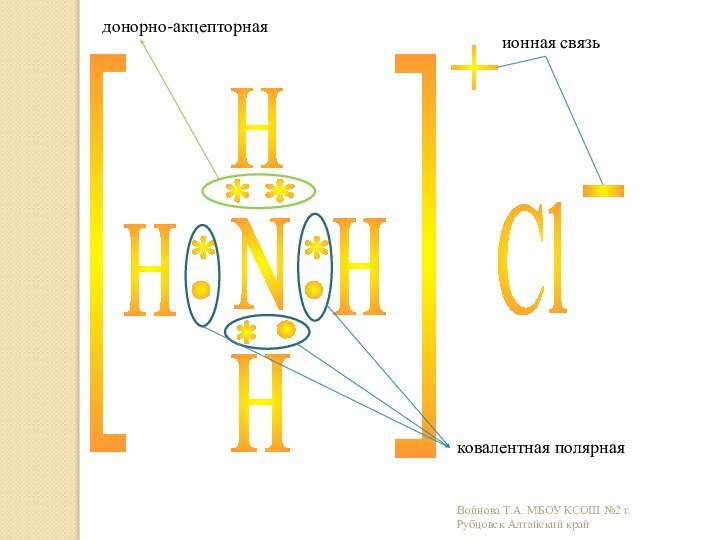
Образовательная: углубить и расширить знания о причинах возникновения разных
видов химической связи и механизмах их образования;дать более полное представление о всех типах кристаллических решеток ;
Развивающая: научить характеризовать химические связи по определенному плану;
научить соотносить зависимость физических и химических свойств веществ от вида химической связи и типа кристаллической решетки.
Воспитательная: развивать представления о взаимосвязи, взаимозависимости явлений окружающего мира.
Медиасоставляющая: используя различные справочники, дополнительную литературу, интернет ресурсы, материалы CD дисков, презентацию – сформировать целостное представление о химической связи.
Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край