Слайд 2
Молекула белка – макромолекула ( греч. «Макрос»
- большой, гигантский), обладает большой молекулярной массой
Сравните: молекулярная
масса спирта – 46
уксусной кислоты – 60
альбумина (одного из белков яйца) – 36000
гемоглобина – 152000
миозина (белок мышц) – 500000
Слайд 3
В клетке бактерий кишечной палочки - 5 тыс.
молекул органических соединений, из них – 3 тыс. -
белки.
В организме человека более 5 мил. белков
В клетке 10-20% сырой массы и 50-80% от сухой массы клетки составляют белки
белки называют протеинами – это название подчёркивает первостепенную роль этих веществ (греч. «протео» - занимаю первое место)
Без белков невозможно представить движение. способность расти, сократимость, размножение
Слайд 4
Белки – это сложные высокомолекулярные природные
соединения, молекулы которых построены из 20 остатков аминокислот и
представляет собой повторяющиеся участки –CH-CO-NH-,составляющих скелет молекул, и отдельных групп-радикалов R, R и R.
Слайд 5
ХИМИЧЕСКИЙ СОСТАВ
В белке следующие химические элементы: С, Н,
О, N, S, P, Fe.
Железо в
гемоглобине крови, фосфор в казеине молока….
Массовая доля элементов:
С – 50% - 55%;
О – 19% - 24%;
N – 15% – 19%;
Н – 6,5% - 7,3%;
S – 0,3% - 2,5%;
P – 0,1% - 2%
Слайд 6
СОДЕРЖАНИЕ БЕЛКА В НЕКОТОРЫХ ТКАНЯХ
(ПОСЛЕ ОБЕЗВОЖИВАНИЯ ОРГАНА):
Мышцы – 80%;
Почки – 72%;
Кожа – 63%;
Печень – 57%;
Мозг – 45%;
Жировая ткань, кости, зубы – 14 – 28%;
Семена растений – 10 – 15 %;
Стебли, корни, листья – 3% - 5%
Плоды – 1-2%
Слайд 7
КЛАССИФИКАЦИЯ БЕЛКОВ
По составу различают:
протеины, состоящие только аминокислот,
протеиды –
содержащие небелковую часть,
сложные – могут включать углеводы (гликопротеиды), жиры
(липопротеиды), нуклеиновые кислоты (нуклеопротеиды)
полноценные – содержат весь набор аминокислот
неполноценные – какие-то аминокислоты в них отсутствуют
Слайд 8
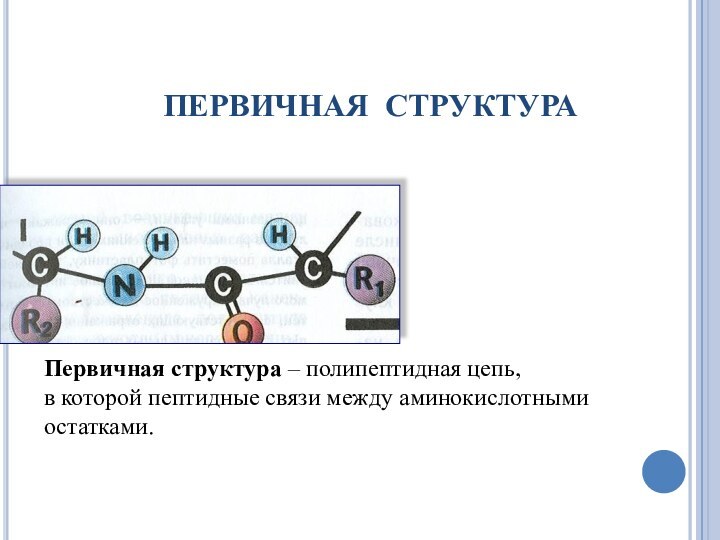
ПЕРВИЧНАЯ СТРУКТУРА
Первичная структура – полипептидная цепь,
в которой
пептидные связи между аминокислотными
остатками.
Слайд 9
Вторичная структура –
спираль, поддерживается
водородными связями,
каждая из
которых в 15 – 20 раз слабее ковалентной.
ВТОРИЧНАЯ
СТРУКТУРА
Слайд 10
В образовании третичной структуры большая роль
принадлежит радикалам.
За счёт которых образуются дисульфидные мостики,
сложноэфирные связи, водородные
связи, амидные связи.
Доказана третичная структура инсулина, рибонуклеазы
ТРЕТИЧНАЯ СТРУКТУРА
Слайд 11
ЧЕТВЕРТИЧНАЯ СТРУКТУРА
Четвертичная структура – это объединение нескольких трёхмерных
структур в одно целое.
Классический пример: гемоглобин, хлорофилл.
В
гемоглобине - гем небелковая часть, глобин белковая часть.
Слайд 12
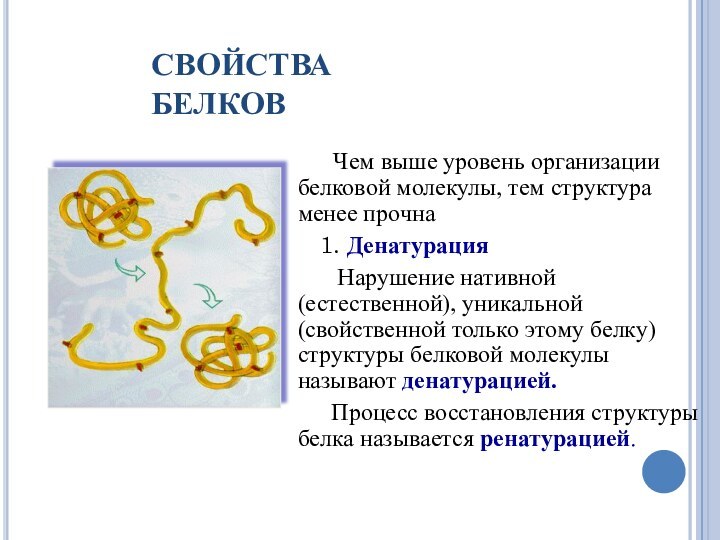
СВОЙСТВА БЕЛКОВ
Чем выше уровень организации белковой
молекулы, тем структура менее прочна
1. Денатурация
Нарушение
нативной (естественной), уникальной (свойственной только этому белку) структуры белковой молекулы называют денатурацией.
Процесс восстановления структуры белка называется ренатурацией.
Слайд 13
2. РАСТВОРИМОСТЬ
3.ПЕНООБРАЗОВАНИЕ
4. ГОРЕНИЕ.
5.ЦВЕТНЫЕ РЕАКЦИИ
а)Ксантопротеиновая реакция
Поместите кусочек прессованного
творога в пробирку и добавьте несколько капель азотной кислоты.
Осторожно нагрейте.
Слайд 14
ЦВЕТНЫЕ РЕАКЦИИ
б) Биуретовая реакция Налейте в пробирку 2
мл яичного белка. Добавьте такой же объем концентрированного раствора
гидроксида натрия и несколько капель раствора сульфата меди (II).