- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Генетичні аспекти онтогенезу
Содержание
- 2. Онтогенетика. Об'єкти і методиРозділ генетики, що вивчає
- 3. Деякі загальні закономірності та стадії індивідуального розвиткуВ
- 4. 5. Диференціація соматичних клітин і тканин може
- 5. Онтогенез багатоклітинних організмів умовно поділяють на такі
- 6. Генетична детермінація і диференціація клітин. ТотипотентністьОдин із
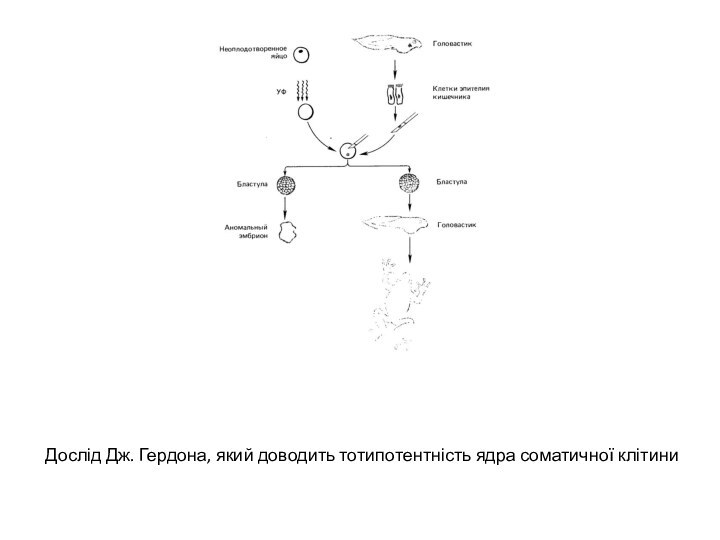
- 7. Дослід Дж. Гердона, який доводить тотипотентність ядра соматичної клітини
- 8. Спроби клонування ссавців за рахунок генетичної інформації
- 9. Відомо, ідо контроль первісних етапів диференціації клітин
- 10. Морфогени накопичуються вже в яйці дрозофіли, в
- 11. Приклад соматичного ембріогенезу як доказ тотипотентності диференційованих клітин флоеми моркви
- 12. Диференційна активність генів і її регуляція в
- 13. Диференційна транскрипція генів в онтогенезі забезпечує зміни
- 14. Перші поділи (дробління) зиготи обумовлюються виключно інформацією,
- 15. Диференціальна активність генівДиференціальна експресія генів, регуляція їх
- 16. Диференціальна трансляція, тобто синтез білка тільки на
- 19. Сигнали регуляції транскрипції в еукаріотРегуляція транскрипції по
- 21. Детермінація й диференціюванняРізні регуляторні сигнали, що забезпечують
- 24. Таким чином, індивідуальний розвиток багатоклітинних огранізмів представляє
- 25. Взаємодія генів в процесі розвиткуСтановлення певного фенотипу
- 26. Схема отримання алофенних мишей
- 27. Такі химерні організми можна також отримати, ін'єкуючи
- 28. Летальна диференціація клітин за розвитку еукаріотівВажливе значення
- 29. Скачать презентацию
- 30. Похожие презентации
Онтогенетика. Об'єкти і методиРозділ генетики, що вивчає генетичні основи індивідуального розвитку (онтогенезу), М. Ю. Лобашов назвав онтогенетикою. Це дуже багатобічний розділ, який включає дослідження в галузі генетики гамет, генетичної детермінації і диференціації клітин, становлення статі і






















Слайд 3
Деякі загальні закономірності та стадії індивідуального розвитку
В поняття
онтогенезу включають гаметогенез, а також процес розвитку, який розпочинається
з акту запліднення яйцеклітини і закінчується смертю організму. Важливо, що ще на стадії визрівання статевих клітин у них здійснюється комплекс генетико-біохіміч-них перетворень, необхідних для подальшого розвитку, в процесі якого відбувається 1) ріст і проліферація (розмноження) клітин, 2) диференціація клітин і тканин і 3) морфогенез, тобто розвиток органів і систем.За з'ясування генетичних основ індивідуального розвитку необхідно враховувати деякі узагальнення, які витікають із результатів досліджень у різних галузях біології (ембріології, генетиці, фізіології, біохімії та ін.):
1. Онтогенез багатоклітинних організмів являє собою складну послідовність змін, що контролюються генами. Це регульована реалізація в конкретних умовах генетичної програми розвитку, яка міститься в цитоплазмі і генотипі зиготи.
2. Кожний організм в ембріогенезі в тій чи іншій мірі проходить фази розвитку, характерні для його предків, що свідчить про генетичну зумовленість загального плану розвитку організмів і про спільність походження різних видів (біогенетичний закон Е. Геккеля).
3. В основі індивідуального розвитку багатоклітинних організмів лежить генетична детермінація і диференціація окремих клітинних клонів, що виникають внаслідок дробління зиготи і подальших мітотичних поділів.
Диференціація — це набуття клітинами здатності до виконання специфічних функцій, пов'язаних з їх спеціалізацією. Щодо генетичної детермінації клітин, то вона наступає ще до диференціації і являє собою стадію розвитку, після якої клітина втрачає здатність диференціюватися у напрямку, не передбаченому генетичною детермінацією.
4. Характерні для розвитку процеси росту, диференціації і морфогенезу є нерівномірними: в період росту переважають процеси, що сприяють мітотичній активності клітин (проліферації), а диференціація і морфогенез здійснюються на тлі високої активності інших генів, які забезпечують синтез специфічних білків, необхідних для формотворчих процесів і інтеграції спеціалізованих клітин. Ріст і проліферація клітин зумовлюються функцією так званих загальноклітинних генів (або «генів домашнього господарства»), а диференціація і морфогенез — активністю тканинноспецифічних генів (або так званих «генів роскоші»).
Слайд 4 5. Диференціація соматичних клітин і тканин може бути
зворотною і незворотною залежно від ступеня генетичної спеціалізації ядер
і цитоплазми в клітинах. Буває, що окрема клітина або група клітин диференційованої тканини зберігають здатність шляхом зворотної дедиференціації і наступної нової диференціації відтворити цілісний організм або певну його частину. Здатність клітин до такого зворотного диференціювання називають тотипотентністю. Соматичні клітини, що пройшли певний критичний рубіж своєї диференціації, втрачають тотипо-тентність і не здатні до відтворення організму та його частин.6. В онтогенезі рослин і тварин існують так звані критичні періоди, які, як правило, випадають на час інтенсивної ембріональної диференціації або вираженого морфогенезу. В ці періоди виявляється найбільша чутливість організмів до дії зовнішніх чинників, з допомогою яких можна викликати характерні в основному лише для даної стадії розвитку зміни (мутації, фенокопії мутацій, морфози). У різних організмів, що знаходяться в одному і тому ж критичному періоді розвитку, з допомогою ушкоджуючих агентів можна викликати, як правило, однотипні мутації та морфози. Це вказує на диференційну активність генів на різних стадіях онтогенезу.
7. Детермінація і диференціація клітин в абсолютній більшості випадків не пов'язані з кількісними або якісними змінами геномів і грунтуються значною мірою на епігенетичній спадковості. Суть її полягає в постійному відтворенні в ряду поколінь соматичних клітин такої надмолекулярної регуляції функцій хромосом, яка дозволяє експресуватися суворо визначеним наборам генів у кожному типі клітин.
Слайд 5 Онтогенез багатоклітинних організмів умовно поділяють на такі основні
періоди:
гаметогенез;
ранній ембріогенез — дробління зиготи і проліферація клітин з
моменту запліднення до перших виявів диференціації і морфогенезу;пізній ембріогенез — процеси диференціації клітин, гісто- і органогенезу;
постембріональний розвиток, під яким розуміють всі більш пізні етапи онтогенезу аж до старіння і смерті.
За винятком гаметогенезу всі ці періоди важко розмежувати у часі, тому поділ неперервного процесу розвитку на зазначені періоди є дуже умовним, але вкрай необхідним для дослідницької роботи
Слайд 6
Генетична детермінація і диференціація клітин. Тотипотентність
Один із прямих
доказів еквіпотенціальності клітин амфібій і ссавців є демонстрація тотипотентності
шляхом трансплантації ядра із диференційованої соматичної клітини в яйцеклітину з вилученим власним ядром. Добре відомий дослід Дж. Гердона, який продемонстрував можливість розвитку південноафриканської жаби Xenopus laevis на основі генетичної інформації ядра соматичної клітини. В цьому досліді власні ядра незапліднених яйцеклітин руйнували ультрафіолетовим опроміненням, а потім у кожне із яєць вводили ядро із клітин кишкового епітелію пуголовка. В окремих випадках із таких штучно сконструйованих клітин розвивалися дорослі жаби. Для доказу того, що в розвитку приймало участь саме трансплантоване ядро, а не власне ядро яйцеклітини використовували цитологічне маркування за кількістю ядерець у ядрі. Яйцеклітини отримували від особин, що мали два ядерця в ядрі кожної клітини. Донором ядер була особина, гетерозиготна по делеції ядерцевого організатора, і тому кожне клітинне ядро утримувало лише одне ядерце. Всі ядра в клітинах, отриманих внаслідок трансплантації в яйцеклітину чужого ядра, мали лише одне ядерце, що переконливо свідчило на користь чистоти проведеного експерименту. Отже, можна вважати, що інформація, необхідна для нормального розвитку, за мітотичних поділів ядром соматичної клітини не втрачається і може бути використана для повторного процесу розвитку.Слайд 8 Спроби клонування ссавців за рахунок генетичної інформації ядер
соматичних клітин довгий час були марними. Сенсаційним стало повідомлення
групи вчених, які під керівництвом Яна Уілмута (Шотландія) у 1997 р. отримали копію вівці за кличкою Доллі шляхом пересадки ядра її соматичної клітини в енуклейовану яйцеклітину. Така штучно отримана клітина після введення її в матку гормонально підготовленої вівці-реципієнта поділялася, як нормальна зигота. Це призвело до народження ягняти, яке за генотипом не відрізнялося від вівці-донора ядра.Подібне клонування сільськогосподарських та інших тварин сьогодні стає буденною справою і має велике практичне значення. Щодо клонування людини, то в технологічному відношенні воно стало цілком можливим, проте стикається з рядом етичних і психологічних проблем. Гарантувати відтворення індивідуальної особистості клону дуже важко, бо інтелект і все, що з ним пов'язане, принаймні на 50% залежить від умов життя та виховання. Слід зважити і на те, що реалізація потенційних можливостей ядерних генів певною мірою може залежати від особливостей цитоплазми яйцеклітини реципієнта та досконалості технології клонування.
Варто зазначити, що клонування сільськогосподарських тварин вже давно здійснюється штучним поділом раннього зародка на частини з наступним вирощуванням із них монозиготних близнюків.
Оскільки ембріональні клітини теплокровних тварин є генетично детермінованими, то це можна використати для отримання органів та тканин, необхідних для трансплантації в ветеринарії та медицині. Все більшого значення набуває розробка технології вирощування спеціалізованих тканин та органів із ізольованих стовбурних клітин, генетично детермінованих на певний тип диференціювання. Цим способом можна отримувати гістосумісний матеріал для трансплантацій без клонування самих організмів і без отримання монозиготних близнюків.
Слайд 9 Відомо, ідо контроль первісних етапів диференціації клітин визначається
позаядерними компонентами яйцеклітини, які накопичуються у ній в процесі
оогенезу. Деякі із таких компонентів — наприклад, детермінанти зародкових клітин дрозофіли — ідентифіковані. Визначена їх локалізація в яйці; встановлено, що вони поступають лише в клітини майбутньої генеративної лінії.У дрозофіли зазначені клітини походять від полярних клітин, які утворюються в задній частині яйця перед формуванням клітинної бластодерми. На цій стадії деякі із ранніх ядер дроб-ління мігрують у задню частину яйцеклітини, де є специфічні детермінанти полярних клітин. Існування цих детермінантів було доведено дослідами, в яких ооплазму задньої частини яйця вводили в передній кінець інших яйцеклітин. За цих умов виникав ембріон, що мав полярні клітини як на задньому, так і на передньому кінці. Під час гаструляції, коли розпочинається впорядкований рух клітин, полярні клітини мігрують у середину ембріона; нащадки цих клітин приймають участь в утворенні гонад і гамет дорослих мух.
Контрольні досліди показують, що ооплазма, взята не з задньої, а з інших частин яйцеклітини, за трансплантації не призводить до утворення полярних клітин.
Детермінація соматичних клітин зародка дрозофіли, тобто вибір цими клітинами певного шляху розвитку, здійснюється іншим способом, ніж детермінація полярних клітин. Головну роль в їх диференціації грає просторове розташування клітин ембріона. Останні використовують так звану позиційну інформацію, яка виникає ще в яйцеклітині за рахунок градієнтів концентрації певних сполук (морфогенів).
Морфогени — це детермінанти та індуктори, які кодуються спеціальними генами і забезпечують формотворчі процеси за розвитку ембріона. Один із таких морфогенів — продукт гена hedgehog — відповідає за детермінацію полярності сегментів ембріона дрозофіли.
Слайд 10 Морфогени накопичуються вже в яйці дрозофіли, в цьому
випадку вони є продуктами генів материнського організму. Крім морфо-генів,
які регулюють експресію генів клітин ембріона, в яйцеклітині накопичуються також про запас синтезовані іРНК, тРНК та ін. Все це обумовлює генетичну предетермінацію цитоплазми, завдяки якій дробління зиготи та ранній ембріогенез здійснюються з виявом материнського ефекту.Незважаючи на те, що ядра клітин на стадії бластодерми опиняються в неоднакових умовах з причини гетерогенності хімічного складу різних областей ооплазми, в більшості випадків це не викликає незворотних змін у генетичній інформації хромосом. Досліди свідчать, що основним механізмом розвитку соматичних клітин є диференційна, тобто різна у просторі і часі, експресія генів.
Висока тотипотентність соматичних клітин рослинних організмів надає великі можливості для дослідження дифе-ренційної активності генів в онтогенезі. Цілі рослини можуть регенерувати із клітин кал юса, отриманого шляхом культивування in vitro соматичних клітин і тканин, особливо клітин меристе-ми або флоеми, що мають найбільшу тотипотентність і добре розмножуються. За досить тривалого культивування недиференційовані клітини ка-люса іноді дають початок окремим органам рослини або навіть повністю всій рослині (регенерація) завдяки так званому соматичному ембріогенезові, як його назвав Б. П. Токін. Регенерація цілих організмів шляхом соматичного ем лих організмів шляхом соматичного ембріогенезу властива не тільки рослинам, але й деяким іншим організмам — губкам, кишковопорожнинним, нематодам та ін.
Порівнюючи спектри ізозимів, наприклад пероксидази, в не-диференційованій калюсній тканині і в диференційованих клітинах регенерантів, можна отримати важливу інформацію про механізми забезпечення диференційної експресії генів.
Слайд 11 Приклад соматичного ембріогенезу як доказ тотипотентності диференційованих клітин
флоеми моркви
Слайд 12 Диференційна активність генів і її регуляція в процесі
розвитку
Диференційна активність генів обумовлюється регуляцією їх експресії зовнішніми сигналами
Існує чимало механізмів, з домогою яких один і той же набір генів на різних стадіях розвитку і в різних умовах життєдіяльності організму детермінує синтез різних білків і в різній кількості Регуляція експресії генів може здійснюватися на рівні будь-якого матричного процесу реплікації, транскрипції, трансляції, а також таких нематричних процесів, як рекомбінація, дозрівання синтезованих іРНК і поліпептидних ланцюгів тощо. Молекулярні механізми цих найважливіших генетичних процесів добре з'ясовано; зараз необхідно звернути увагу на роль кожного з них у регулюванні експресії генів за розвитку.Диференційна реплікація забезпечує зміну якості та кількості генів, що контролюють розвиток певних ознак. Прикладом даного типу регуляції є ампліфікація генів рРНК, яка спостерігається в ядерцях ооцитів багатьох тварин, а також за мегаспорогенезу в рослинному світі. Це значно прискорює синтез рибосом в ооциті, необхідних для ранніх етапів розвитку У Xenopus laevis по закінченні ампліфікації вміст рДНК в яйцеклітині майже дорівнює кількості ДНК у диплоїдному наборі хромосом.
Про те, що реплікація в різних соматичних клітинах здійснюється диференційовано, свідчить факт утворення політенних хромосом лише в деяких типах клітин організмів. Відомо також, що в окремих ділянках гігантських хромосом слинних залоз двокрилих спостерігається різний ступінь політенізації*. Важливість диференційної реплікації для процесу розвитку підтверджується і тим, що розміри ре-пліконів на різних етапах диференціації клітин істотно змінюються.
Слайд 13 Диференційна транскрипція генів в онтогенезі забезпечує зміни кількісного
і якісного складу іРНК, необхідні на кожній стадії розвитку.
В цьому легко переконатися, спостерігаючи за утворенням профазних хромосом типу лампових щіток, які можна бачити на електронномікроскопічних препаратах ооцитів амфібій і птахів. По локалізації структур типу лампових щіток можна розпізнати активно функціонуючі гени ооцитів, а в окремих випадках — і деякі гени інших клітин. Оскільки хромосоми типу лампових щіток виникають у диплотені мейозу, вони складаються із чотирьох хроматид, і кожна ділянка таких хромосом представлена чотирма петлями.Петля — це ділянка ДНК з інтенсивною транскрипцією. В кожній з них можна знайти тонкий кінець, де розпочинає свій рух РНК-полімераза, і товстий кінець, де транскрипція закінчується.
Щойно синтезована РНК має вигляд гранул або фібрил, що оточують випетлену ДНК. З'ясовано, що в ооцитах тритонів кількість петель у хромосомах типу лампових щіток приблизно дорівнює кількості типів іРНК цитоплазми яйця. Більша частина цих іРНК не зв'язана з рибосомами і використовується лише після запліднення Запаси іРНК в яйцеклітині поповнюються, крім того, молекулами іРНК, які проникають із клітин яєчника. Через це у нащадків можуть виявлятися деякі ознаки, що не обумовлені ні генами яйця, ні сперматозоїда, але були властиві гетерозиготній матері.
В зрілих статевих клітинах генетична інформація повністю блокована і не транскрибується. В цитоплазмі зрілого яйця містяться репресори транскрипції: пересадка в незапліднену енуклейовану яйцеклітину ядра соматичної клітини, як правило, призводить до зупинки в ньому транскрипції, яка до цього була досить активною. Репресія транскрипції в сперматозоїді є, очевидно, наслідком тісно'і взаємодії його ДНК з білками протамінами.
За запліднення здійснюється взаємна дерепресія геномів матері і батька внаслідок так званої ембріональної індукції, проте реалізація інформації генів зиготи розпочинається значно пізніше.
Слайд 14 Перші поділи (дробління) зиготи обумовлюються виключно інформацією, що
міститься у цитоплазмі. При цьому реплікується ДНК, йде активний
синтез білка за рахунок отриманого із яйця запасу рибосом і РНК, але нові молекули РНК не синтезуються. Відомо, що в ембріогенезі жаб синтез іРНК, заблокований в кінці оогенезу, відновлюється лише після десяти поділів (дробління) зиготи, тобто посеред стадії бластули, коли зародок містить вже більше 1000 клітин; синтез тРНК розпочинається в кінці стадії бластули, а рРНК і нові рибосоми вперше утворюються тільки на стадії гаструли. В ембріогенезі мишей синтез різних типів РНК здійснюється значно раніше — на стадії 2—4 бластомерів, але і в цьому випадку перші стадії розвитку зародка спочатку виключно, а потім головним чином забезпечуються інформацією, отриманою від матері через цитоплазму яйця у складі інформосом та інших молекулярних структур. Встановлено, що зиготи амфібій і безхребетних тварин з вилученими ядрами здатні нормально розвиватися до стадії бластули.Експресія генів батьківського геному здійснюється дещо пізніше, ніж материнського; у мишей це відбувається на стадії бластули.
На перших стадіях ембріогенезу (у амфібій — до пізньої бластули) реалізується головним чином та частина генетичної інформації, що має відношення до загальних процесів метаболізму, властивих всім проліферуючим клітинам. Потім відбувається поступова де-репресія тканинноспецифічних генів, тобто розпочинається диференціація клітин зародка. На стадії гаструли і пізніше відокремлюються так звані стовбурові клітини, клони яких дають початок різним тканинам і органам. Ці перетворення здійснюються шляхом диференційного зчитування генетичної інформації хромосом, а в деяких випадках — ще й шляхом незворотних перебудов генетичного матеріалу.
Слайд 15
Диференціальна активність генів
Диференціальна експресія генів, регуляція їх активності
залежно від сигналів, що надходять ззовні, може відбуватись на
рівні будь-якого відомого матричного процесу; реплікації, транскрипції, трансляції, а також у процесі дозрівання іРНК і поліпептидних ланцюгів, що утворюються в результаті трансляції.Диференциальна реплікація окремих ділянок генетичного матеріалу відома в прокаріот і в еукаріот. Індукція й наступна реплікація профага λ являють собою приклад диференціальної реплікації у бактерій. Ампліфікацію екстрахромосомних копій ДНК, що кодує рРНК, спостерігали в ядерцях ооцитів багатьох тварин, а також при мегаспорогенезі у рослин. Ампліфікація рДНК полягає в тому, що одна з її копій, що містить багаторазові повтори генів, що кодують рРНК, залишає хромосому – ділянку ядерцевого організатора й потім багаторазово реплікується по механізму кільця, що котиться). Цим досягається посилений синтез рибосом в ооциті, що забезпечує ранні етапи розвитку після запліднення. Відомо, що сперматозоїд вносить у зиготу тільки ядерний матеріал і перші стадії дроблення аж до гаструли забезпечуються цитоплазмою, а отже, і рибосомами яйцеклітини.
У гігантських хромосомах слинних залоз двокрилих спостерігається більша політенізація окремих ділянок хромосом. Саме утворення политенных хромосом вказує на те, що реплікація в різних соматичних клітинах відбувається неоднаково. Про це ж свідчить і порівняння репліконів - одиниць реплікації різних соматичних клітин. Розміри репліконів у ході диференціювання тканин змінюються. Диференціальна транскрипція генів в онтогенезі добре помітна при утворенні хромосом типу лампових щіток. Петлі лампових щіток, що виникають на стадії діплотени, активно транскрибуються, що добре видно на електронно-мікроскопічних препаратах ооцитов амфібій і птахів.
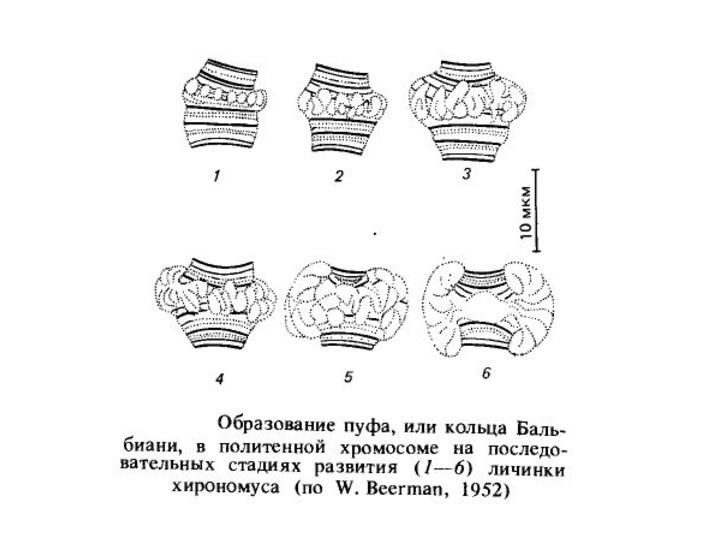
Інший яскравий приклад диференціальної транскрипції пов'язаний з утвором так званих пуфів або кілець Бальбіані в гігантських хромосомах двокрилих. Пуфи - це характерні здуття певних дисків политенных хромосом, щоутворюються в результаті локальної декомпактизации в них ДНК активною транскрипцією, на що вказує інтенсивне включення 3 Н-уридину в районі пуфів на препаратах політенних хромосом.
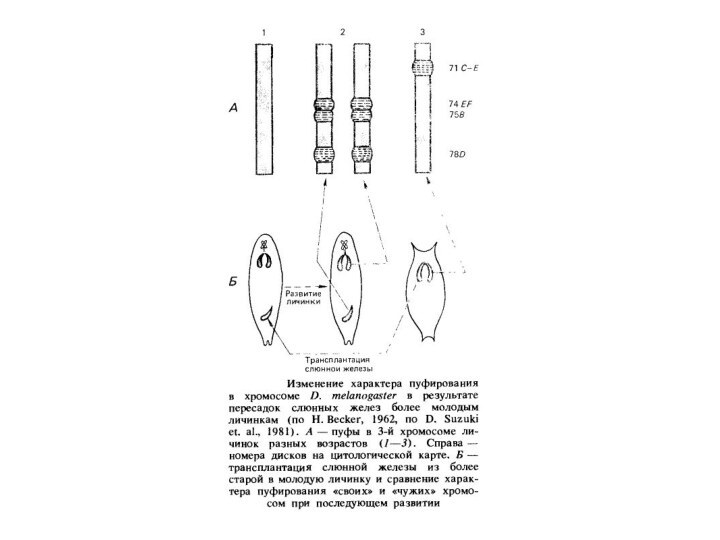
Пуфування тих або інших дисків характерно для стадії розвитку личинки. Утвореня й зникнення пуфів регулює внутрішнє середовище організму у відповідності зі стадією розвитку. Якщо слинні залози личинки дрозофіли пересаджувати більш молодим або більш старим личинкам, то картина розподілу пуфів міняється відповідно до тієї, яка характерна для віку реципієнта.
Одним з важливих регуляторів утвору пуфів і, отже, диференціальної транскрипції генів у комах є стероїдні гормони, зокрема гормон линяння - екдизон. Показане також вплив білків, синтезованих більш ранніми пуфами, на розвиток більш пізніх пуфів.
Зміна структури хроматину, його декомпактизація, що спостерігається при утворі пуфів, також є однією з умов, що забезпечують диференціальну активність генів.
Слайд 16 Диференціальна трансляція, тобто синтез білка тільки на певних
іРНК або регуляція синтезу білка на одній і тієї
ж іРНК, показана для РНК-містячих бактеріофагів Е. coli, a також при синтезі глобінів на стабільних іРНК без'ядерних ретикулоцитів ссавців. В останньому випадку показано, що надлишок геміну стимулює синтез глобина. Гемининактивирует білок, який репресує, тобто "забороняє" синтез α- і β- ланцюгів глобина. На цій же моделі показане, щодеякі фракції трнк відіграють роль модуляторів, що задають темп трансляції.трнктанк,трак,трек,трок,трюк- модуляторислужать, що лімітує фактором у трансляції,Можливість диференціальної трансляції ґрунтується на існуванні стабільних іРНК, а також на збереженні іРНК у цитоплазмі у вигляді інформосом - комплексу іРНК із білками, відкритих А. С. Спіріним і ін. (1966).
Диференціальне дозрівання продуктів транскрипції й трансляції. Дозрівання транскриптів має на увазі модифікацію їх окремих основ і сплайсинг про- іРНК. Кілька варіантів сплайсинга однієї й тієї ж про- іРНК показані для мавпячого вірусу SV 40.
Активність багатьох білків визначається їхньою посттрансляційною модифікацією - фосфорилюванням, ацетилуванням, а в ряді випадків розщепленням вихідному поліпептидному ланцюга на більш дрібні фрагменти.
Широко розповсюджений механізм регуляції активності ферментів, заснований на приєднанні до них молекул-ефекторів. Найчастіше в ролі ефекторів виступають кінцеві продукти ланцюгів біосинтезу, які зв'язуються з першим або з одним з перших ферментів даного метаболичного шляху й пригнічують його активність, тим самим виключаючи весь ланцюг синтезу. Це інгібування кінцевим продуктом завдяки якому регулюються відразу кілька етапів метаболізму. Кінцевий продукт зв'язується з ферментом не в його активному центрі, а в алостеричному центрі і така взаємодія індукує зміну (інактивацію) активного центру ферменту.
Таким чином, диференціальна амивность генетическою матеріалу можемо забезпечуватися регуляцією різних рівнівйого експресії: від реплікації до ферментативної активності білків - генних продуктів.
Слайд 19
Сигнали регуляції транскрипції в еукаріот
Регуляція транскрипції по типу
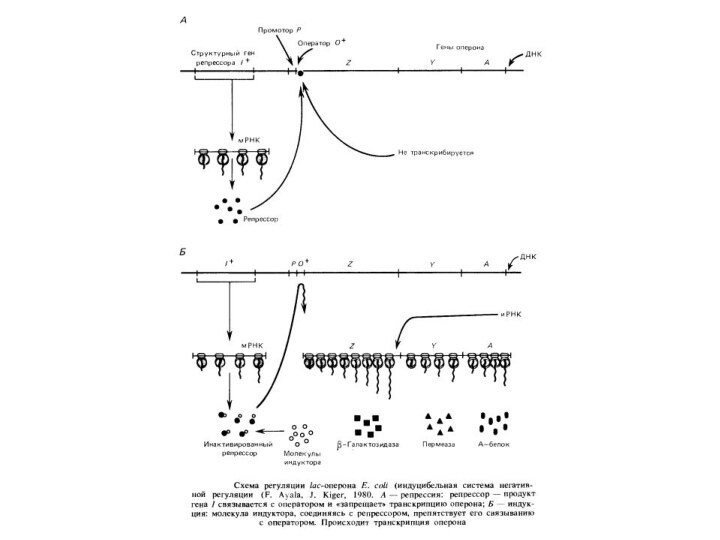
оперона характерна для прокаріот і їх вірусів- бактеріофагів. Важливою
особливістюопе- ронов бактерій і фагов є послідовності, що полягають із оператора й наступних за ним структурних генів,транскрибируемых як одне ціле. В эукариот такі системи не знайдені, хоча в них є промоторные області. Для генів дріжджів, наприклад, звичайна TATA - послідовність Хогнесса, необхідна для ініціації транскрипції. Термінатори транскрипції - також обов'язкові елементи эукариотических генів.Проте координована регуляція транскрипції навіть незчеплених генів відома й в эукариот. Наприклад, у клітках нижчихэукариот - дріжджів розшифровані ділянки ДНК, що передують багатьом генам біосинтезу амінокислот і підстав. Наявність такої послідовності: 5'-TGACTC-3' (або близької до неї) необхідно для регулювання біосинтезу амінокислот. Як показали експерименти з локусом HIS4 Sacch. cerevisiae, делеции ц ділянк, локалізован у области, що некодирующей, перед началом транскрипции, делают
Очевидно, присутність повторів такого роду перед декількома генами - необхідна умова їх координованої регуляції, яка спостерігається в багатоклітинних при дії багатьох гормонів. Відомо також, що посередником у регуляторній дії гормонів служить цамф.
Поряд зі звичайними нуклеотидными послідовностями промоторной і терминаторной областей транскрипції вэукариот виявлені такі специфічні елементи регуляції, як підсилювачі, або энхансеры (enhansers), і глушителі (silencers). Энхансеры вперше були знайдені в геномі вірусу SV 40. Це послідовність довжиною в 72 п. н., повторенатандемно. Вона підвищує ефективність транскрипції із промоторів вірусу, перебуваючи на своєму звичайнім місці, поблизу ori - початку реплікації вірусного генома, а також при штучнім перенесенні в інші ділянки цього генома, що має розмір 5243 п. н. Аналогічні энхансеры виявлені в геномі ссавців. У них відсутня видима протяжна гомологія. Вони діють як підсилювачі транскрипції, перебуваючи на відстані кількох сотень і навіть тисяч пара нуклеотидов від регульованого гена. Механізм дії энхансеров може бути пов'язаний зі зміною нуклеосомной структури хроматину.
Інший тип сигналів регуляції транскрипційної активності в эукариот- глушителі - виявлені в Sacch. cerevisiae. Це послідовність довжиною 262 п. н., яка містить ділянку, гомологичный ARS - початку реплікації (див. гл. 6). Розташовуючись у декількох сотнях пар нуклеотидов до або після регульованого гена, вона виключає транскрипцію, змінюючи структуру хроматину. Показане, що глушитель, функціонуючи, взаємодіє із продуктами декількох генів, мутації в яких роблять глушитель неактивним і тим самим " транскрипцію із промотору регульованого гена.
Найбільше докладно вивчена регуляція генів, що контролюють засвоєння галактози й синтезу изозимов кислих фосфатаз в Sacch. cerevisiae. Показане, що ці системи регуляції діють як на рівні транскрипції, так і напосттранскрипционном рівні. При цьому здійснюється багатоступінчаста, або каскадна, регуляція, у якій беруть участь елементи позитивного й негативного контролю, що послідовно регулюють активність один одного. Цілісна схема регуляції дії гена в эукариот поки не побудована для жодної системи.
Слайд 21
Детермінація й диференціювання
Різні регуляторні сигнали, що забезпечують включення
й вимикання генів, очевидно, являють собою важливу складову частину
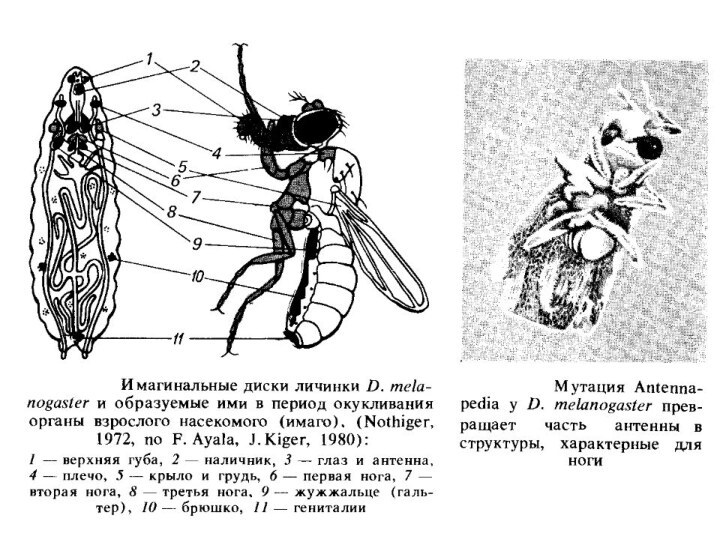
механізму дифференцировки кліток. Дифференцировка клітин, або їх онтогенетическая дивергенція, відбувається на основі детермінації певного клітинного типу. Детермінація - це встановлення функціонального стану, що веде до певного процесу розвитку, до дифференцировке в певному напрямку.Стан детермінації, наслідуваний при митотических поділах клітини, вивчений в D. melanogaster.
Після запліднення ядро зиготи в дрозофилы ділиться кілька раз, і тільки після 12 поділів ядра відокремлюються на периферії яйця в самостійні клітини, що формують бластодерму. Ці клітини вже детерміновані до розвитку різними шляхами, і личинка дрозофіли, що з'являється з яйця, вже містить не тільки личинкові клітки, але й клітки імаго - дорослої комахи. Ці клітини в міру росту личинки (і послідовних линьок) діляться й утворюють так звані імагінальні диски. Доля клітин цих дисків вже визначена.
У тому, що стан детермінації успадковується при мітотичних поділах, можна переконатися, пересаджуючи імагинальні диски в черевце дорослої мухи. При цьому диференціювання імагинальних дисків не відбувається. Якщо після серії таких послідовних трансплантацій імагинальний диск пересадити в порожнину тіла личинки, готової до окукливання, то доросла муха буде мати додатковий орган: око, крило, ногу і т.д. відповідно до тем, якийимагинальный диск був узятий.
Стан детермінації, установлювані ще на стадії бластодерми в дрозофилы, порушують так звані гомеозисные мутації. До них належать : antennapedia - перетворення антен у ноги; ophthalmoptera - розвиток крила з имагинального диска ока; proboscipedia - розвиток ноги або частини антени (залежно від температури) замість хоботка; у мутантів tumorous head тканини голови заміщаються іншими типами тканин, включаючи структури, характерні для гениталий, і т.д. У гомеозисных мутантів порушений сам процес детермінації дисків, що й приводить надалі до помилок диференціювання. Гомеозисні мутанти дрозофіли - зручна модель для вивчення детермінації.
Завдяки клонуванню гомеозисных генів і гібридизації ДНК із різних джерел показано, що всі досліджені гомеозисні гени дрозофилы містять ділянка однакової нуклеотидной послідовності, названої гомеодоменом.Гомологичные послідовності знайдені в ДНК амфібій, мишей, людину й у локусі типів спарювання в дріжджів. Продуктом їх є білок або пептид, що зв'язується із ДНК і виконуючий регуляторні функції.
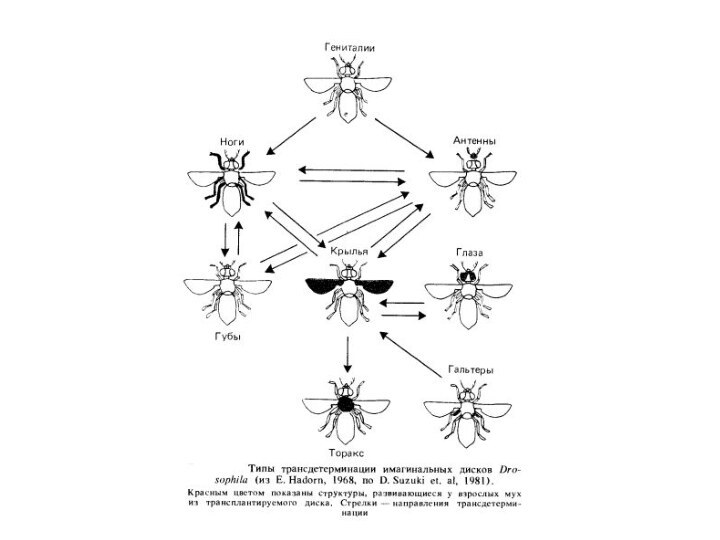
Інший приклад порушення детермінації, виявлений у дрозофилы, полягає в тому, що іноді в процесі трансплантації через черевце дорослих мух клітки имагинального диска трансдетерминируются. Трансдетерминация виражається втому, що, наприклад, имагинальный диск гениталий після перетворення в окукливающейся личинці диференціюється не в підлоговий апарат, а в ногу. Трансдетерминация не відбувається випадково, а додержується певнимзакономірностей. Наприклад, имагинальный диск гениталий може перетворитися в диск ноги, але ніколи не перетворюється безпосередньо в диск ока. Механізм цього явища ще не з'ясований, однак уже показане, щотрансдетерминация здійснюється в тих же напрямках, що й гомеозисные мутації, тобто трансдетерминация - цефепокопії гомеозисних мутацій.
Слайд 24 Таким чином, індивідуальний розвиток багатоклітинних огранізмів представляє собою
складний ланцюг змін, які контролюються генами. При цьому здійснюється
диференціальна експресія генів, яка регулюється на різних рівнях від реплікації до просторової модифікації білків та збірки надмолекулярних структур. У багатьому регуляторні процеси у еукарітів ще не розшифровані. Вочевидь, для поняття генетичних закономірностей онтогенезу уявлень про диференційну експресію генів ще недостатньо. Відбуваються зміни самого генетичного матеріалу, наприклад при диференціюванні лімфоцитів, детермінації клітинних типів у дріждів і в інших випадках. Все ще не до кінця зрозуміла роль цитоплазми в детермінації клітин, так же як і в многому не ясно сопідлеглість генетичних механізмів детермінації та диференціювання.
Слайд 25
Взаємодія генів в процесі розвитку
Становлення певного фенотипу в
онтогенезі є наслідком не тільки диференційної експресії генів, але
й складної взаємодії останніх у процесі розвитку.Взаємодія генних продуктів у еукаріотів може відбуватися на різних рівнях — не тільки внутрішньоклітинному, але й міжклітинному, а також на рівні органів і систем. Одна із найбільш складних міжклітинних форм взаємодії генів в онтогенезі — це гормональна регуляція біологічних процесів, в першу чергу таких, як транскрипція і трансляція. Однак є чимало і інших прикладів взаємодії генів на міжклітинному рівні.
Дуже важливу інформацію про взаємодію генів різних клітин вдалось отримати завдяки дослідженням на алофенних тваринах . Алофенними називають химерні організми, які розвиваються із суміші бластомерів двох або декількох генетично відмінних зародків.
У мишиного ембріона на стадії восьми бластомерів всі клітини є рівноцінними, а в більш пізні строки виявляються біохімічні та інші відмінності, пов'язані з диференціюванням клітин трофоектодерми і внутрішньої клітинної маси.
Про те, що клітини раннього зародка ссавців у генетичному відношенні є рівнозначними, свідчать факти народження ідентичних близнюків. Останні утворюються із бластомерів, які виникають внаслідок поділу однієї зиготи.
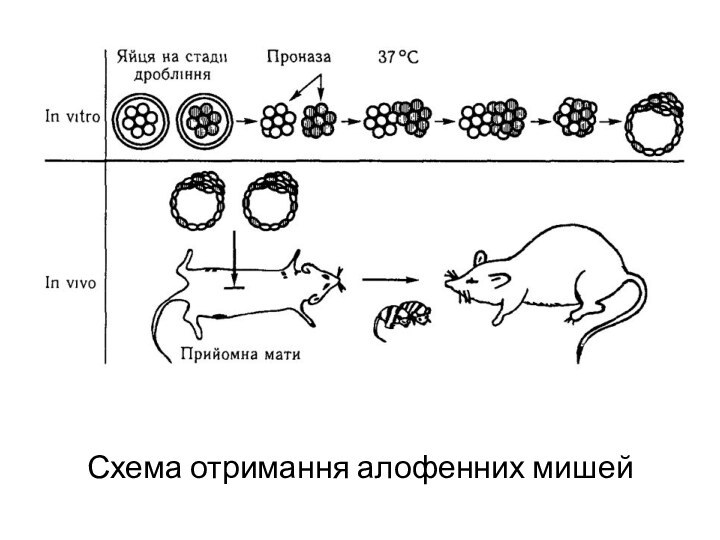
Якщо взяти два мишиних ембріони на стадії восьми бластомерів і об'єднати їх в одну гігантську морулу, то із останньої в матці названої матері може розвинутися мишеня нормальної величини, але з генетично неоднорідними сегментами тіла (алофенна миша). Наприклад, якщо одна пара батьків належить до лінії з білим забарвленням шерсті, а друга пара — до лінії з чорною шерстю, то їх химерні нащадки будуть строкатими: в забарвленні шерсті мишенят чередуються білі і чорні плями у відповідності з розподілом в тілі клонів генетично неоднорідних клітин.
Слайд 27 Такі химерні організми можна також отримати, ін'єкуючи клітини
ранніх ембріонів у бластоцисти іншого генотипу. Химеру можна отримати
навіть після ін'єкції однієї клітини. Цей методичний підхід дає можливість з'ясувати, наскільки та чи інша клітина зародка зберегла тотипотентність. Результати таких досліджень переконливо свідчать про те, що клітини ранніх зародків ссавців (принаймні восьмиклітинної стадії) є тотипотентними і взаємно сумісними. Із цього можна зробити висновок, що імуногенетичні механізми гістонесумісності формуються у ссавців на більш пізніх стадіях розвитку.Приклади особливо складної взаємодії генів за диференціації клітин дає імуногенетика — наука, яка з'ясовує спадкові фактори імунітету, включаючи ті, що визначають різноманітність і специфічність імуноглобулінів. Крім прикладів комплементарності генів, які кодують легкі та важкі субодиниці антитіл, імуногенетика дає переконливі докази можливості незворотних онтогенетичних перебудов структури геному в процесі розвитку шляхом рекомбінацій, делецій та інших змін.
Слайд 28
Летальна диференціація клітин за розвитку еукаріотів
Важливе значення в
онтогенезі більшості еукаріотів має генетично запрограмоване швидке розмноження одних
типів клітин і летальна диференціація клітин інших типів. Відмирання певних диференційованих клітин властиве нормальному розвитку вищих організмів. Прикладами можуть бути: руйнування тканин і органів личинки за метаморфозу у комах, клітин хвоста і зябер при перетворенні пуголовка на жабу, клітин міжпальцевих перепонок у ембріонів хребетних тварин і т. п. В усіх цих та інших прикладах генетично запрограмована смерть клітин (апоптоз) наступає на чітко визначеній стадії онтогенезу і контролюється генами, мутації яких можуть істотно змінити хід розвитку. Так, уроджена виродливість — ластопалість — у людини визначається домінантним мутантним геном, за наявності якого клітини ембріона, що з'єднують пальці, не відмирають, і пальці залишаються з'єднаними.Гіпотеза запрограмованої загибелі клітин (апоптозу) передбачає, що в клітині шляхом диференційованої експресії генів незво-ротно здійснюється генетична програма, яка приводить до смерті. Ця гіпотеза ґрунтується на численних дослідженнях, які у XX ст. провадив Л. Хейфлік. Він встановив, що фібробласти людини ростуть у культурі лише обмежений час. Після певної кількості поділів вони втрачають мітотичну активність і відмирають. Кількість поділів клітин у культурі залежить від віку донора. Якщо клітини беруть у плода, то вони можуть поділятися приблизно ще 50 разів; клітини новонародженого поділяються в культурі не більше 20-30 разів, а клітини людей зрілого віку на штучному середовищі дають лише декілька поколінь. Отже, кількість поділів клітин in vitro приблизно відповідає тій, яка властива даним клітинам протягом життя людини.





























