Слайд 2
Метаболизм аминокислот
Основным экзогенным источником аминокислот являются белки пищи, они

переводятся в доступную для организма форму при переваривании под
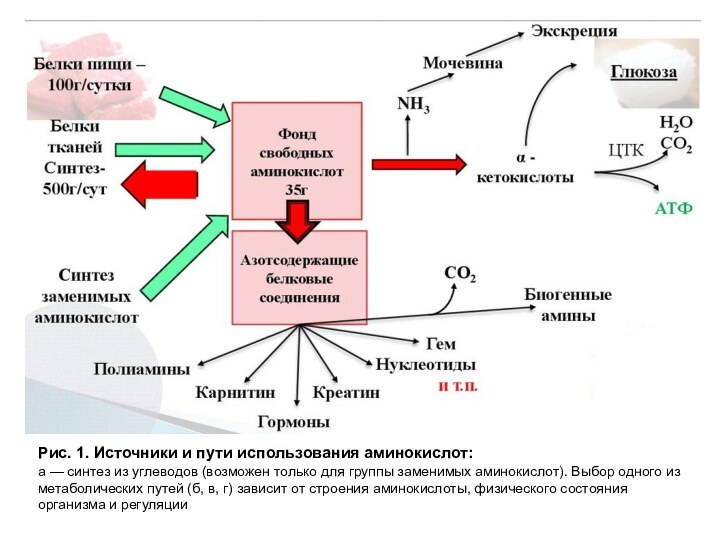
действием протеолитических ферментов, входящих в состав желудочно-кишечных секретов. Свободные аминокислоты всасываются и после транспорта кровью включаются в клетках в различные метаболические пути, главным из которых является синтез собственных белков. Аминокислоты используются для синтеза других азотсодержащих соединений, например таких, как тироксин, адреналин, гистамин, выполняющих специфические функции. Аминокислоты служат также источником энергии, включаясь в путь катаболизма. Источники аминокислот и пути их использования представлены на рис. 1.
Распад тканевых белков (~ 400 г в сутки) не обеспечивает затрат аминокислот, необходимых при использовании их как исходных веществ для катаболизма или синтеза других азотсодержащих соединений. Синтез аминокислот из углеводов также не обеспечивает всех потребностей организма, так как из углеводов возможен синтез лишь углеродной части аминокислот, называемых заменимыми. Основным источником аминокислот являются белки пищи.
Слайд 3
Рис. 1. Источники и пути использования аминокислот:
а —
синтез из углеводов (возможен только для группы заменимых аминокислот).
Выбор одного из метаболических путей (б, в, г) зависит от строения аминокислоты, физического состояния организма и регуляции
Слайд 4
Метаболизм аминокислот.
Азотистый баланс
Азотистый баланс — это разница
между количеством азота, поступающего с пищей, и количеством выделяемого
азота (в основном в составе мочевины). 95% всего азота в организме приходится на долю аминокислот. Следовательно, азотистый баланс характеризует состояние белкового и аминокислотного обмена.
Азотистое равновесие (количество выводимого азота равно количеству поступающего) характерно для здорового человека с нормальным ритмом питания.
Положительный азотистый баланс (выводится азота меньше, чем поступает) имеет место в период роста организма или при выздоровлении после истощающих заболеваний.
Отрицательный азотистый баланс (выводится азота больше, чем поступает) характерен для течения истощающих заболеваний, состояния голодания, старения.
Слайд 5
Метаболизм аминокислот.
Переваривание белков
Белки представляют собой высокомолекулярные полимеры,

образованные 20 аминокислотами, соединенными пептидными связями. В желудочнокишечном тракте
белки подвергаются гидролитическому расщеплению доаминокислот-мономеров, которые всасываются и затем поступают в клетки тканей.
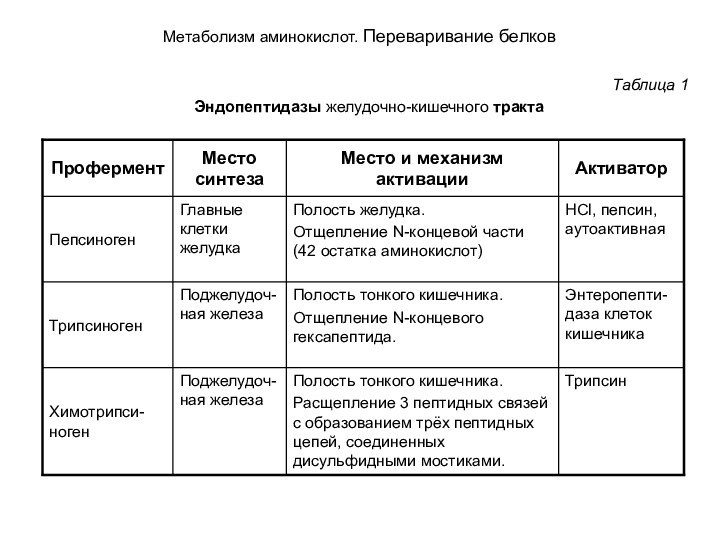
Переваривание пищевых белков начинается в желудке и завершается в тонком кишечнике под действием протеолитических ферментов (пептидгидролаз, пептидаз, протеаз —названия-синонимы). В соответствии с механизмом действия эти ферменты делят на две группы: эндо- и экзопептидазы. Эндопептидазы: пепсин, трипсин и химотрипсин, расщепляют пептидные связи, расположенные во внутренних участках полипептидной цепи. Они синтезируются в виде неактивных предшественников проферментов. Таким способом секретирующие клетки защищают свои собственные белки от разрушения этими ферментами. После секреции проферменты активируются в просвете желудка или кишечника путем частичного протеолиза (табл.1). В норме слизистая оболочка желудка и кишечника защищена от действия протеаз слоем слизи. Поверхностный полисахаридный слой плазматической мембраны также предохраняет клетку от действия протеаз.
Слайд 6
Метаболизм аминокислот. Переваривание белков
Таблица 1
Эндопептидазы желудочно-кишечного тракта
Слайд 7
Метаболизм аминокислот.
Переваривание белков в желудке
Большинство нативных пищевых

белков имеют структуру компактной глобулы и поэтому значительная часть
пептидных связей недоступна для гидролитических ферментов. Отсюда возникает необходимость в предварительной денатурации белка, которая происходит в желудке, содержимое которого имеет pH ~ 2 благодаря секреции обкладочными клетками слизистой HCl. В кислой среде нарушаются многие слабые связи, стабилизирующие белковую глобулу, она разворачивается, делая доступными связи для протеолиза. Соляная кислота выполняет и другие функции:
создает барьер, препятствующий попаданию патогенных бактерий в кишечник;
участвует в активации пепсиногена.
Пепсиноген в присутствии HCl приобретает частичную протеолитическую активность вследствие протонирования некоторых групп и изменения конформации. Активированный таким образом пепсиноген катализирует отщепление от другой молекулы пепсиногена N-концевойчасти, содержащий 42 аминокислоты, переводя фермент в активную форму. Образованный пепсин катализирует превращение других молекул пепсиногена. Таким образом, продукт реакции — пепсин ускоряет свое собственное образование. Подобный тип активации называется аутоактивацией.
При многих заболеваниях желудочно-кишечного тракта нарушается секреция HCl и пепсиногена. Изменение концентрации HCl и пепсина в желудочном соке используется для диагностики некоторых заболеваний желудка.
Слайд 8
Метаболизм аминокислот.
Переваривание белков в кишечнике
Частично переваренная в

желудке пища (химус) далее попадает в двенадцатиперстную кишку. Кислый
химус стимулирует выделение клетками кишечника в кровь гормонов секретина и холецистокинина, которые, в свою очередь, стимулируют секрецию панкреатического сока. Ионы НСО3-,содержащиеся в панкреатическом соке, нейтрализуют желудочный сок, повышая pH до ~7, и создают оптимальную среду для действия панкреатических ферментов трипсина и химотрипсина.
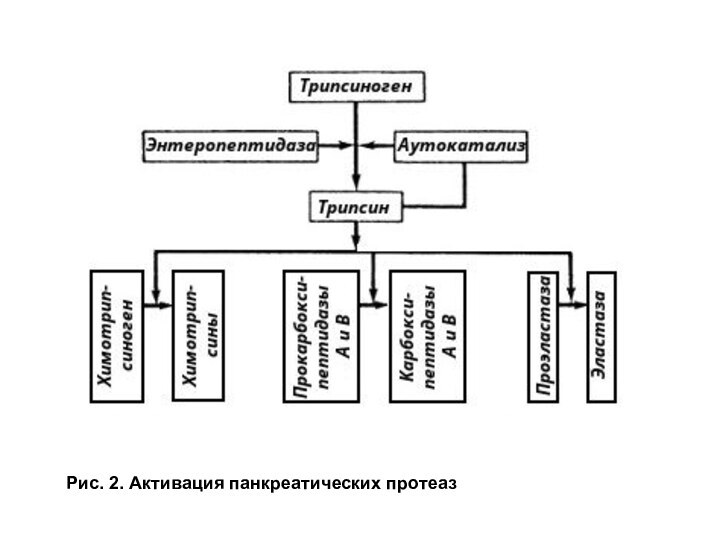
Активация трипсиногена происходит под действием фермента энтеропептидазы, синтезируемой клетками кишечника. Этот фермент отщепляет N-концевой гексапептид трипсиногена, что сопровождается изменением конформации и образованием активного фермента. Энтеропептидаза катализирует образование лишь небольшого количества трипсина. Основное количество трипсина образуется из трипсиногена в результате аутоактивации.
Другие проферементы поджелудочной железы: химотрипсиноген, прокарбоксипептидаза, проэластаза, активируются трипсином путем частичного протеолиза (рис. 2).
Слайд 9
Рис. 2. Активация панкреатических протеаз
Слайд 10
Метаболизм аминокислот. Переваривание белков в кишечнике
Действие эндопептидаз на
белки различается по субстратной специфичности. Эти ферменты гидролизуют с наибольшей
скоростью пептидные связи, образованные определенными аминокислотами.
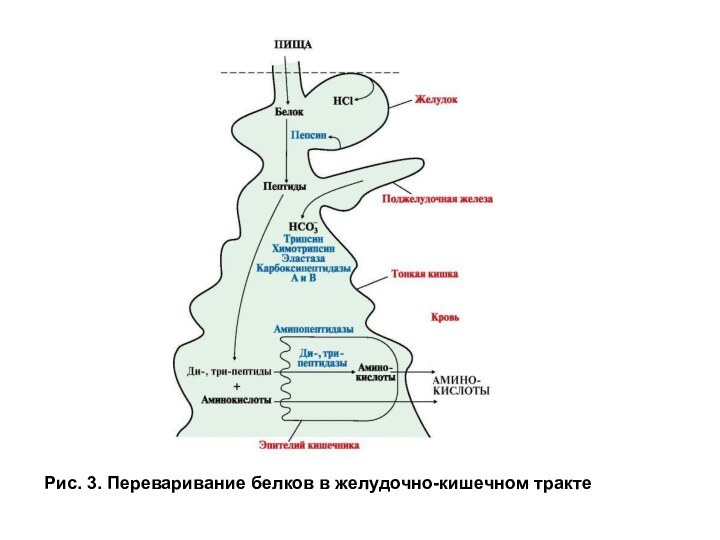
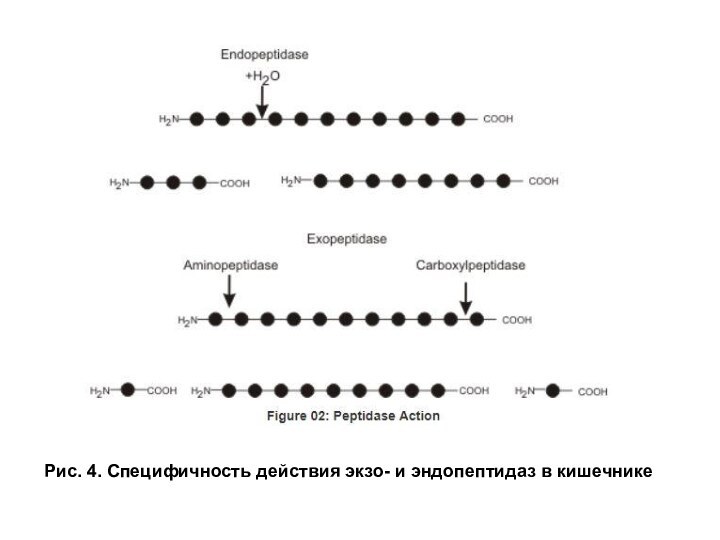
Экзопептидазы. Карбоксипептидазы и аминопептидазы гидролизуют пептиды, отщепляя аминокислоты соответственно от С- и N- конца пептида. Дипептидазы расщепляют пептидную связь в дипептидах. Карбоксипептидаза синтезируется в поджелудочной железе в виде прокарбоксипептидазы и активируется в кишечнике под действием трипсина. Амино- и дипептидазы синтезируются в клетках тонкого кишечника. Все кишечные экзопептидазы функционируют в основном внутриклеточно в щелочной каемке эпителия, хотя могут в небольшом количестве выделяться в просвет кишечника. Эндопептидазы и экзопептидазы в совокупности завершают гидролиз белков образованием аминокислот (рис. 3, 4).
Слайд 11
Рис. 3. Переваривание белков в желудочно-кишечном тракте
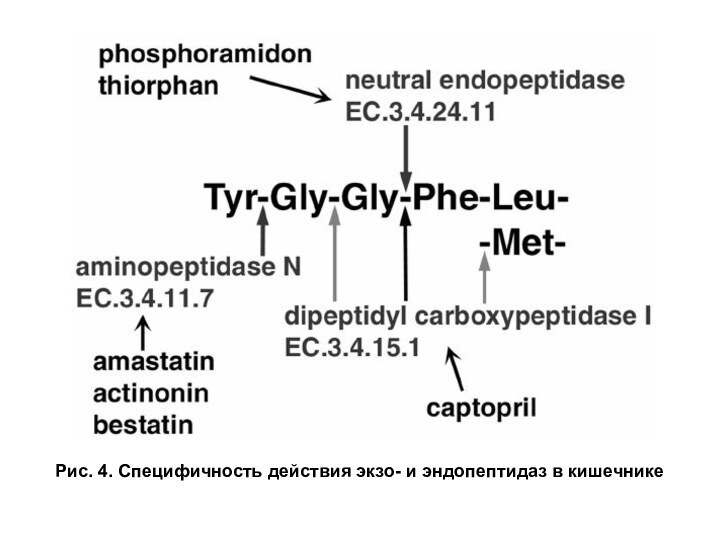
Слайд 12
Рис. 4. Специфичность действия экзо- и эндопептидаз в
кишечнике
Слайд 13
Рис. 4. Специфичность действия экзо- и эндопептидаз в
кишечнике
Слайд 14
Метаболизм аминокислот. Переваривание белков в кишечнике
Пищевая ценность белка зависит

от его аминокислотного состава и способности усваиваться организмом. В
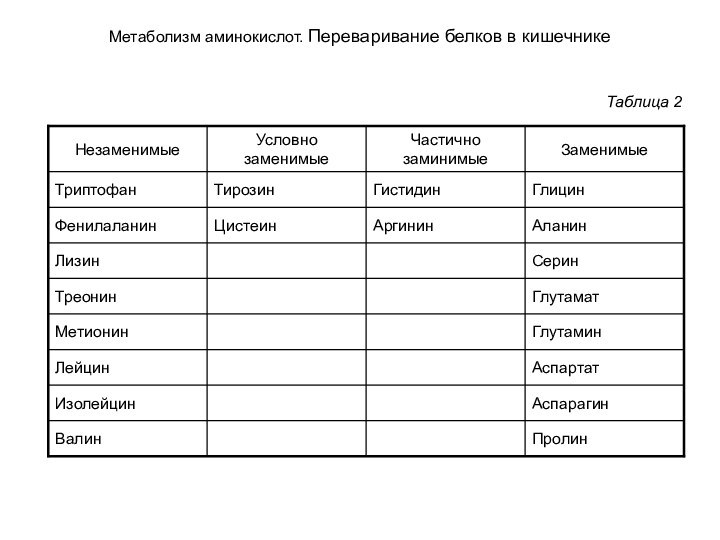
табл. 2 указаны незаменимые аминокислоты, присутствие которых в белках пищи обязательно, так как их синтез в организме невозможен; частично заменимые аминокислоты, которые в небольших количествах синтезируются в организме; условно заменимые аминокислоты, для образования которых необходимы незаменимые аминокислоты, и заменимые аминокислоты, потребность в которых может быть восполнена синтезом из других веществ. Присутствие в белках всех незаменимых аминокислот говорит о его полноценности. Чем выше содержание незаменимых аминокислот, тем больше пищевая ценность белка. Норма белков в питании составляет примерно 100 г в сутки.
Недостаток в течение длительного времени пищевых белков, богатых незаменимыми аминокислотами, приводит к заболеванию. Чтобы восполнить недостающие аминокислоты, ткани начинают гидролизовать свои собственные белки с помощью тканевых протеиназ. Белковая недостаточность проявляется у детей нарушением развития и функций организма.
Слайд 15
Метаболизм аминокислот. Переваривание белков в кишечнике
Таблица 2
Слайд 16
Метаболизм аминокислот. Переваривание белков в кишечнике
Транспорт аминокислот из
кишечника в кровяное русло осуществляется в два этапа.
Сначала аминокислоты, образовавшиеся
в результате гидролиза белков, проходят через мембрану щеточной каймы внутрь эпителиальной клетки с помощью переносчиков путем Na+-зависимого симпорта, подобно переносу глюкозы.
Далее специфические транслоказы по механизму облегченной диффузии переносят аминокислоты в кровь.
Слайд 17
Метаболизм аминокислот.
Распад тканевых белков
Белки тканей гидролизуются и в
норме в целях их обновления, но процессы гидролиза и
синтеза белков тканей в этом случае уравновешены. Основными причинами распада тканевых белков являются:
денатурация белков, которая происходит в организме непрерывно;
старение клеток или их повреждение внешними факторами (излучения, токсины);
частичный протеолиз, сопровождаемый отщеплением части пептидной цепи, которая гидролизуется до аминокислот;
гидролиз белков и ферментов, содержащихся в пищеварительных соках. Все эти белки (~ 100 г в сутки) перевариваются с образованием аминокислот;
разрушение белков (гормонов, ферментов), участвующих в регуляции — индукции и репрессии синтеза белков.
Слайд 18
Биосинтез аминокислот
Растения и многие виды бактерий содержат
ферментные системы, необходимые для синтеза всех требуемых α-кетокислот. Животные утратили
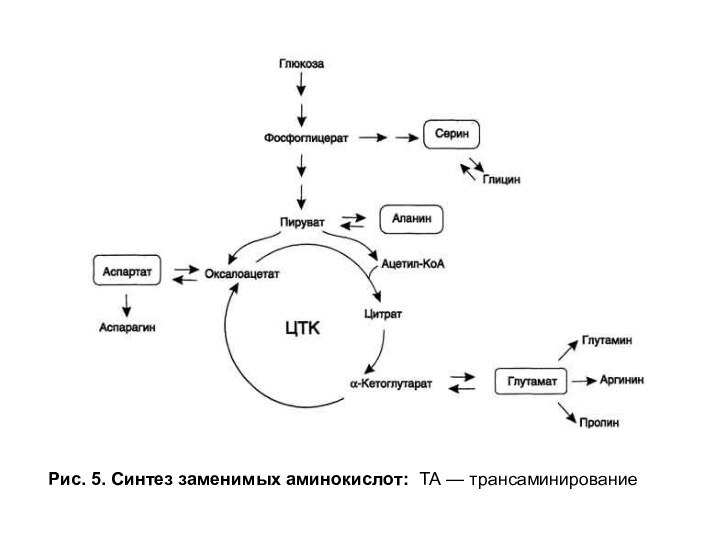
способность синтезировать некоторые α-кетокислоты. Эти кетокислоты соответствуют незаменимым аминокислотам. Некоторые α-кетокислоты (соответствующие заменимым аминокислотам) могут образовываться в результате метаболизма веществ других классов, в основном глюкозы (рис. 5).
Слайд 19
Рис. 5. Синтез заменимых аминокислот: ТА — трансаминирование
Слайд 20
Биосинтез аминокислот
Заключительной реакцией в синтезе аминокислот из α-кетокислот
является реакция трансаминирования, в ходе которой аминогруппа переносится от донорной
аминокислоты к акцепторной α-кетокислоте.В результате получается α-кетокислота из донорной аминокислоты и новая аминокислота. Реакцию катализируют ферменты аминотрансферазы (трансаминазы) с участием кофермента пиридоксальфосфата (производное витамина В6). Эта реакция легко обратима. Любые аминокислоты, которых в пище недостаточно, можно получить за счет имеющихся в избытке при наличии соответствующих кетокислот (рис. 5, 6). Исключением являются лизин и треонин, которые не участвуют в реакциях трансаминирования. Трансаминирование происходит практически во всех органах. Промежуточные продукты некоторых метаболических путей являются кетокислотами и могут включаться в трансаминирование (рис. 5).
Слайд 21
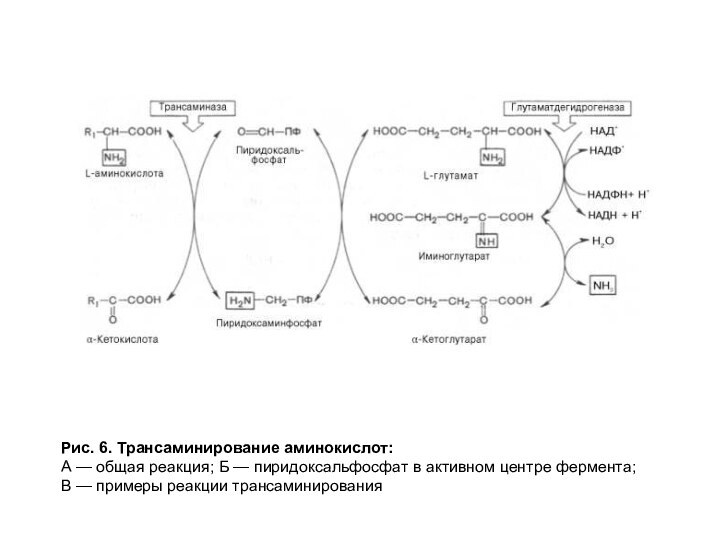
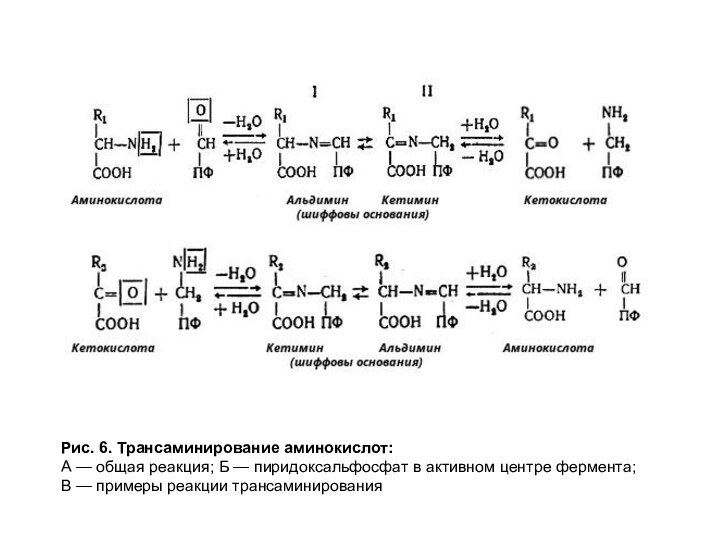
Рис. 6. Трансаминирование аминокислот:
А — общая реакция; Б
— пиридоксальфосфат в активном центре фермента;
В — примеры реакции
трансаминирования
Слайд 22
Рис. 6. Трансаминирование аминокислот:
А — общая реакция; Б
— пиридоксальфосфат в активном центре фермента;
В — примеры реакции
трансаминирования
Слайд 23
Биосинтез аминокислот
Многие аминотрансферазы предпочтительно используют α-кетоглутарат как

акцептор аминогруппы. При этом образуется глутамат. Пара α-кетоглутарат и
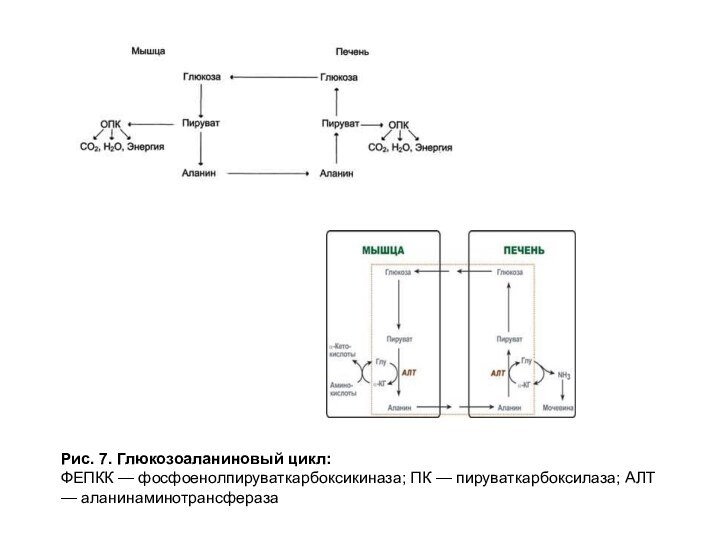
глутамат широко участвуют в метаболических превращениях аминокислот. Например, с помощью реакций трансаминирования осуществляется «переброска» аминного азота из мышц в печень. В работающей мышце происходит образование аланина из пировиноградной кислоты путем трансаминирования с глутаматом. Аланин поступает в кровь и затем поглощается печенью. В печени происходит обратная реакция, в результате которой образуется пируват, используемый в глюконеогенезе. Глюкоза может поступать в работающую мышцу. Создается глюкозоаланиновый цикл, который служит для переноса из мышц в печень пирувата и аминного азота (рис. 7).
Трансаминирование может быть использовано как для синтеза аминокислот (заключительная реакция), так и для катаболизма аминокислот. Замещение аминогруппы в аминокислоте на кетогруппу является первой стадией в катаболизме некоторых аминокислот.
Слайд 24
Рис. 7. Глюкозоаланиновый цикл:
ФЕПКК — фосфоенолпируваткарбоксикиназа; ПК — пируваткарбоксилаза;
АЛТ — аланинаминотрансфераза
Слайд 25
Катаболизм аминокислот
Катаболизм аминокислот включает два этапа:
дезаминирование, заключающееся
в отщеплении аминогруппы с образованием кетокислоты;
катаболизм кетокислот — безазотистых
остатков аминокислот. Катаболизм аминокислот в организме животных происходит в двух различных ситуация.
В нормальных условиях, когда в диете присутствует избыточное количество белка и после переваривания и всасывания избыточные аминокислоты дезаминируются, а углеродный скелет (кетокислота) или используется для конверсии в гликоген и жир, или окисляется для получения энергии. При голодании разрушаются белки тканей, и получающиеся после дезаминирования кетокислоты могут служить для синтеза глюкозы в процессе для глюконеогенеза, или для окисления, и извлечения энергии.
Слайд 26
Катаболизм аминокислот
Дезаминирование — это превращение аминокислот в соответствующие
α-кетокислоты в результате отщепления аминогруппы в виде аммиака. С
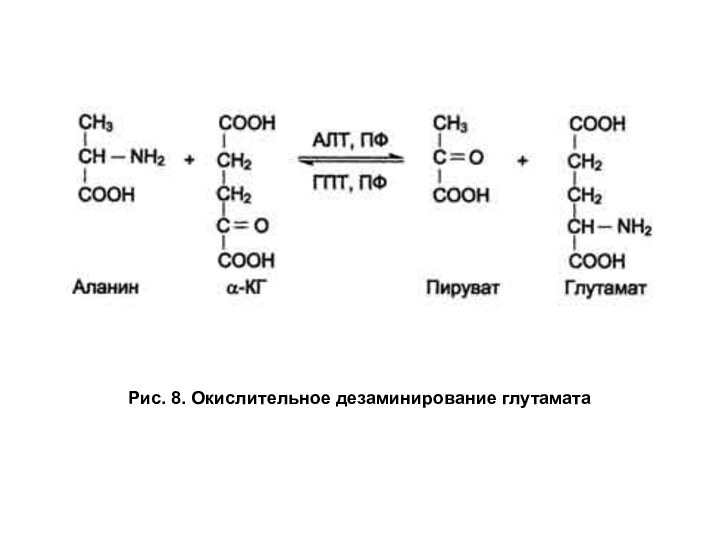
наибольшей скоростью дезаминируется глутаминовая кислота. Реакция сопровождается окислением, поэтому называется окислительным дезаминированием. Окислительное дезаминирование глутаминовой кислоты катализирует NAD-зависимая дегидрогеназа (рис. 8).
Слайд 27
Рис. 8. Окислительное дезаминирование глутамата
Слайд 28
Катаболизм аминокислот
Эта реакция обратима, но ее основная
роль заключается в дезаминировании, хотя в некоторых органах она
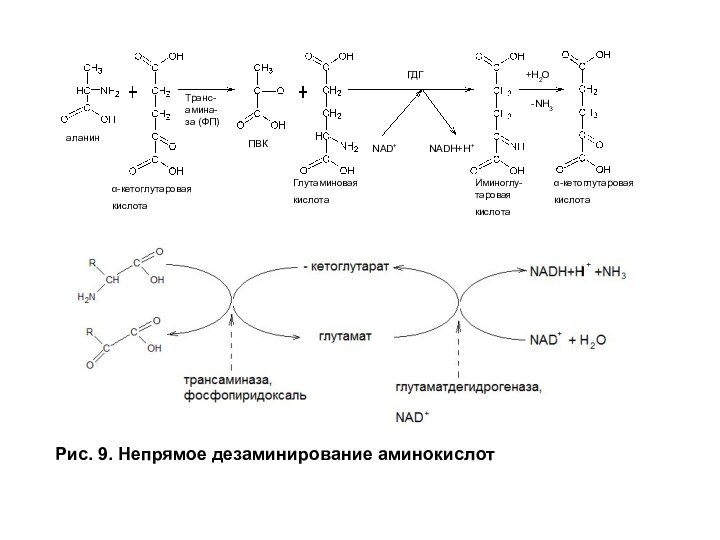
может протекать в сторону синтеза глутаминовой кислоты. В ходе дезаминирования глутамата аминогруппа сразу превращается в ион аммония, поэтому эта реакция называется прямым окислительным дезаминированием. Большинство аминокислот дезаминируются непрямым путем, включающим два этапа: 1) трансаминирование с α-кетоглутаратом с образованием глутамата; 2) окислительное дезаминирование глутамата (рис. 9).
Глутаматдегидрогеназа — ключевой фермент катаболизма аминокислот. Она аллостерически ингибируется АТФ, ГТФ NADH — показателями высокого энергетического статуса клетки. Высокие концентрации АДФ активируют глутаматдегидрогеназу, при участии которой аминокислоты превращаются в кетокислоты, поступающие в цитратный цикл как энергетические субстраты.
Слайд 29
Рис. 9. Непрямое дезаминирование аминокислот
аланин
α-кетоглутаровая
кислота
Транс-амина-за (ФП)
ПВК
Глутаминовая
кислота
α-кетоглутаровая
кислота
Иминоглу-таровая
кислота
ГДГ
NAD+
NADH+H+
+H2O
-NH3
Слайд 30
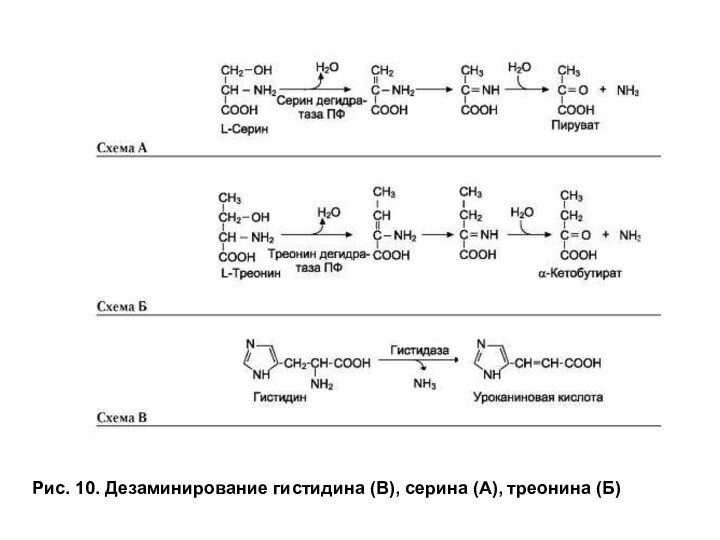
Катаболизм аминокислот
Дезаминирование гистидина, серина и треонина
Гистидин и
серин могут дезаминироваться непрямым путем, но для них существует
также другой путь, называемый неокислительным дезаминированием (рис. 10). Поскольку треонин не участвует в реакциях трансаминирования, то для него возможен только путь неокислительного дезаминирования.
Слайд 31
Рис. 10. Дезаминирование гистидина (В), серина (А), треонина
(Б)
Слайд 32
Катаболизм аминокислот. Дезаминирование гистидина, серина и треонина
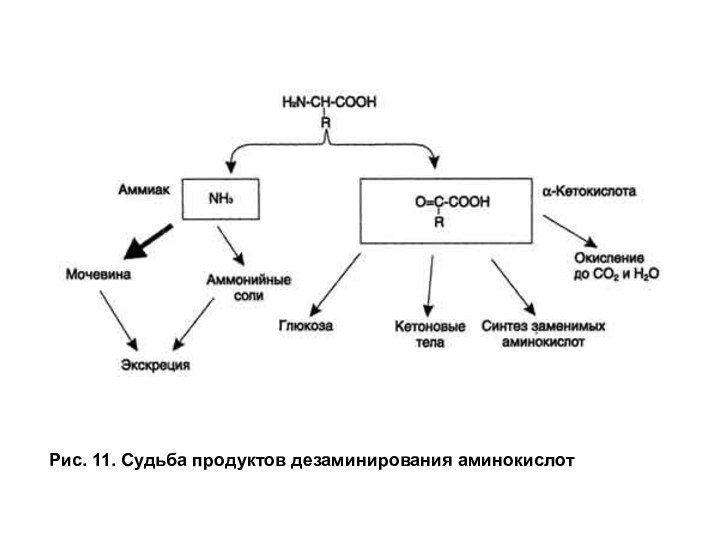
Катаболизм безазотистых

остатков, полученных в результате дезаминирования аминокислот, приводит к образованию либо ацетил-КоА или
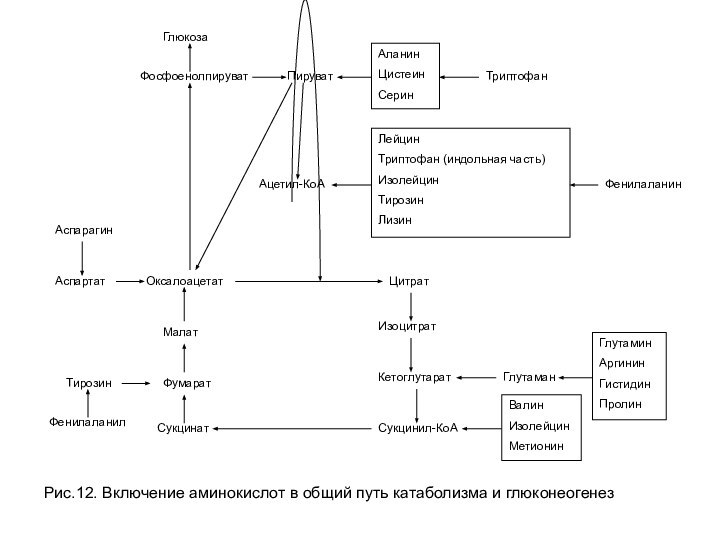
к образованию метаболитов, способных включаться в глюконеогенез. Все кетокислоты способны окисляться в цитратном цикле до СО2 и Н2О с выделением энергии (рис. 11). Безазотистые остатки большинства аминокислот при катаболизме проходят стадию образования оксалоацетата или пировиноградной кислоты, превращаясь в них непосредственно либо опосредованно через промежуточные продукты цитратного цикла. Такие аминокислоты называются гликогенными, так как пируват и оксалоацетат являются субстратами глюконеогенеза. Аминокислоты лейцин и лизин в ходе катаболизма превращаются не в пируват, а в ацетил-КоА и называются кетогенными, хотя в норме ацетил-КоА, образованный из аминокислот для синтеза кетоновых тел, не используется.
Тирозин, фенилаланин, изолейцин и триптофан являются одновременно и кетогенными и гликогенными, так как часть углеродного скелета этих аминокислот образует гликогенный продукт (опосредованно метаболитами цитратного цикла), а другая часть образует ацетил-КоА (рис. 12).
Слайд 33
Рис. 11. Судьба продуктов дезаминирования аминокислот
Слайд 34
Рис.12. Включение аминокислот в общий путь катаболизма и
глюконеогенез
Слайд 35
Обмен аммиака
В результате дезаминирования аминокислот в различных органах
освобождается большое количество аммиака. Аммиак также образуется при дезаминировании
биогенных аминов и нуклеотидов. Концентрация аммиака в жидкостях и тканях организма человека низкая (в крови 25÷40 мкмоль/л). При более высоких концентрациях аммиак токсичен. Низкая концентрация аммиака обеспечивается реакциями его связывания с образованием нетоксичных соединений.
Слайд 36
Обмен аммиака
Обезвреживание (связывание) аммиака
Аммиак может обезвреживаться несколькими способами:
1)
восстановительное аминирование α-кетоглутарата с образованием глутамата при участии глутаматдегидрогеназы (обратная реакция
окисления глутамата):
Эта реакция протекает в малом объеме и не имеет большого значения, для обезвреживания аммиака, хотя используется для образования глутаминовой кислоты;
Слайд 37
Обмен аммиака. Обезвреживание (связывание) аммиака
2) образование амида глутаминовой
кислоты — глутамина при участии глутаминсинтетазы:
Эта реакция протекает во многих тканях, но
наиболее важна для нервной ткани, особенно чувствительной к токсическому действию аммиака. Глутаминсинтетаза обладает высоким сродством к аммиаку. Благодаря этому свойству фермент обеспечивает поддержание концентрации аммиака на низком уровне — 25÷40 мколь/л (0,4÷0,7мг/л). Этот уровень содержания аммиака для организма нетоксичен.
Реакция образования глутамина происходит в митохондриях клеток. В реакции участвуют кофактор-ионы Mg2+. Глутаминсинтетаза — регуляторный фермент. Его аллостерическим ингибитором является АМФ. Глутамин также участвует в анаболических процессах, являясь донором азота в синтезе пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров;
Слайд 38
Обмен аммиака. Обезвреживание (связывание) аммиака
3) образование карбамоилфосфата путем
конденсации NH3, CO2 и АТФ, катализируемое карбомоилфосфатсинтетазой I (фермент действует в
митохондриях). Эта реакция происходит в печени и является начальной стадией синтеза мочевины — конечного продукта метаболизма азота:
Слайд 39
Обмен аммиака
Биосинтез мочевины (орнитиновый цикл)
Количество синтезируемой мочевины зависит
от количества белков в пищевом рационе. Если человек потребляет
~100 г белков, то в сутки синтезируется примерно 25÷30г мочевины. В этом количестве мочевины содержится 90% всего выводимого из организма азота.
Синтез мочевины — циклический процесс (рис. 13), состоит из пяти реакций, катализируемых пятью отдельными ферментами. Суммарное уравнение:
Слайд 40
Обмен аммиака. Биосинтез мочевины (орнитиновый цикл)
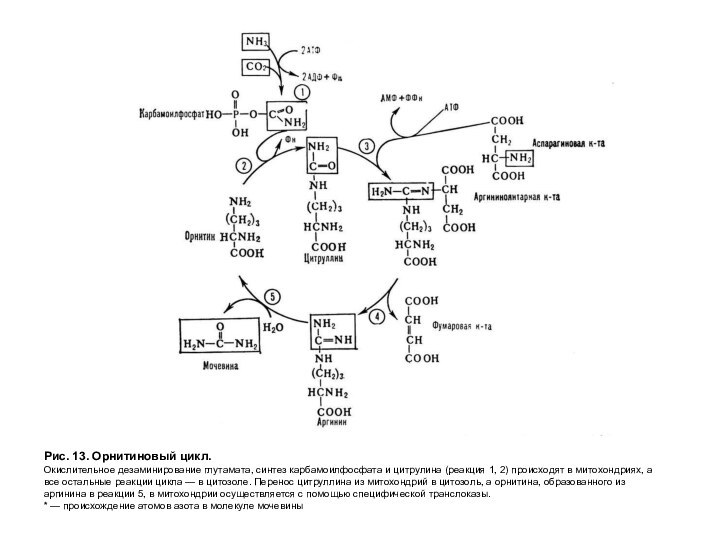
Из анализа процесса

синтеза мочевины (рис. 13) следует:
включение азота происходит в двух
реакциях. Один из атомов азота поступает в форме NH3 в реакции I и является продуктом дезаминирования аминокислот, а другой включается в составе аспартата (реакция 3). Этот второй азот может поступать в аспартат из любой аминокислоты путем трансаминирования с оксалоацетатом (реакция 7). Следовательно, атомы азота в мочевине имеют разное происхождение;
орнитиновый цикл связан с цитратным циклом, так как оксалоацетат, необходимый для трансаминирования, образуется из фумарата в реакциях цитратного цикла, протекающего в митохондриях клетки (реакция 6);
процесс эндергонический, требующий 3 моль АТФ для синтеза одной молекулы мочевины (реакции 1, 3). Затраты энергии в этом процессе могут быть компенсированы реакцией окислительного дезаминирования глутамата, протекание которой сопряжено с дыхательной цепью и синтезом АТФ. Синтез мочевины происходит в печени. Причем синтез карбамоил-фосфата и цитрулина протекает в митохондриях так же, как образование оксалоацетата из фумарата. Остальные реакции происходят в цитозоле клетки.
В норме орнитиновый цикл имеет запас мощности, так как он функционирует на 60%. Поэтому при колебаниях количества белков в диете процесс выведения аммиака в виде мочевины не нарушается.
Слайд 41
Рис. 13. Орнитиновый цикл.
Окислительное дезаминирование глутамата, синтез карбамоилфосфата
и цитрулина (реакция 1, 2) происходят в митохондриях, а
все остальные реакции цикла — в цитозоле. Перенос цитруллина из митохондрий в цитозоль, а орнитина, образованного из аргинина в реакции 5, в митохондрии осуществляется с помощью специфической транслоказы.
* — происхождение атомов азота в молекуле мочевины
Слайд 42
Обмен аммиака
Транспорт азота аминокислот из тканей в печень
Так
как синтез мочевины происходит только в печени, транспорт аминного
азота — продукта катаболизма аминокислот из разных тканей в печень — осуществляется в составе глутамина, аланина и аммиака.
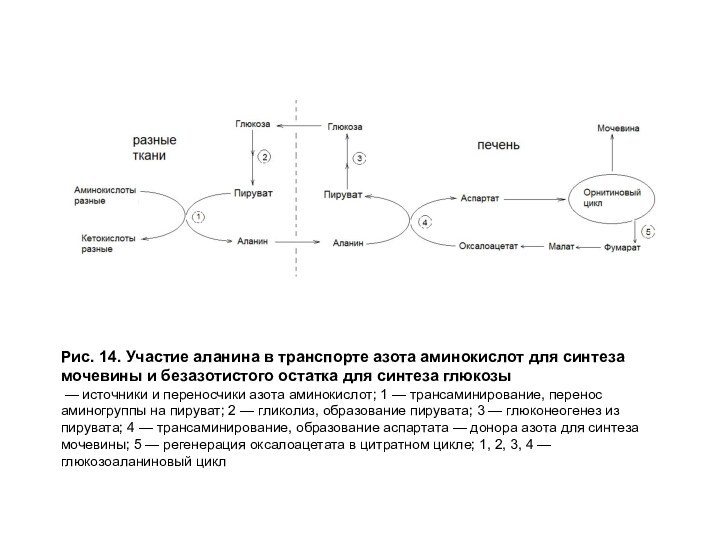
Аланин образуется при трансаминировании пирувата с разными аминокислотами (источником пирувата является глюкоза или безазотистые остатки аминокислот). В форме аланина в печень транспортируется аминный азот для синтеза мочевины и углеродный скелет для синтеза глюкозы, то есть осуществляется глюко-аланиновый цикл (рис. 7). Роль аланина представлена на рис. 14. Первоначальным источником азота может быть любая аминокислота.
Слайд 43
Рис. 14. Участие аланина в транспорте азота аминокислот
для синтеза мочевины и безазотистого остатка для синтеза глюкозы
—
источники и переносчики азота аминокислот; 1 — трансаминирование, перенос аминогруппы на пируват; 2 — гликолиз, образование пирувата; 3 — глюконеогенез из пирувата; 4 — трансаминирование, образование аспартата — донора азота для синтеза мочевины; 5 — регенерация оксалоацетата в цитратном цикле; 1, 2, 3, 4 — глюкозоаланиновый цикл
Слайд 44
Обмен аммиака. Транспорт азота аминокислот из тканей в

печень
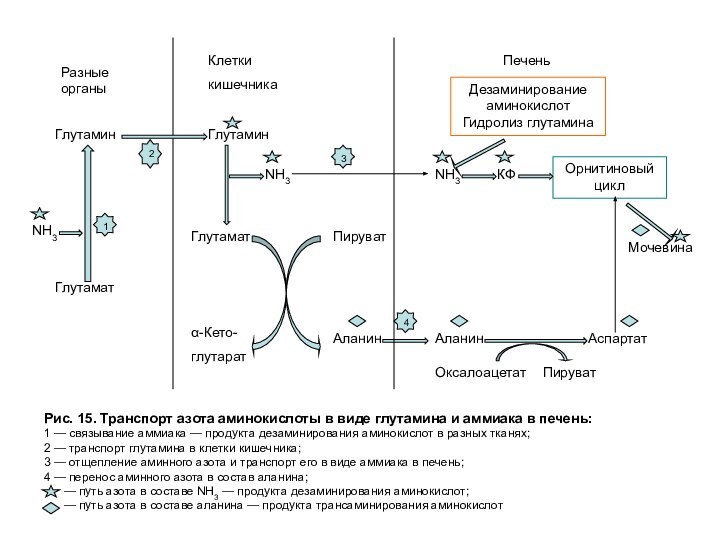
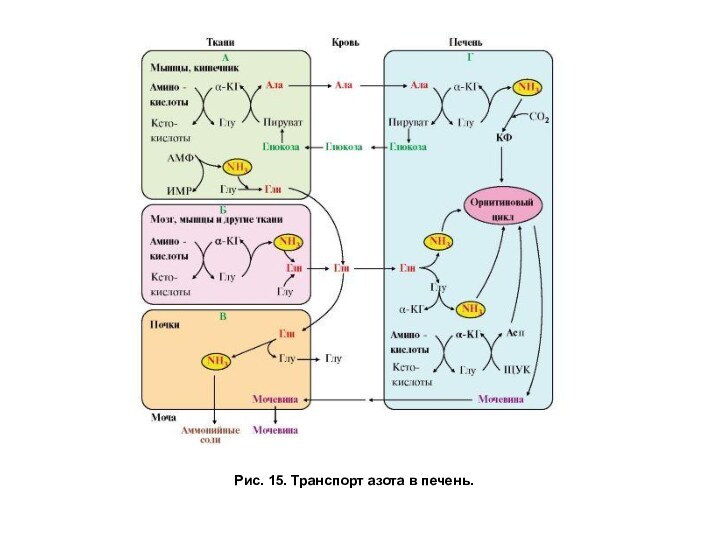
Глутамин не только связывает и обезвреживает аммиак, но также служит
его транспортной формой, так как легко проходит через мембраны и поступает из клеток в кровь, затем в основном в кишечник (рис. 15). В энтероцитах отщепляется амидная группа глутамина в виде аммиака, который с кровью воротной вены, оттекающей от кишечника, поступает в печень и там участвует в синтезе карбамоилфосфата. Аминная группа глутамата — продукта гидролиза глатамина, переносится на пируват, затем в составе аланина поступает в печень и, как показано выше, участвует в синтезе аспартата. α-кетоглутарат, образовавшийся из глутамата, окисляется и служит источником энергии для энтероцитов.
Аммиак. Часть аммиака для синтеза мочевины поступает в печень по воротной вене из кишечника. Кроме того, некоторое количество аммиака образуется в гепатоцитах в результате дезаминирования аминокислот или отщепления амидной группы глутамина при участии глутаминазы:
Слайд 46
Рис. 15. Транспорт азота в печень.
Слайд 47
Обмен аммиака
Роль аммиака в почках
В почках аммиак образуется
в результате гидролиза глутамина (реакцию катализирует глутаминаза) и дезаминирования
глутамата при участии глутаматдегидрогеназы. Выводится аммиак в виде ионов аммония в составе аммонийных солей. Ионы аммония образуются в результате взаимодействия с протонами:
Образование и экскреция ионов аммония почками обеспечивают выведение протонов. При ацидозе увеличивается потребление глутамина почками и происходит ускорение глутаминазной реакции, по-видимому, за счет индукции синтеза глутаминазы. Ускорение образования NH4 + служит для выведения кислот при ацидозе. Благодаря этому сберегаются ионы Na+, которые могли бы выводиться с анионами кислот.
Слайд 48
Обмен аммиака
Гипераммониемии
Это состояния, возникающие вследствие нарушений функционирования орнитинового

цикла — главного пути удаления азота из организма человека.
Причиной гипераммониемии могут быть как генетические дефекты ферментов орнитинового цикла, так и вторичные поражения функций печени. Следствием дефекта фермента является накопление субстрата данного фермента и его предшественников, оказывающих токсическое действие на организм. Например, недостаточность карбамоилфосфатсинтетазы I ведет к накоплению аммиака. Повышение концентрации аммиака может вызывать припадки с потерей сознания, судороги, возбуждение, неукротимую рвоту. Наследственная гипераммониемия сопровождается нарушением умственного развития.
Токсичность аммиака при повышении его концентрации возможно связана с тем, что:
в нервной ткани стимулируется синтез глутамина из глутамата. Накопление глутамина может привести к повышению осмотического давления и отеку мозга. Результатом снижения концентрации глутамата может быть нарушение синтеза γ-аминомасляной кислоты (ГАМК) — тормозного медиатора, вследствие чего могут возникать судороги;
ускоряется реакция восстановительного аминирования α-кетоглутарата, а следствием уменьшения концентрации α-кетоглутарата являются: 1) гипоэнергетическое состояние как результат снижения скорости цитратного цикла, метаболитом которого α-кетоглутарат является; 2) угнетение реакций трансаминирования и синтеза некоторых медиаторов;
сдвигается рН крови в щелочную сторону — алкалоз. В щелочной среде увеличивается сродство гемоглобина к кислороду. Следствием этого является гипоксия, которая, в свою очередь, приводит к гипоксии тканей, нарушению энергетического обмена, накоплению СО2;
увеличивается концентрация в крови ионов аммония, которые практически не проходят через мембраны клеток. Ионы аммония конкурируют с Na+ и К+ за ионные каналы, что влияет на трансмембранный перенос Na+ и К+ и проведение нервных импульсов.
Для диагностики гипераммониемий используется определение: концентрации аммиака в крови; метаболитов орнитинового цикла в крови и в моче, а также активности ферментов этого цикла в биоптатах печени.
Для лечения используются препараты, связывающие аммиак, и назначение малобелковой диеты.
Слайд 49
Трансметилирование и метаболизм одноуглеродных фрагментов
В клетках осуществляются
превращения, включающие перенос одноуглеродных групп, таких, как –СН3, –СНОН, –СНО,
–СН2— и т.д. Реакция, в которой переносится метильная группа (-СН3), называется реакцией метилирования, и она протекает с участием метионина. Метионин — это незаменимая аминокислота.
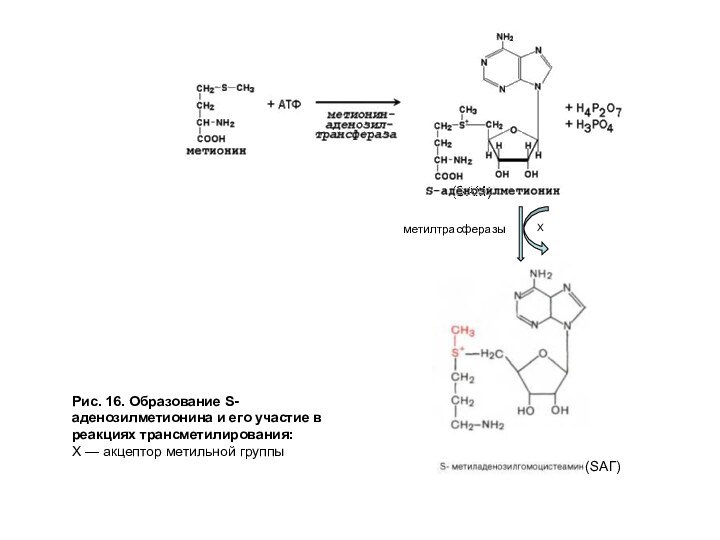
Донором метильной группы служит S-аденозилметионин (SAM).
Это соединение является активной формой метионина в реакциях метилирования (рис. 16).
Реакции метилирования катализируют метилтрансферазы. Они используются для:
синтеза ряда веществ (адреналина, ацетилхолина, карнитина, креатина, фосфатидилхолина и т.д.);
инактивации метаболитов (гормонов, биогенных аминов), ксенобиотиков, в том числе лекарств;
метилирования азотистых оснований.
Слайд 50
Рис. 16. Образование S-аденозилметионина и его участие в реакциях
трансметилирования:
Х — акцептор метильной группы
(SAM)
Слайд 51
Трансметилирование и метаболизм одноуглеродных фрагментов
В ходе реакции
метилирования SAM превращается в S-аденозилгомоцистеин (SAG). Гомоцистеин может вновь превращаться
в метионин, то есть метионин может регенерировать, но для этого нужен донор и переносчик метильной группы.
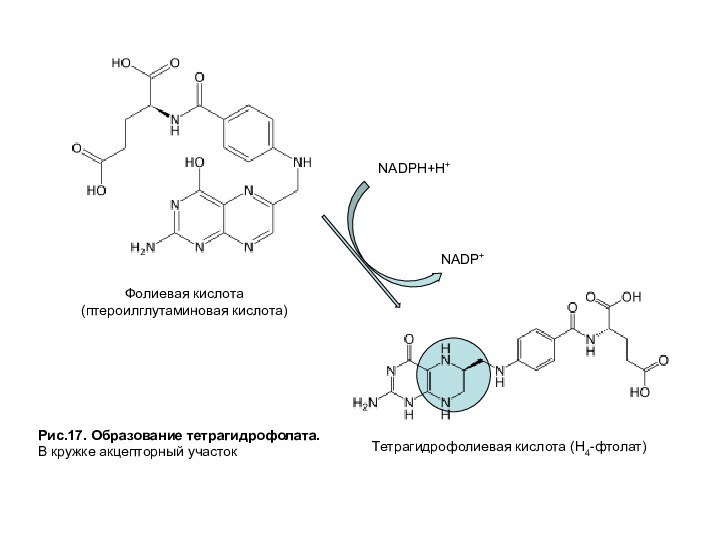
Все ферменты, катализирующие перенос одноуглеродных групп, нуждаются в коферменте, роль которого выполняет тетрагидрофолат (ТГФК или Н4-фолат), образующийся из фолиевой кислоты — витамина В9 (рис. 17).
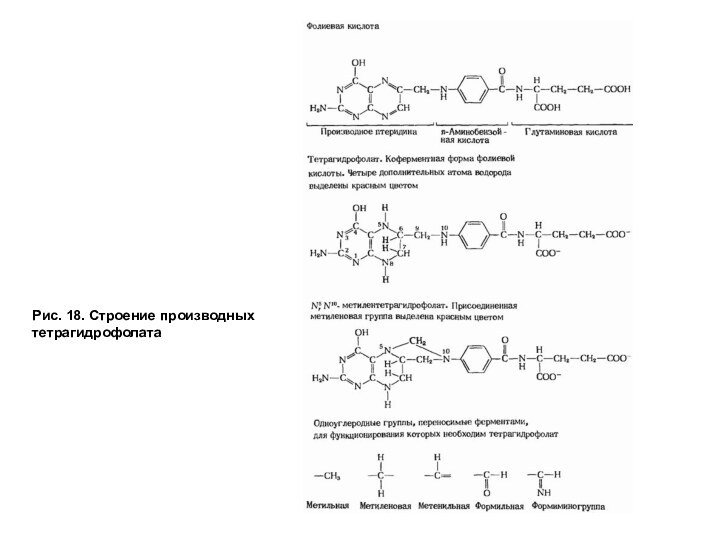
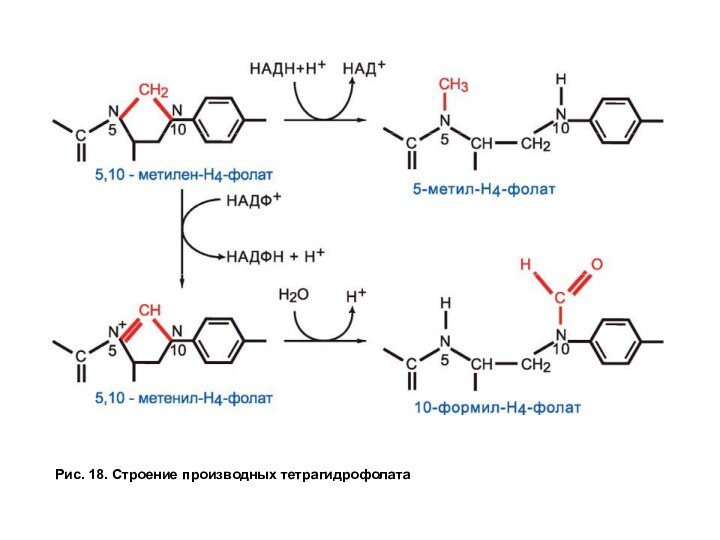
Тетрагидрофолат способен связывать одноуглеродные группы с атомами азота в положении № 5 и 10, образуя разные формы в зависимости от степени окисленности одноуглеродных производных (рис. 18).
Слайд 52
Рис.17. Образование тетрагидрофолата.
В кружке акцепторный участок
Слайд 53
Рис. 18. Строение производных тетрагидрофолата
Слайд 54
Трансметилирование и метаболизм одноуглеродных фрагментов
Донорами одноуглеродных фрагментов

могут быть серин и глицин. Серин — заменимая кислота. Углеродная
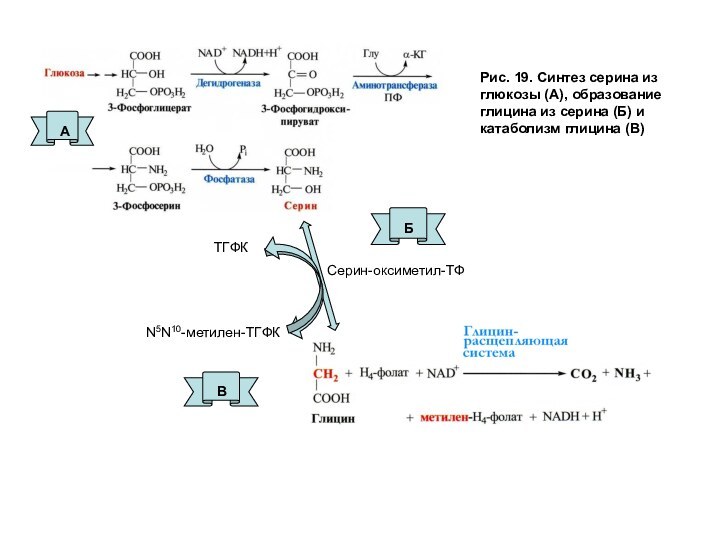
часть серина образуется из глюкозы (рис. 19А), а аминогруппа поступает с помощью реакции трансаминирования из другой аминокислоты. Глицин может синтезироваться из серина в реакции, катализируемые серин-оксиметилтрансферазой, которая переносит оксиметильную группу с серина на кофермент-Н4-фолата (рис. 19Б). Катаболизм глицина происходит также с участием Н4-фолат (рис. 19В).
Дальнейшие метаболические превращения преобразуют группу –СН2- в другие одноуглеродные производные и определяют пути их использования. Метильная группа необходима для превращения гомоцистеина в метионин, а метиленовые, метенильные и формильные группы участвуют в биосинтезе всех пуриновых и одного из пиримидиновых (дТМФ) нуклеотидов.
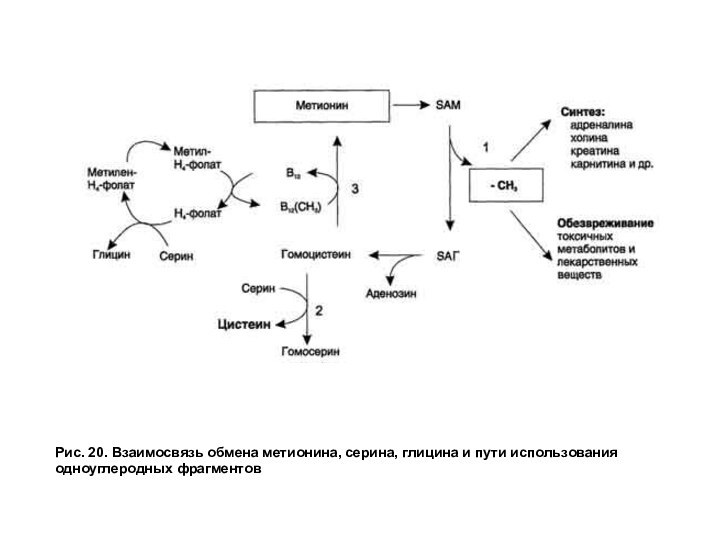
На рис. 20 представлен путь одноуглеродных групп от глюкозы — первичного источника углерода — и от серина, который образуется из углеродных атомов глюкозы до использования этих групп различными акцепторами.
Участие ТГФК в синтезе тимидиловых и пуриновых нуклеотидов объясняет применение сульфаниламидных препаратов как антибактериостатических средств. Эти препараты подавляют в клетках микроорганизмов образование фолиевой кислоты, которая не является для прокариотов витамином и может ими синтезироваться. Сульфаниламиды — это структурные аналоги n-аминобензоата (компонента фолиевой кислоты), поэтому действуют как конкурентные ингибиторы синтеза фолата и тем самым препятствуют росту клеток микроорганизмов.
Слайд 55
Рис. 18. Строение производных тетрагидрофолата
Слайд 56
Рис. 19. Синтез серина из глюкозы (А), образование
глицина из серина (Б) и катаболизм глицина (В)
Слайд 57
Рис. 20. Взаимосвязь обмена метионина, серина, глицина и
пути использования одноуглеродных фрагментов
Слайд 58
Трансметилирование и метаболизм одноуглеродных фрагментов
Недостаточность фолиевой кислоты
Проявлением

дефицита фолиевой кислоты является мегалобластная (макроцитарная) анемия, которая характеризуется снижением
в крови концентрации гемоглобина, количества эритроцитов, увеличением их размера. Причиной является нарушение синтеза нуклеиновых кислот (прежде всего ДНК) в клетках кроветворной ткани. Клетки этой ткани относятся к быстроделящимся и поэтому дефицит фолиевой кислоты, приводящий к дефициту Н4-фолата, прежде всего отражается на эритропоэзе. Нарушается участие производных Н4-фолатав синтезе тимидиловой кислоты других пуриновых нуклеотидов, а следовательно, снижается скорость образования ДНК и РНК в кроветворных клетках. Недостаточность фолиевой кислоты чаще всего сопровождается дефицитом витамина В12. Снижение синтеза коферментов — производных витаминов В9 и В12 объясняется несколькими причинами:
неправильным питанием, когда в пище мало зеленых овощей и мясныхпродуктов. В этом случае одновременно с дефицитом Н4-фолата возникает дефицит метионина и холина, что усугубляет нарушения в обмене одноуглеродных групп;
нарушением всасывания при энтеритах или других заболеваниях кишечника, приводящих к гиповитаминозу;
заболеваниями печени. При гепатите или циррозе печени может снижаться активность фолатредуктазы, которая катализирует превращение фолата в Н4-фолат.
Слайд 59
Обмен фенилаланина и тирозина
Фенилаланин — незаменимая аминокислота и

поступает в организм в составе пищи. Фенилаланин в основном
используется для синтеза тканевых белков и тирозина — условно заменимой аминокислоты. Тирозин также включается в синтез белков и участвует в синтезе других соединений (катехоламинов, тироксина, меланинов). Кроме того, тирозин, а значит, и фенилаланин посредством тирозина могут включаться в катаболизм, окисляясь до СО2 и Н2О.
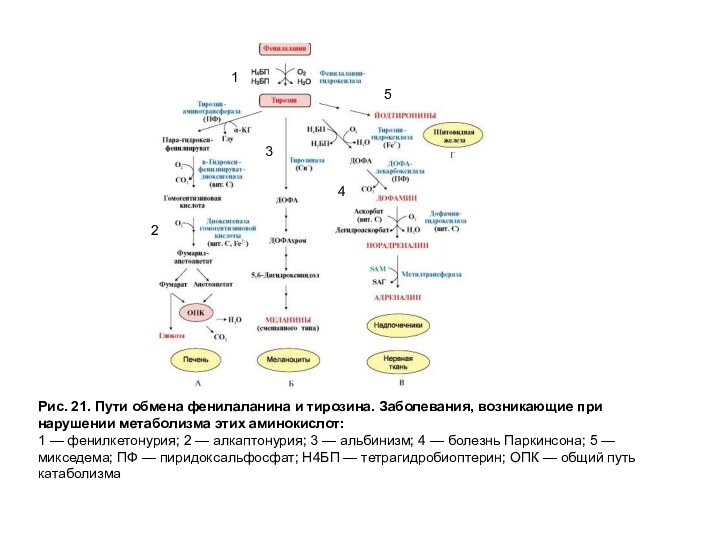
Пути обмена фенилаланина и тирозина представлены на рис. 21. Изучение обмена фенилаланина и тирозина показало, что нарушение превращений этих аминокислот ведет к ряду заболеваний.
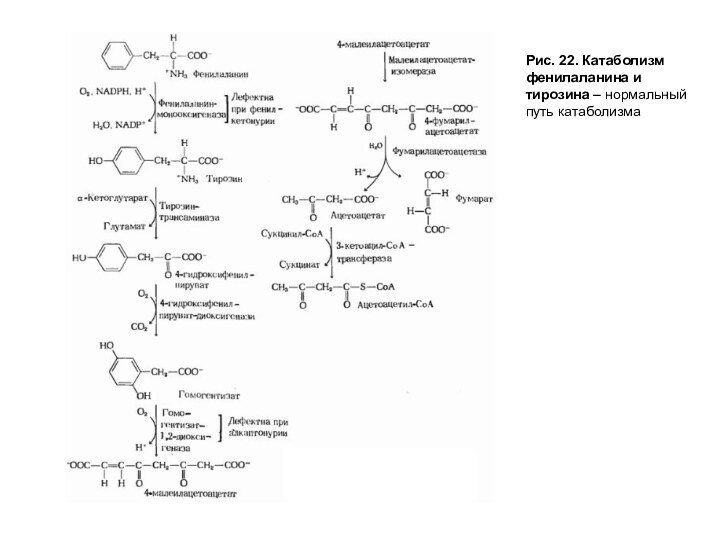
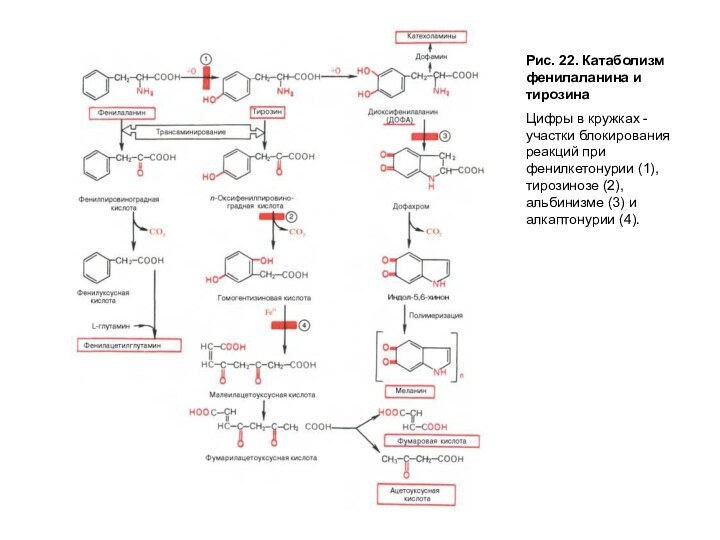
Катаболизм фенилаланина и тирозина
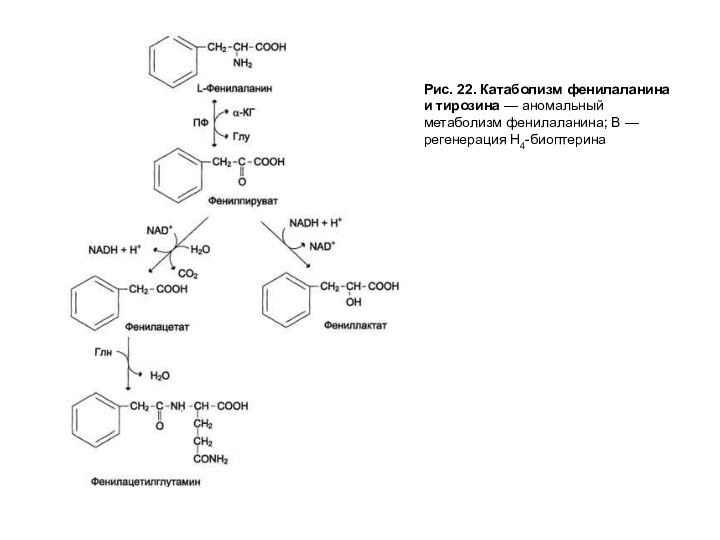
Весь фенилаланин, не использованный в синтезе тканевых белков, в норме превращается в тирозин (рис. 22). Эта реакция катализируется фенилаланингидроксилазой, коферментом которой служит тетрагидробиоптерин (Н4БП). Известно сравнительно часто встречающееся заболевание, причиной которого является генетический дефект фенилаланингидроксилазы или реже дефицит редуктазы тетрагидробиоптерина — фермента, обеспечивающего восстановление Н2БП в Н4БП. Накапливающийся при этом фенилаланин подвергается дезаминированию и образует метаболит — фенилпируват, который в норме образуется в очень малых количествах. При заболевании фенилпируват превращается в фениллактат и фенилацетат — токсичные продукты, которые выводятся с мочой. Этот дефект метаболизма фенилаланина проявляется как заболевание фенилкетонурия-ФКУ. Заболевание проявляется рано и сопровождается резким нарушением умственного и физического развития ребенка вследствие токсического влияния высоких концентраций фенилаланина и фенилкетоновых тел.
Слайд 60
Рис. 21. Пути обмена фенилаланина и тирозина. Заболевания,
возникающие при нарушении метаболизма этих аминокислот:
1 — фенилкетонурия; 2
— алкаптонурия; 3 — альбинизм; 4 — болезнь Паркинсона; 5 — микседема; ПФ — пиридоксальфосфат; Н4БП — тетрагидробиоптерин; ОПК — общий путь катаболизма
5
4
3
2
1
Слайд 61
Рис. 22. Катаболизм фенилаланина и тирозина – нормальный
путь катаболизма
Слайд 62
Рис. 22. Катаболизм фенилаланина и тирозина
Цифры в кружках
- участки блокирования реакций при фенилкетонурии (1), тирозинозе (2),
альбинизме (3) и алкаптонурии (4).
Слайд 63
Рис. 22. Катаболизм фенилаланина и тирозина — аномальный
метаболизм фенилаланина; В — регенерация Н4-биоптерина
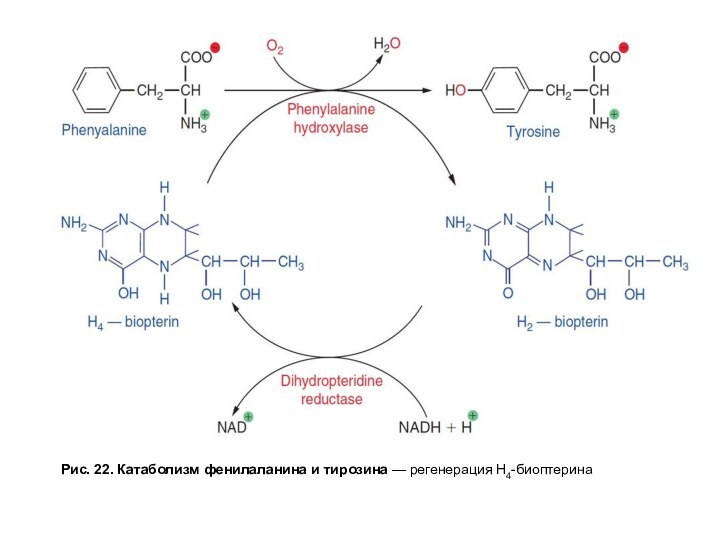
Слайд 64
Рис. 22. Катаболизм фенилаланина и тирозина — регенерация Н4-биоптерина
Слайд 65
Обмен фенилаланина и тирозина. Катаболизм фенилаланина и тирозина

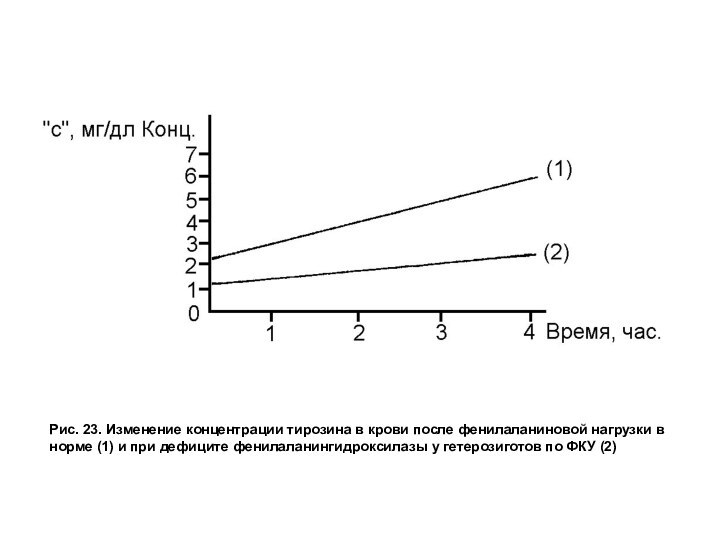
Для диагностики этого заболевания используют тест на толерантность к
фенилаланину. Для этого исследуют концентрацию тирозина в крови через часовые интервалы после дачи натощак обследуемому ~10 г фенилаланина (рис. 23).
Для лечения детей с ФКУ назначают диету, бедную фенилаланином, но содержащую достаточное количество тирозина. Это позволяет уменьшить токсическое действие фенилаланина и его производных.
Известно еще одно генетическое отклонение — алкаптонурия, причиной которого является нарушение пути катаболизма фенилаланина и тирозина на стадии превращения гомогентизиновой кислоты в фумарилацетоацетат, катализируемый диоксигеназой гомогентизиновой кислоты (рис. 22). Вследствие дефекта этого фермента накапливается гомогентизиновая кислота, которая выводится с мочой, но, окисляясь кислородом воздуха, образует черный пигмент и придает моче черный цвет. Проявлениями алкаптонурии являются также пигментация соединительной ткани, называемая охронозом, и артриты.
Слайд 66
Рис. 23. Изменение концентрации тирозина в крови после
фенилаланиновой нагрузки в норме (1) и при дефиците фенилаланингидроксилазы
у гетерозиготов по ФКУ (2)
Слайд 67
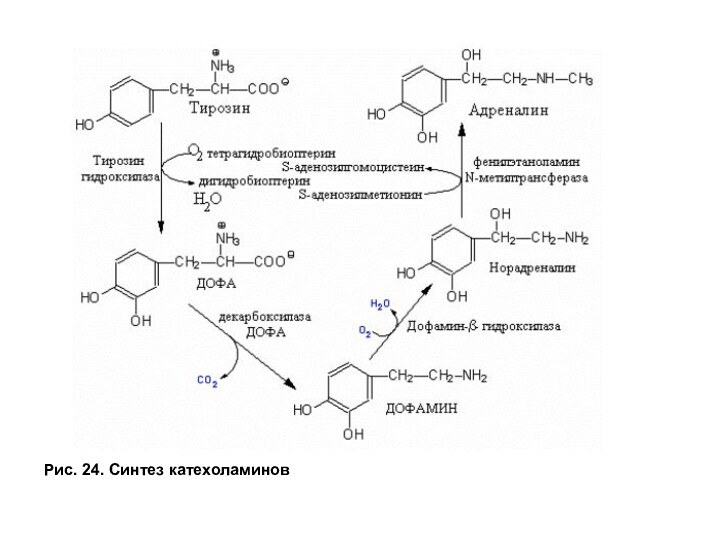
Обмен фенилаланина и тирозина.
Синтез катехоламинов
Тирозин является предшественником для синтеза

катехоламинов —дофамина и норадреналина в нервной ткани и адреналина в мозговом
веществе надпочечников (рис. 24). Дофамин и норадреналин выполняют функции медиаторов в синаптической передаче нервного импульса, а адреналин является гормоном.
Нарушение синтеза дофамина в черной субстанции мозга проявляется как болезнь Паркинсона. При этой патологии снижена активность ДОФА декарбоксилазы. Заболевание сопровождается скованностью движений (акинезия), напряжением мышц (ригидность) и непроизвольным дрожанием конечностей (тремор). Заместительная терапия не имеет эффекта, так как дофамин не проходит гематоэнцефалический барьер. Поэтому используют в качестве лекарств предшественник дофамина — производные ДОФА. Существуют препараты, подавляющие инактивацию дофамина и тем самым способствующие его накоплению в клетках. Так как инактивация катехоламинов происходит путем их окисления под действием моноаминооксидазы (МАО) (рис. 26В), следовательно, используемые препараты действуют как ингибиторы этого фермента.
Слайд 69
Обмен фенилаланина и тирозина.
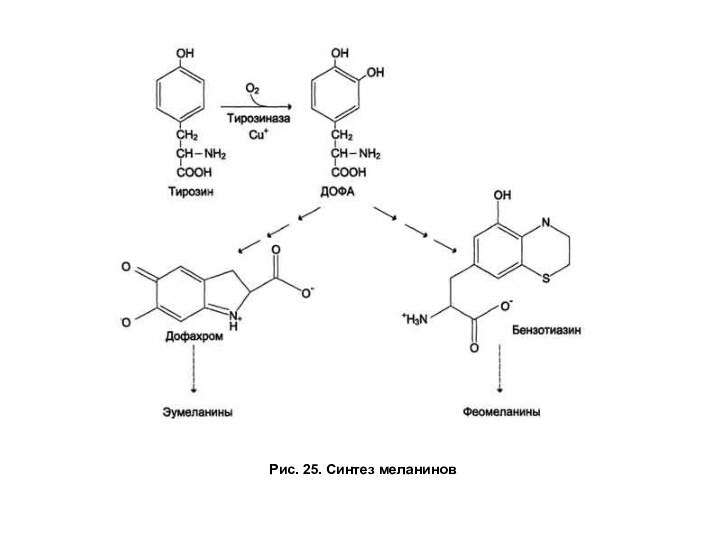
Синтез меланинов
Синтез пигментов меланинов происходит
в меланоцитах и предшественником меланинов является тирозин (рис. 25).
Тирозин при участии тирозиназы окисляется в ДОФА, из которого в результате разветвленного процесса образуются черно-коричневые пигменты (эумеланины) икрасно-коричневые или желтые пигменты (феомеланины). В разных сочетаниях эти типы меланинов содержатся в составе волос, кожи, сетчатке глаза, обуславливая их окраску.
Генетический дефект тирозиназы в меланоцитах или отсутствие меланоцитов проявляется как заболевание — альбинизм. Клинически эта патология проявляется отсутствием пигментации кожи и волос, светобоязнью, снижением остроты зрения.
Слайд 71
Декарбоксилирование аминокислот
иметаболизм биогенных аминов
Врезультате отщепления α-карбоксильной группы аминокислот образуются
амины (рис. 26А). Реакцию катализируют декарбоксилазы, коферментом которых является
фосфопиридоксаль. Продукты декарбоксилирования обладают высокой биологической активностью и с этим связано их название — биогенные амины.
Гистамин образуется из гистидина в тучных клетках. Выделяется в ответ на присутствие аллергена. Является сильным сосудорасширяющим фактором, вызывает сокращение гладкой мускулатуры, в клетках слизистой желудка стимулирует секрецию соляной кислоты.
γ-аминомасляная кислота (ГАМК) образуется из глутамата в ткани головного мозга, выполняет функции тормозного нейромедиатора.
Серотонин образуется из триптофана в нейронах гипоталамуса. Функционирует как нейромедиатор и тканевой гормон.
Слайд 72
Декарбоксилирование аминокислот иметаболизм биогенных аминов
Дофамин образуется из тирозина в

почках, надпочечниках, синаптических ганглиях, нервах. Является медиатором ингибирующего типа,
функционирует в черной субстанции верхнего отдела ствола мозга. В других клетках является предшественником норадреналина и адреналина.
Норадреналин образуется в результате гидроксилирования дофамина в клетках нервной ткани, мозговом веществе надпочечников. Функционирует как медиатор в синаптической передаче нервных импульсов.
Адреналин — продукт метилирования норадреналина в клетках мозгового вещества надпочечников. Выполняет функции гормона.
Инактивация биогенных аминов происходит двумя способами:
дезаминированием и окислением;
метилированием.
Реакцию дезаминирования и окисления (рис. 26В) катализирует FAD-зависимая моноаминооксидаза (МАО). Моноаминооксидаза может быть точкой воздействия некоторых лекарств, ингибирующих или активирующих этот фермент, так как изменение концентрации биогенных аминов является причиной ряда патологических состояний. Например, при паркинсонизме наблюдается уменьшение количества дофамина, и одним из способов лечения является снижение скорости инактивации дофамина под влиянием веществ — ингибиторов МАО.
Инактивация биогенных аминов путем их метилирования протекает с участием метилтрансфераз и SAM как донора метильной группы (рис. 26Г).
Слайд 73
Рис. 26. Синтез и обезвреживание биогенных аминов:
А —
реакция декарбоксилирования аминокислот;
Б — строение некоторых биогенных аминов; В
— инактивация биогенных аминов с участием МАО; Г — примеры инактивации
Слайд 74
Обмен нуклеотидов
Нуклеотиды и их производные используются в
организме в качестве:
субстратов синтеза ДНК, РНК и нуклеотидных коферментов;
источников
энергии;
участников синтеза гомо- и гетерополисахаридов, липидов и белков, а также универсальной системы детоксикации, обеспечивающей выведение чужеродных веществ и некоторых собственных метаболитов из организма;
вторичных вестников сигнала гормонов, факторов роста, нейромедиаторов и других регуляторных молекул в клетки.
В организме почти все клетки способны к синтезу нуклеотидов. Продукты расщепления нуклеиновых кислот тканей и пищи используются повторно лишь в незначительной степени.
Слайд 75
Обмен нуклеотидов
Центральное место в синтезе пуриновых и

пиримидиновых нуклеотидов занимает фосфорибозилдифосфат (ФРДФ) или фосфорибозилпирофосфат, который образуется
из рибозо-5-фосфата и АТФ в реакции, катализируемой ФРДФ-синтетазой:
Источниками рибозо-5-фосфата для этой реакции могут быть пентозофосфатный путь превращения глюкозы или пентозы, образующиеся в тканях при распаде нуклеиновых кислот и нуклеотидов.
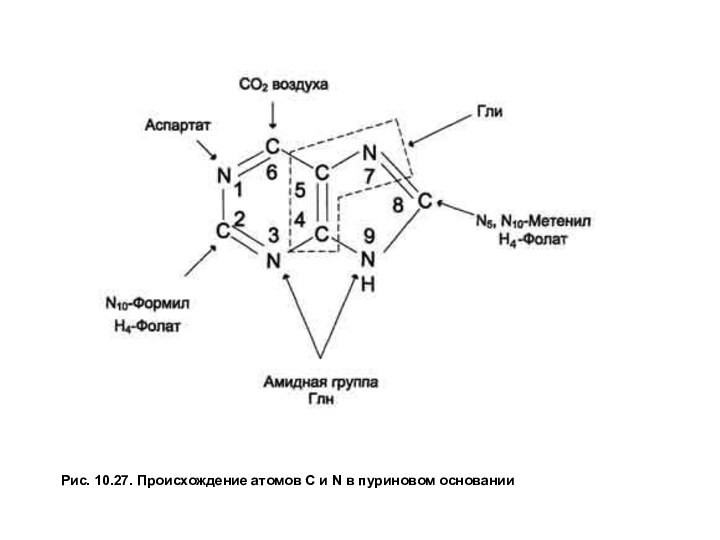
Биосинтез пуриновых нуклеотидов. Образование пуринового гетероциклического основания идет на остатке рибозо-5-фосфата при участии простых предшественников: глицина, СО2 , амидного азота глутамина, α-NH2 — группы аспартата и одноуглеродных производных Н4-фолата (рис. 27). Сначала формируется 5-членное кольцо, а затем 6-членное с образованием первого пуринового нуклеотида — инозинмонофосфата или ИМФ. Все четыре атома азота пурина поступают из аминокислот: два из Глн, один из Асп и 1 из Гли. Два из пяти углеродных атомов принадлежат Гли, два других — производным Н4- фолата и последний СО2 .
Слайд 76
Рис. 10.27. Происхождение атомов С и N в
пуриновом основании
Слайд 77
Обмен нуклеотидов
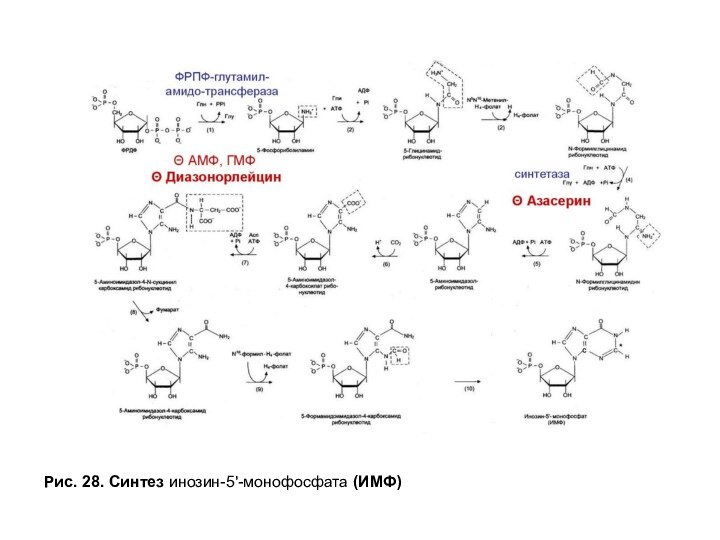
Скорость-лимитирующей и регуляторной стадией процесса является
образование 5-фосфорибозил-1-амина, которую катализирует амидофосфорибозилтрансфераза (рис. 28). В ходе этой
реакции амидная группа Глн замещает пирофосфатный остаток ФРДФ. Образуется N-C-связь, которая затем в нуклеотиде станет N-гликозидной связью между пурином и пентозой.
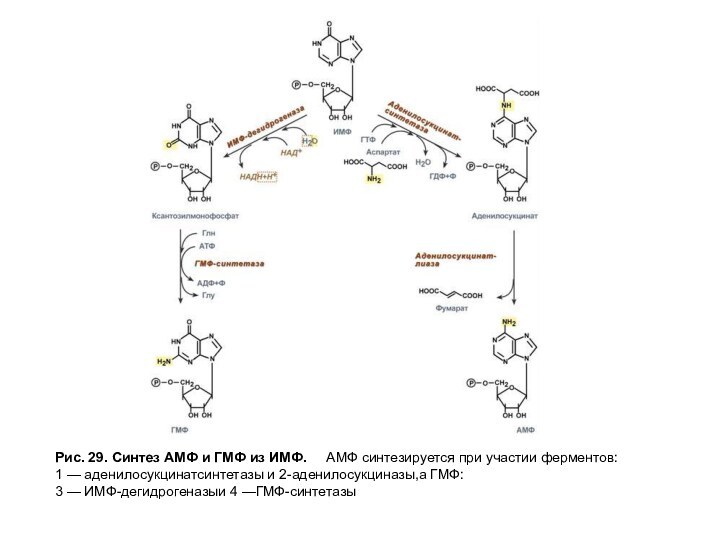
Синтез первого пуринового нуклеотида — ИМФ включает 10 стадий и идет с затратой 6 молей АТФ. Все реакции протекают в цитозоле клетки. АМФ и ГМФ образуются из ИМФ в каждом случае в ходе двух последовательных реакций (рис. 29).
Слайд 78
Рис. 28. Синтез инозин-5'-монофосфата (ИМФ)
Слайд 79
Рис. 29. Синтез АМФ и ГМФ из ИМФ. АМФ
синтезируется при участии ферментов:
1 — аденилосукцинатсинтетазы и 2-аденилосукциназы,а ГМФ:
3 — ИМФ-дегидрогеназыи
4 —ГМФ-синтетазы
Слайд 80
Обмен нуклеотидов
Нуклеозидди- и трифосфаты синтезуются при участии
АТФ и ферментов: нуклеозидмонофосфаткиназ (НМФ-киназ) и нуклеозиддифосфаткиназ (НДФ-киназ). АДФ и
ГДФ образуются в реакциях, катализируемых аденилаткиназой и гуанилаткиназой соответственно:
а НДФ-киназа осуществляет синтез НТФ, в частности превращает ГДФ в ГТФ:
Образование АТФ из АДФ в основном происходит за счет окислительного фосфорилирования или частично в реакциях субстратного фосфорилирования, которые встречаются в гликолизе, цитратном цикле или при использовании креатинфосфата в мышцах.
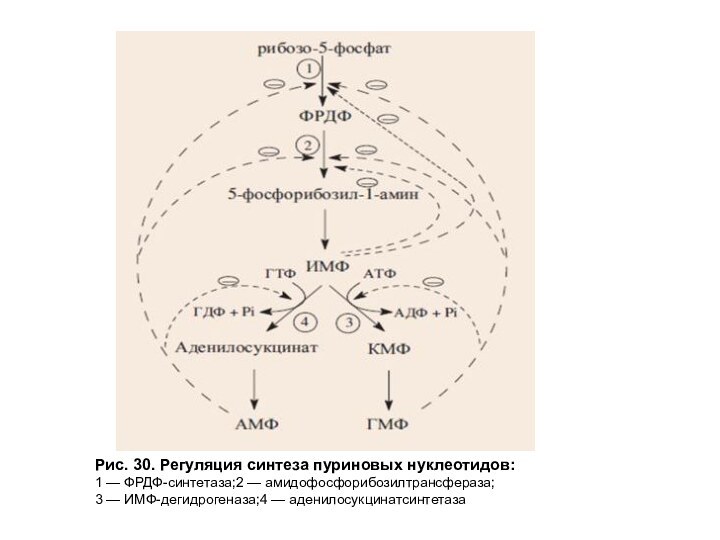
Регуляция синтеза пуриновых нуклеотидов осуществляется аллостерически по механизму отрицательной обратной связи (рис. 30).
Слайд 81
Рис. 30. Регуляция синтеза пуриновых нуклеотидов:
1 — ФРДФ-синтетаза;2 —
амидофосфорибозилтрансфераза;
3 — ИМФ-дегидрогеназа;4 — аденилосукцинатсинтетаза
Слайд 82
Обмен нуклеотидов
АМФ, ГМФ и ИМФ ингибируют ключевые
реакции своего синтеза. Два фермента: ФРДФ-синтетаза и амидофосфорибозилтрансфераза ингибируются лишь
при одновременном повышении концентрации АМФ и ГМФ, тогда как активность аденилосукцинатсинтетазы и ИМФ-дегидрогеназы снижается лишь при увеличении количества конечного продукта, образующегося в каждой из ветвей метаболического пути. АМФ ингибирует превращение ИМФ в аденилосукцинат, а ГМФ — превращение ИМФ в ксантозин-5'-монофосфат (КМФ), обеспечивая таким образом сбалансированное содержание адениловых и гуаниловых нуклеотидов.
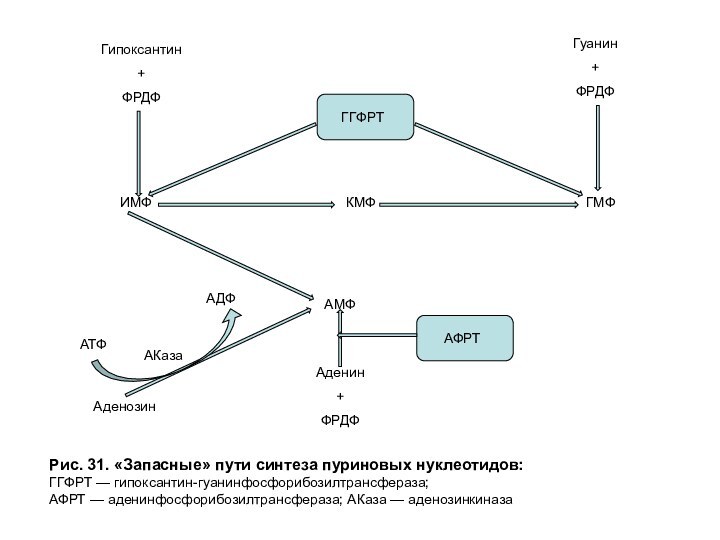
«Запасные» пути синтеза пуриновых нуклеотидов играют заметную роль в периоды активного роста тканей, когда основной путь синтеза из простых предшественников не способен полностью обеспечить нуклеиновые кислоты субстратами (рис. 31).
Слайд 83
Рис. 31. «Запасные» пути синтеза пуриновых нуклеотидов:
ГГФРТ — гипоксантин-гуанинфосфорибозилтрансфераза;
АФРТ
— аденинфосфорибозилтрансфераза; АКаза — аденозинкиназа
Слайд 84
Обмен нуклеотидов
При синтезе по «Запасному» пути возрастает
активность:
гипоксантин-гуанинфосфорибозилтрансферазы (ГГФРТ), катализирующей превращение азотистых оснований: гипоксантина и гуанина
в нуклеотиды – ИМФ и ГМФ с использованием ФРДФ в качестве донора фосфорибозы;
аденинфосфорибозилтрансферазы (АФРТ), синтезирующей АМФ из аденина и ФРДФ;
аденозинкиназы (АКаза), превращающей аденозин в АМФ за счет переноса γ-фосфатного остатка АТФ на 5'-гидроксильную группу рибозы нуклеозида.
Слайд 85
Обмен нуклеотидов
Катаболизм пуриновых нуклеотидов. Гиперурикемия и подагра
У

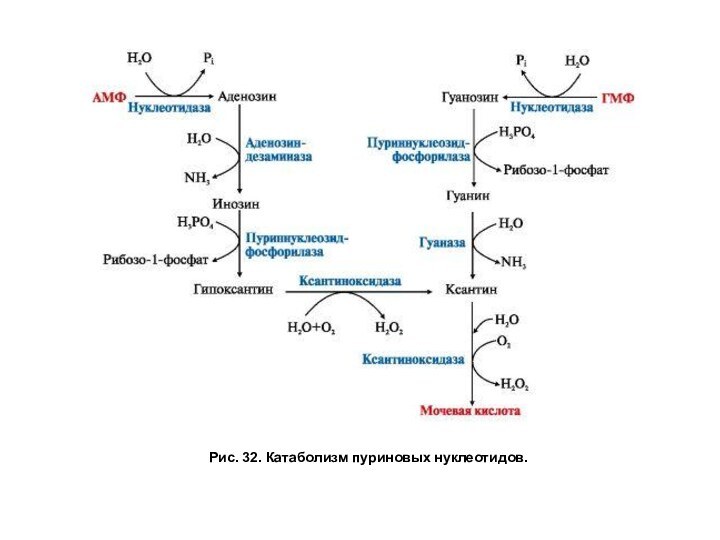
человека катаболизм пуриновых нуклеотидов заканчивается образованием мочевой кислоты. Первоначально нуклеотиды гидролитически
теряют фосфатный остаток в реакциях, катализируемых фосфатазами или нуклеотидазами. Аденозин дезаминируется аденозиндезаминазой с образованием инозина. Пуриннуклеозидфосфорилаза расщепляет нуклеозиды до свободных оснований и рибозо-1-фосфата. Затем ксантиноксидаза — аэробная оксидоредуктаза, простетическая группа которой включает ионы железа (Fe3+), молибдена и FAD, превращает азотистые основания в мочевую кислоту. Фермент в значительных количествах обнаруживается в печени и кишечнике и окисляет пурины молекулярным кислородом (рис. 32). Мочевая кислота удаляется из организма человека главным образом с мочой и немного с фекалиями. Она является слабой кислотой и в биологических жидкостях находится в недиссоциированной форме в комплексе с белками или в виде мононатриевой соли – урата. В норме в сыворотке крови ее концентрация составляет 0,15÷0,47 ммоль/л или 3÷7 мг/дл. Из организма ежесуточно выводится от 0,4 до 0,6 г мочевой кислоты и уратов.
Слайд 86
Рис. 32. Катаболизм пуриновых нуклеотидов.
Слайд 87
Обмен нуклеотидов. Катаболизм пуриновых нуклеотидов. Гиперурикемия и подагра
Частым

нарушением катаболизма пуринов является гиперурикемия, которая возникает, когда в плазме
крови концентрация мочевой кислоты превышает норму. Из-за плохой растворимости этого вещества на фоне гиперурикемии развивается подагра — заболевание, при котором кристаллы мочевой кислоты и уратов откладываются в суставных хрящах, связках и мягких тканях с образованием подагрических узлов или тофусов, вызывая воспаление суставов и нефропатию. Подагрой страдает от 0,3 до 1,7 % населения земного шара. У мужчин сывороточный фонд уратов в два раза выше, чем у женщин, поэтому они болеют подагрой в 20 раз чаще, чем женщины. Заболевание генетически детерминировано и вызывается:
дефектами ФРДФ-синтетазы, связанными с гиперактивацией, либо устойчивостью фермента к ингибированию конечными продуктами синтеза;
частичной потерей активности гипоксантингуанинфосфорибозилтрансферазы, которая обеспечивает повторное использование пуринов.
При полной потере активности гипоксантингуанинфосфорибозилтрансферазы развивается тяжелая форма гиперурикемии —синдром Леша–Найхана, при котором наблюдаются неврологические и психические отклонения. Болезнь наследуется как рецессивный признак, сцепленный с Х-хромосомой и встречается только у мальчиков.
Лечат подагру аллопуринолом — структурным аналогом гипоксантина. Ксантиноксидаза окисляет препарат в оксипуринол, который прочно связывается с активным центром фермента и останавливает катаболизм пуринов на стадии гипоксантина, который в 10 раз лучше растворим в жидкостях организма, чем мочевая кислота.
Слайд 88
Обмен нуклеотидов
Биосинтез и катаболизм пиримидиновых нуклеотидов. Оротацидурия
В
отличие от синтеза пуриновых нуклеотидов, при котором азотистое основание
формируется на остатке рибозо-5-фосфата, пиримидиновое кольцо первоначально собирается из простых предшественников: глутамина, аспартата и СО2. Затем оно взаимодействует с ФРДФ и превращается в уридин-5'- монофосфата — УМФ (рис. 33).
Синтез УМФ протекает в цитозоле клеток и включает 6 стадий, катализируемых 3 ферментами, два из которых полифункциональны. На первой стадии идет синтез карбамоилфосфата из Глн и СО2 с использованием 2 молекул АТФ. При присоединении к карбамоилфосфату Асп и отщеплении Н2О образуется циклическое соединение — дигидрооротат, который является продуктом первого полифункционального белка — КАД-фермента.
Слайд 89
Обмен нуклеотидов. Биосинтез и катаболизм пиримидиновых нуклеотидов. Оротацидурия
Название

КАД складывается из начальных букв ферментативных активностей, которыми обладают
отдельные каталитические домены:
карбамоилфосфатсинтетазы П (КФСП), аспартаттранскарбамоилазы и дигидрооротазы. Дигидрооротат далее окисляется в оротат под действием NADзависимой дигидооротатдегидрогеназы и при участии второго бифункционального фермента — УМФ-синтазы превращается в УМФ. УМФ образует УТФ в две стадии:
первую стадию катализирует УМФ-киназа,
УМФ + АТФ → УДФ + АДФ,
а вторую — НДФ-киназа с широкой субстратной специфичностью
УДФ + АТФ → УТФ + АДФ,
ЦТФ образуется из УТФ под действием ЦТФ, синтетазы, которая, используя энергию АТФ, замещает кетогруппу урацила на амидную группу Глн:
УТФ + Глн + АТФ → ЦТФ + Глу + АДФ + Н3РО4.
Регуляция синтеза пиримидиновых нуклеотидов осуществляется аллостерически по механизму отрицательной обратной связи:
УТФ ингибирует активность КФС П в составе КАД-фермента;
УМФ и ЦМФ подавляют активность второго полифункционального фермента — УМФ-синтазы;
накопление ЦТФ снижает активность ЦТФ синтетазы.
Слайд 90
Обмен нуклеотидов. Биосинтез и катаболизм пиримидиновых нуклеотидов. Оротацидурия
Запасные

пути в синтезе пиримидиновых нуклеотидов не играют столь существенной
роли, что в синтезе пуриновых нуклеотидов, хотя в клетках обнаружены:
пиримидинфосфорибозилтрансфераза, катализирующая реакцию:
Пиримидин + ФРДФ → Пиримидинмонофосфат + Н4Р2О7 (У или Ц) (УМФ или ЦМФ),
уридинкиназа, превращающая нуклеозид в нуклеотид:
Уридин + АТФ → УМФ + АДФ,
и уридинфосфорилаза, способная обращать реакцию деградации нуклеозида:
урацил + рибозо-1-фосфат→ уридин + Н3РО4.
В процессе катаболизма цитидиловые нуклеотиды гидролитически теряют аминогруппу и превращаются в УМФ. Когда от УМФ и дТМФ отщепляются неорганический фосфат с помощью нуклеотидазы или фосфатазы и рибоза при участии фосфорилаз, то остаются азотистые основания — урацил и тимин. Оба гетероцикла могут подвергаться гидрированию с участием NADPH-зависимой дигидропиримидиндегидрогеназы и гидролитическому расщеплению с образованием из дигидроурацила — β-уреидопропионовой, а из дигидротимина — β-уреидомасляной кислот. Дальнейшее гидролитическое расщепление уреидопроизводных заканчивается образованием СО2, NH4 и β-аланинаил и β-аминомасляной кислоты.
Среди нарушений обмена пиримидиновых нуклеотидов описано лишь одно редкое наследственное заболевание — оротацидурия, которое возникает в результате мутации в гене второго полифункционального фермента — УМФ-синтазы. В этом случае нарушается превращение оротата в УМФ, большие количества оротата ( до 1,5 г в сутки) выводятся с мочой. Развивается недостаточность пиримидиновых нуклеотидов. Для лечения этого заболевания используют уридин или цитидин в дозах от 0,5 до 1 г в сутки, которые с помощью нуклеозидкиназы превращаются в УМФ или ЦМФ в обход нарушенной реакции.
Слайд 91
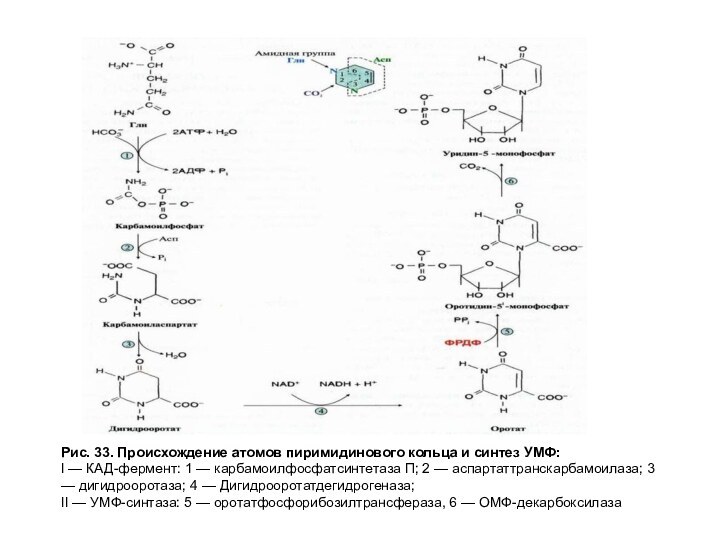
Рис. 33. Происхождение атомов пиримидинового кольца и синтез
УМФ:
I — КАД-фермент: 1 — карбамоилфосфатсинтетаза П; 2 — аспартаттранскарбамоилаза;
3 — дигидрооротаза; 4 — Дигидрооротатдегидрогеназа;
II — УМФ-синтаза: 5 — оротатфосфорибозилтрансфераза, 6 — ОМФ-декарбоксилаза
Слайд 92
Обмен нуклеотидов
Образование дезоксирибонуклеотидов
Обычно внутриклеточная концентрация дезоксирибонуклеотидов очень
низка, но в S-фазу клеточного цикла она возрастает, обеспечивая синтез
ДНК субстратами. В образовании дезоксирибонуклеотидов участвуют два ферментных комплекса: рибонуклеотидредуктазы и тимидилатсинтазы.
Восстановление всех рибонуклеотидов в дезоксипроизводные катализирует рибонуклеотидредуктазный комплекс, который включает собственно рибонуклеотидредуктазу, белок-восстановитель — тиоредоксин и фермент — тиоредоксинредуктазу, участвующий в регенерации тиоредоксина с помощью NADPH (рис. 34).
Слайд 93
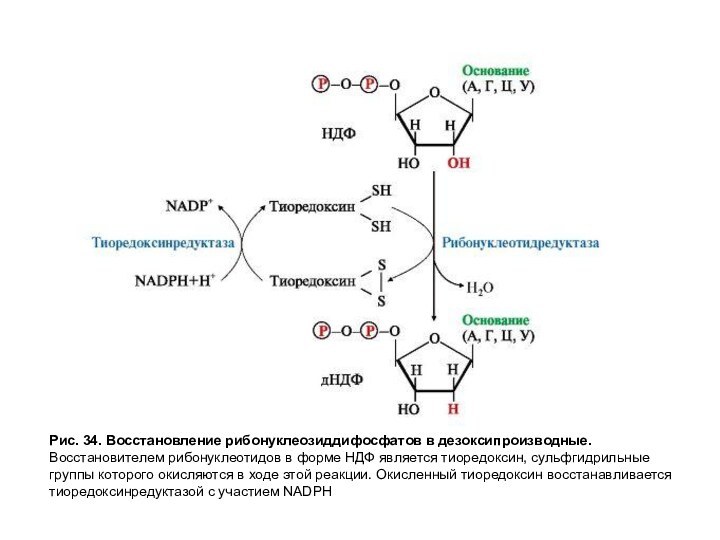
Рис. 34. Восстановление рибонуклеозиддифосфатов в дезоксипроизводные.
Восстановителем рибонуклеотидов в
форме НДФ является тиоредоксин, сульфгидрильные группы которого окисляются в
ходе этой реакции. Окисленный тиоредоксин восстанавливается тиоредоксинредуктазой с участием NADPH
Слайд 94
Обмен нуклеотидов. Образование дезоксирибонуклеотидов
Рибонуклеотидредуктаза — аллостерический фермент, активность
которого зависит от концентрации отдельных дНТФ, причем дАТФ является
ингибитором восстановления всех рибонуклеотидов. Это обстоятельство объясняет возникновение тяжелейших форм иммунодефицитов при снижении активности ферментов катаболизма пуринов: аденозиндезаминазы или пуриннуклеозидфосфорилазы (рис. 32). Недостаточность этих ферментов приводит к накоплению в В- и Т-лимфоцитах дАТФ и дГТФ, которые аллостерически ингибируют рибонуклеотидредуктазу и лишают ДНК предшественников. Синтез ДНК снижается, и клетки перестают делиться.
Слайд 95
Обмен нуклеотидов. Образование дезоксирибонуклеотидов
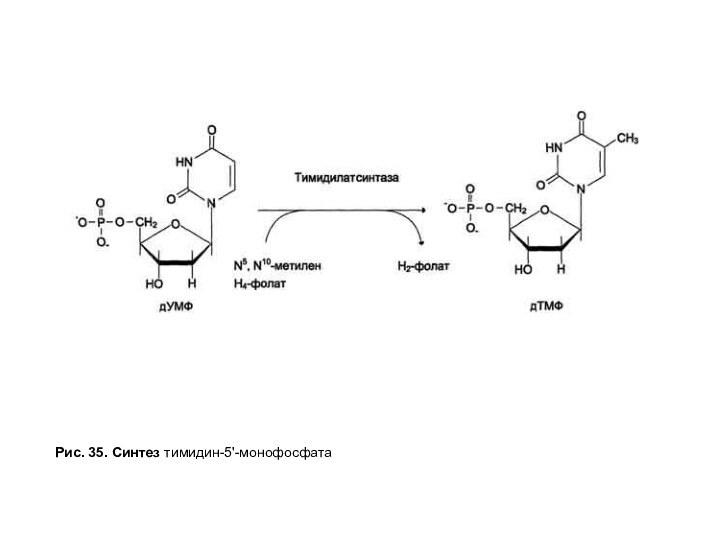
Синтез тимидиловых нуклеотидов катализирует тимидилатсинтазный
комплекс, в который входят тимидилатсинтаза, катализирующая включение одноуглеродного радикала в
молекулу дУМФ, дигидрофолатредуктаза, обеспечивающая восстановление Н2-фолатав Н4-фолат с участием NADPH, и сериноксиметилтрансфераза, осуществляющая перенос оксиметильной группы Серина на Н4-фолат с образованием N5N10-метилен-Н4-фолата (рис. 35). В организме человека дУМФ образуется из дЦДФ путем дефосфорилирования и последующего гидролитического дезаминирования.
Среди «запасных» путей синтеза определенное значение имеют:
тиминфосфорилаза, превращающая тимин в тимидин:
Тимин + Дезоксирибозо-1-фосфат→Тимидин + Н3РО4 и
тимидинкиназа, катализирующая фосфорилирование тимидина.
Тимидин + АТФ → дТМФ + АДФ.
Слайд 96
Рис. 35. Синтез тимидин-5'-монофосфата
Слайд 97
Обмен нуклеотидов.
Использование ингибиторов синтеза нуклеотидов в качестве противовирусных
и противоопухолевых препаратов
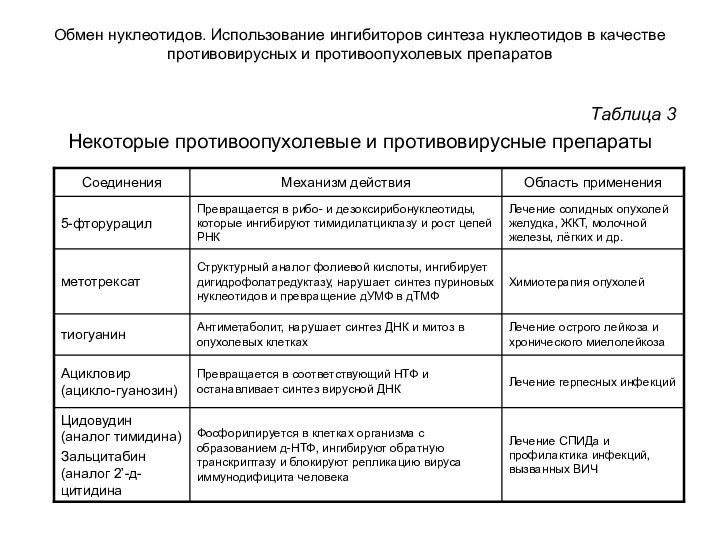
Аналоги азотистых оснований, нуклеозидов и нуклеотидов широко
используются в медицинской практике в качестве лекарственных препаратов (табл. 3). Они могут:
ингибировать определенные ферменты, участвующие в синтезе нуклеотидов или нуклеиновых кислот;
включаться в растущие цепи РНК или ДНК и останавливать рост цепей.