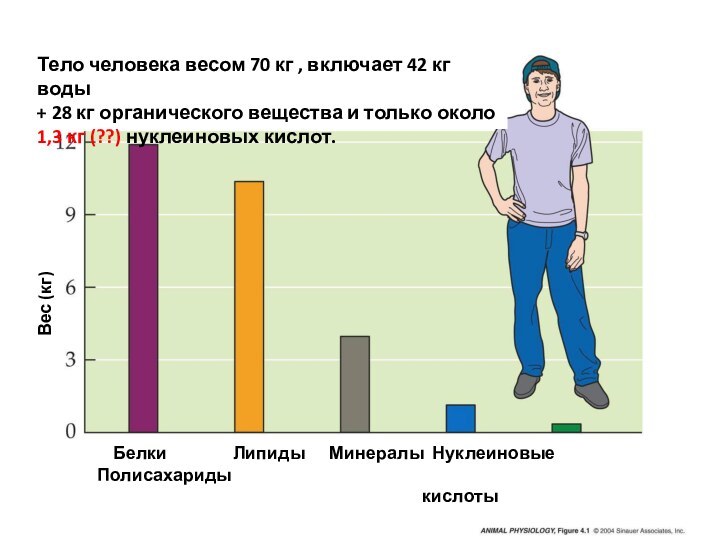
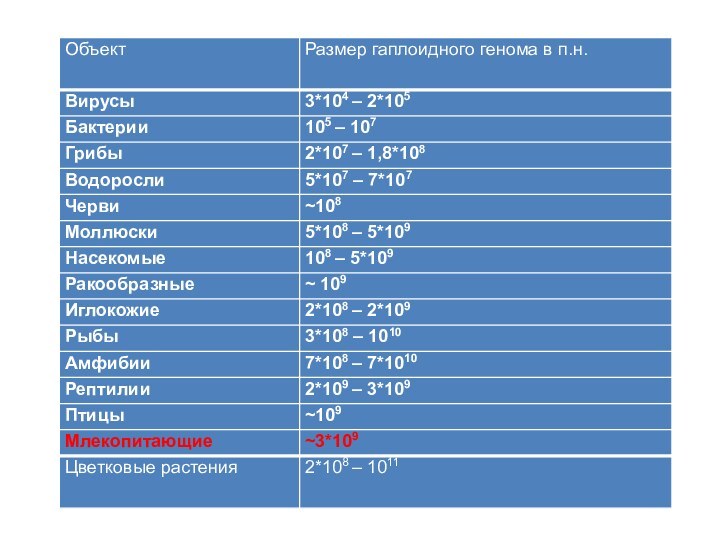
Слайд 3
Методы исследования первичной и вторичной структуры нуклеиновых кислот
Выделение
ДНК и РНК
Физико-химические свойства ДНК
Методы анализа первичной структуры ДНК
Методы
анализа вторичной структуры ДНК
Методы гибридизации ДНК
Слайд 4
Этапы выделения ДНК и РНК
Разрушение клеток.
Отделение нуклеиновых кислот
от белков, полисахаридов и др. соединений.
Осаждение нуклеиновых кислот.
Анализ чистоты
препарата.
Слайд 5
В зависимости от того, из какого организма выделяют
ДНК используют различные методы разрушения клеток:
Для разрушения клеток бактерий
используют химические вещества, разрушающие клеточную стенку бактерий – ЭДТА, лизоцим, ультразвук, гомогенизация и др. Для лизиса клеток и денатурации белков часто используется детергент додецилсульфат натрия или гуанидинизотиоцианат.
Разрушение клеток животных и человека не вызывает сложностей: используют гомогенизацию, обработку SDS, либо клетки обрабатывают протеиназами.
Для разрушения клеточных стенок растений – ферменты, разрушающие целлюлозу, замораживание в жидком азоте и последующее механическое разрушение клеток и др. Часто используют обработку детергентами, растворяющих мембраны клеток, и хелатирующими агентами, подавляющих действие клеточных нуклеаз за счѐт связывания двухвалентных катионов.
Слайд 6
2. Отделение нуклеиновых кислот от белков осуществляют :
депротеинизацию
клеточного лизата чаще всего осуществляют с помощью фенола и
хлороформа (белки переходят в фазу растворителя).
Молекулярщики часто используют смесь водонасыщенного фенола с хлороформом 1:1. В смеси с хлороформом фенол работает эффективнее, а изоамиловый спирт гасит пенообразование.
Нуклеиновые кислоты остаются в водном растворе.
Часто белки разрушают протеиназами, например, протеиназой К; а также центрифугированием для удаления денатурированных белков и фрагментов клеточных органелл.
Ряд современных методов предусматривает осаждение ДНК на гранулах силикагеля, центрифугирование и последующую элюцию ДНК с гранул в раствор.
Некоторые коммерческие наборы предусматривают сорбцию ДНК на мембранах или ионообменных сорбентах.
Слайд 7
ДНК осаждают из раствора этанолом и после центрифугирования
растворяют осадок в буферном растворе.
Вместе с ДНК частично
выделяется и РНК, от которой избавляются с помощью фермента РНКазы.
Слайд 8
Концентрацию полученной нуклеиновой кислоты, а также наличие примесей
(белков) обычно определяют спектрофотометрически по поглощению на А260 нм.
Максимум
поглощения белка приходится на 280 нм. Одна (каждая) оптическая единица соответствует концентрации ДНК в 50 мкг/мл. Для расчѐта можно воспользоваться калькулятором на интернет-ресурсе MOLBIOL.RU (http://www.molbiol.ru) или других подобных порталах.
Для оценки чистоты препарата ДНК, свободного от РНК, проводят измерения оптической плотности раствора при длинах волн 260, 280 и 235 нм, т.е. на максимумах поглощения растворов ДНК, белков и полисахаридов, соответственно.
Значение соотношения А260/280 для чистой ДНК должно быть больше 1,8. Значение А260/235 должно быть больше, чем 2,2.
Слайд 9
2. Физико-химические свойства ДНК и РНК
Физические свойства молекулы
ДНК. При повышении температуры или добавлении щелочей происходит разрыв
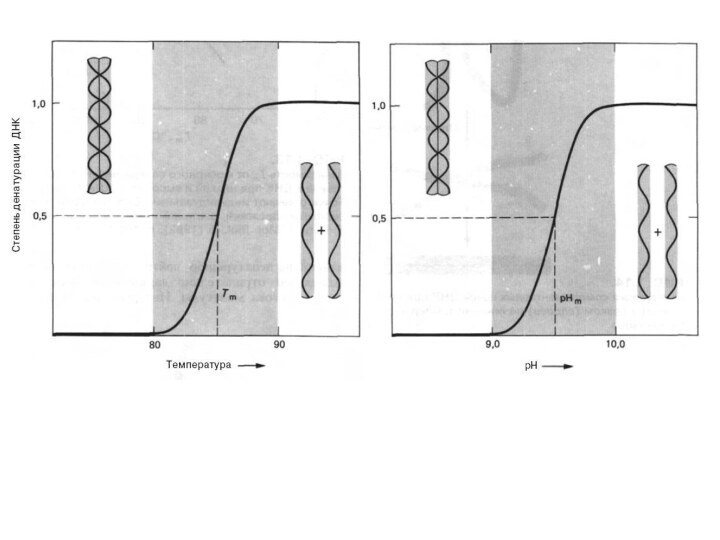
водородных связей между комплементарными основаниям. При этом происходит денатурация (плавление) и нативная двухцепочечная ДНК переходит в одноцепочечную форму. При охлаждении или понижении рН среды происходит ренатурация (отжиг), т.е. восстановление двойной спирали ДНК.
Температура плавления (Тm) – это температура, при которой денатурируется 50% всей ДНК. Тm зависит от содержания Г=Ц пар в молекуле ДНК. У млекопитающих, в том числе и у человека, Тm ДНК составляет 870С.
Способность ДНК денатурировать и восстанавливать двойную структуру используют для гибридизации при образовании дуплексов ДНК-РНК или ДНК-ДНК.
Слайд 11
Денатурация происходит также при увеличении рН раствора до
уровня, при котором разрушаются водородные связи между основаниями.
Денатурация
- процесс обратимый, последующее восстановление двухцепочечной структуры ДНК может происходить даже при полном расхождении цепей. Процесс воссоединения, называемый ренатурацией, реассоциацией или отжигом, происходит при понижении температуры или рН. Если температура или рН понижаются постепенно, то цепи соединяются правильно, с восстановлением всех исходных пар оснований. При резком понижении температуры или рН правильное воссоединение комплементарных цепей затрудняется и они остаются в несвязанном состоянии. Этот процесс называется «quenching» из-за спаривания оснований локально комплементарных участков в пределах одной или разных цепей.
Слайд 13
При денатурации изменяются некоторые физические свойства ДНК, например
ее оптическая плотность. Азотистые основания поглощают свет в ультрафиолетовой
области (с максимумом, близким к 260 нм). Молекула ДНК поглощает свет почти на 40 % меньше, чем смесь свободных нуклеотидов того же состава или смесь однонитчатых фрагментов ДНК. Это явление называют гипохромным эффектом, а обусловлено оно взаимодействием оснований при их расположении в двойной спирали.
Слайд 15
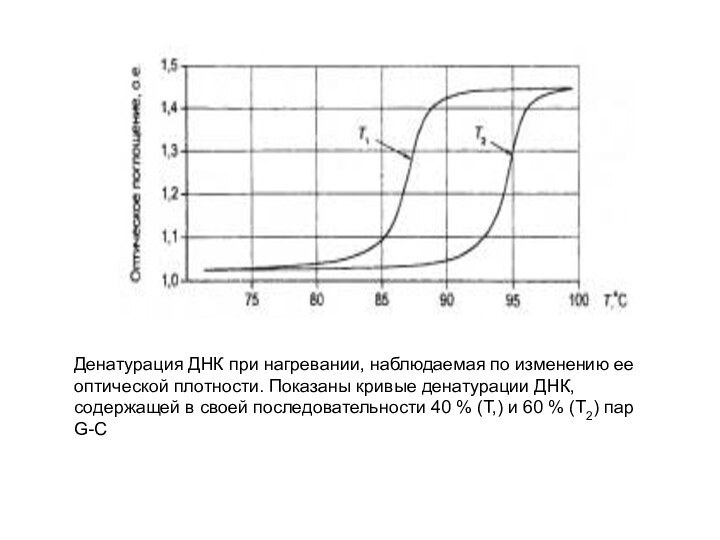
Денатурация ДНК при нагревании, наблюдаемая по изменению ее
оптической плотности. Показаны кривые денатурации ДНК, содержащей в своей
последовательности 40 % (Т,) и 60 % (Т2) пар G-C
Слайд 16
Поскольку для разрушения двух водородных связей АТ-пар требуется
меньше энергии, чем для разрыва трех водородных связей GС-пар,
значения температуры и рН, при которых происходит денатурация, зависят от нуклеотидного состава ДНК. Чем выше содержание GС-пар, тем выше Тт или рНm.
Слайд 18
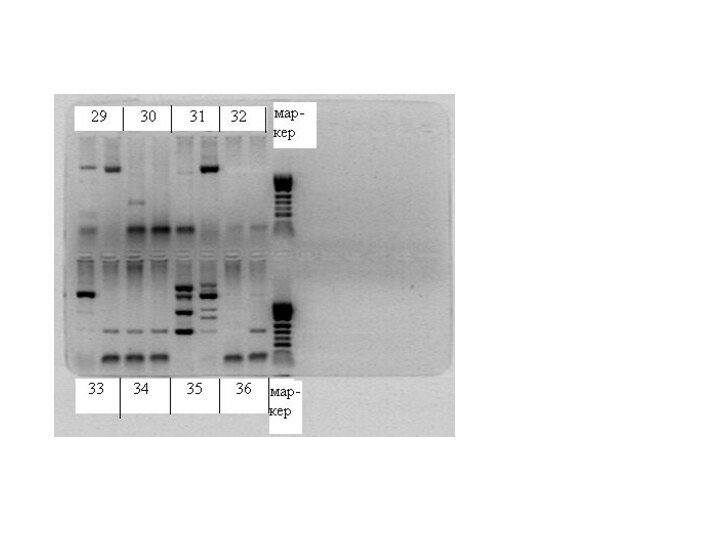
Электрофорез в агарозном геле является стандартным методом для
разделения, идентификации и очистки интактных молекул ДНК и их
фрагментов (высокомолекулярная хромосомная ДНК всегда фрагментируется при изоляции из клетки). Агароза – фракция природного полисахарида агар-агара.
Гель предотвращает свободную диффузию образца (в воде то же самое не получится);
ДНК – дезоксирибонуклеиновая кислота, значит, в растворе она диссоциирует на отрицательно заряженные ионы кислоты и H+ (протоны). Если у вас есть смесь фрагментов ДНК длин 10 и 20, то соответствующие анионы кислоты будут иметь заряд, пропорциональный длине фрагмента (и, соответственно, пропорциональный массе).
Слайд 19
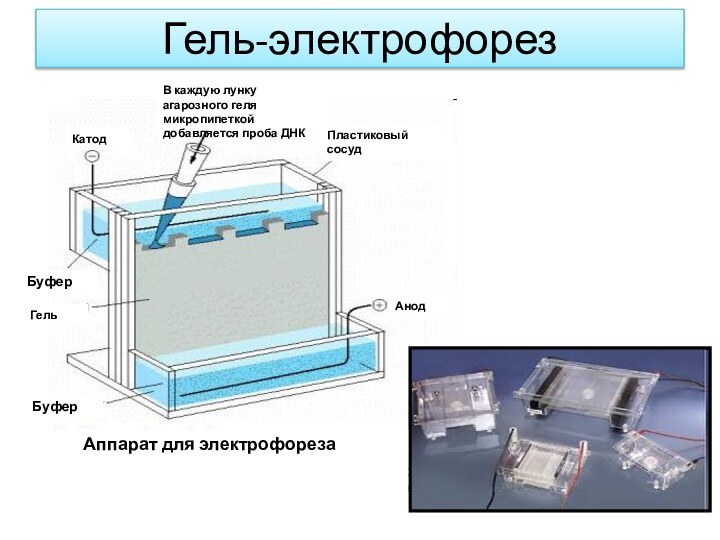
Гель-электрофорез
Пластиковый
сосуд
Анод
Катод
В каждую лунку агарозного геля микропипеткой добавляется
проба ДНК
Буфер
Гель
Буфер
Аппарат для электрофореза
Слайд 20
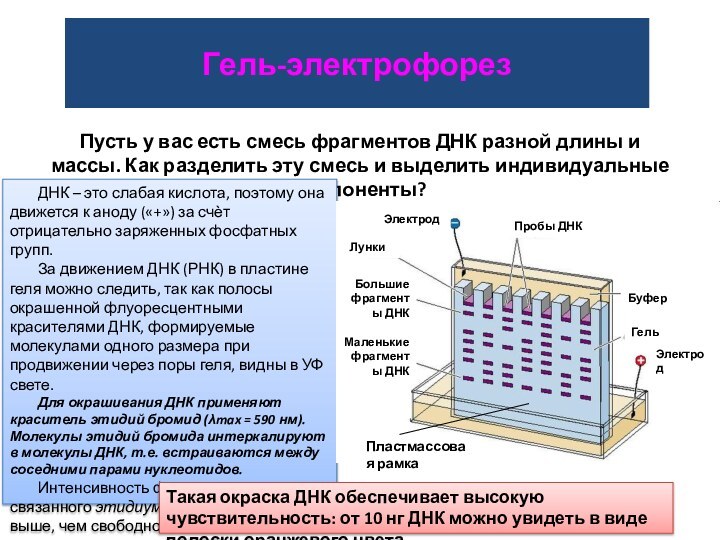
Гель-электрофорез
Пусть у вас есть смесь фрагментов ДНК разной
длины и массы. Как разделить эту смесь и выделить
индивидуальные компоненты?
ДНК – это слабая кислота, поэтому она движется к аноду («+») за счѐт отрицательно заряженных фосфатных групп.
За движением ДНК (РНК) в пластине геля можно следить, так как полосы окрашенной флуоресцентными красителями ДНК, формируемые молекулами одного размера при продвижении через поры геля, видны в УФ свете.
Для окрашивания ДНК применяют краситель этидий бромид (λmax = 590 нм). Молекулы этидий бромида интеркалируют в молекулы ДНК, т.е. встраиваются между соседними парами нуклеотидов.
Интенсивность флуоресценции связанного этидиум бромида в 20 раз выше, чем свободного.
Электрод
Электрод
Пробы ДНК
Буфер
Гель
Пластмассовая рамка
Гель
Большие фрагменты ДНК
Маленькие фрагменты ДНК
Лунки
Такая окраска ДНК обеспечивает высокую чувствительность: от 10 нг ДНК можно увидеть в виде полоски оранжевого цвета.
Слайд 25
В 1977 г. Максамом и Гилбертом был предложен
метод секвенирования, основанный на селективной химической модификации различных типов
оснований в составе ДНК с последующим расщеплением межнуклеотидных связей в модифицированных звеньях.
Реакции селективной модификации по каждому типу гетероциклических оснований проводятся таким образом, чтобы в каждой молекуле ДНК в среднем модифицировалось только одно звено данного типа.
Поскольку все звенья данного типа в составе молекулы эквивалентны и реагируют с модифицирующим агентом с одинаковыми скоростями, то в сумме каждое звено этого типа окажется частично модифицированным.
Дальнейшая обработка ДНК вторичным амином или щелочью приводит к отщеплению модифицированных гетероциклических оснований от цепи ДНК и разрыву полинуклеотидной цепи в местах отщепления гетероциклов.
Модификации подвергают ДНК, 32Р-меченные по 5'-концевому нуклеотидному звену. Радиоактивная метка вводится фосфорилированием с помощью 32Р-АТР и Т4-полинуклеотидкиназы.
Слайд 26
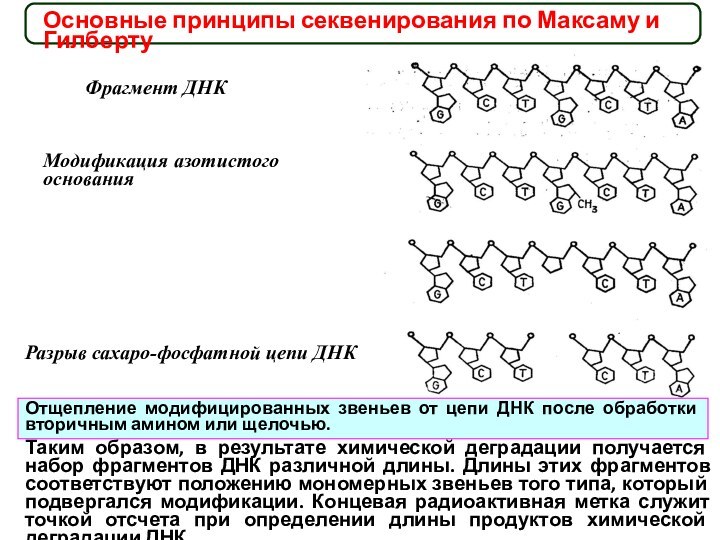
Основные принципы секвенирования по Максаму и Гилберту
Фрагмент ДНК
Модификация
азотистого основания
Разрыв сахаро-фосфатной цепи ДНК
Отщепление модифицированных звеньев от цепи
ДНК после обработки вторичным амином или щелочью.
Таким образом, в результате химической деградации получается набор фрагментов ДНК различной длины. Длины этих фрагментов соответствуют положению мономерных звеньев того типа, который подвергался модификации. Концевая радиоактивная метка служит точкой отсчета при определении длины продуктов химической деградации ДНК.
Слайд 27
Метод Максама и Гилберта, разработанный для анализа первичной
структуры достаточно длинных ДНК, применим и для коротких (8
– 16 звенных) олигодезоксирибонуклеотидов.
Слайд 28
Пусть есть образец ДНК, надо узнать его последовательность.
Возьмем
раствор, содержащий наш образец (одноцепочечную ДНК в достаточном количестве),
дезоксинуклеотиды дНТФ (кирпичи, из которых строится ДНК), ДНК-полимеразу (белок-строитель), и праймер к образцу (праймер – это комплементарная «затравка» - кусочек ДНК, комплементарный началу нашего фрагмента, достаточной длины, чтобы с него начался синтез комплементарной цепи):
Если позволить полимеразе работать (то есть, держать температуру, в которой ей удобно вести синтез), то в результате мы получим полностью достроенные комплементарные цепи.
Слайд 29
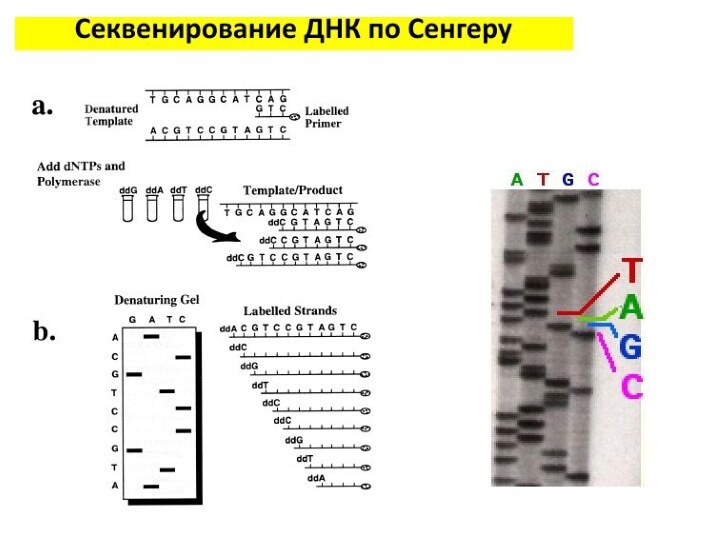
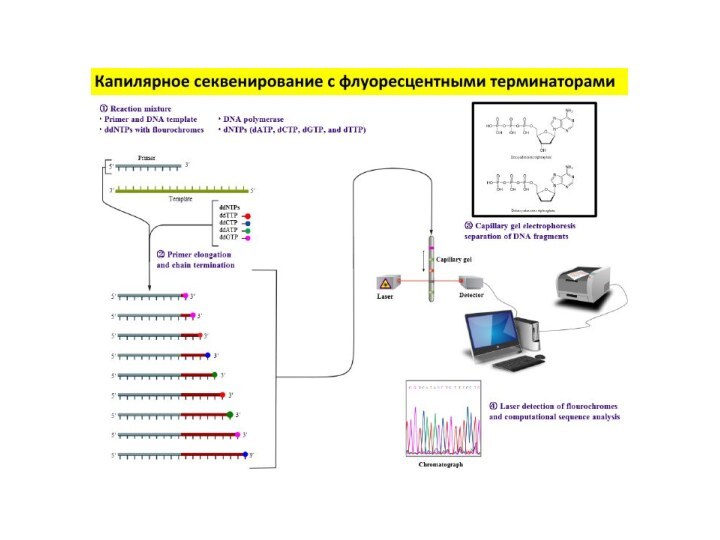
Секвенирование ДНК по Сэнгеру
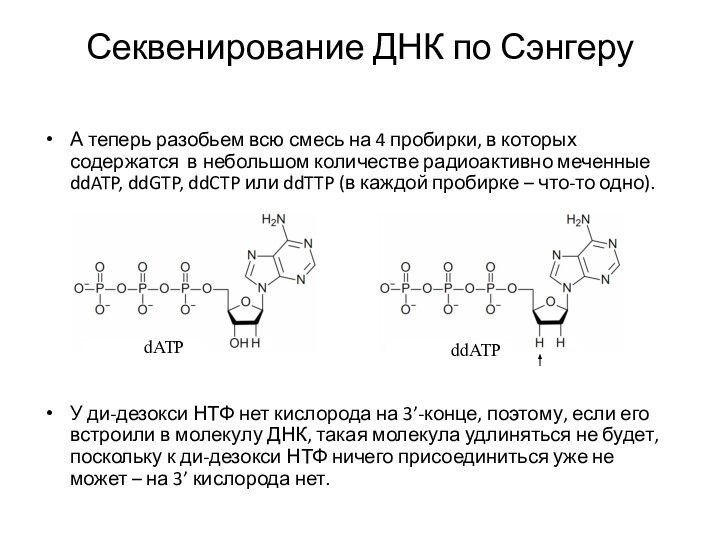
А теперь разобьем всю смесь
на 4 пробирки, в которых содержатся в небольшом количестве
радиоактивно меченные ddATP, ddGTP, ddCTP или ddTTP (в каждой пробирке – что-то одно).
У ди-дезокси НТФ нет кислорода на 3’-конце, поэтому, если его встроили в молекулу ДНК, такая молекула удлиняться не будет, поскольку к ди-дезокси НТФ ничего присоединиться уже не может – на 3’ кислорода нет.
dATP
ddATP
Слайд 30
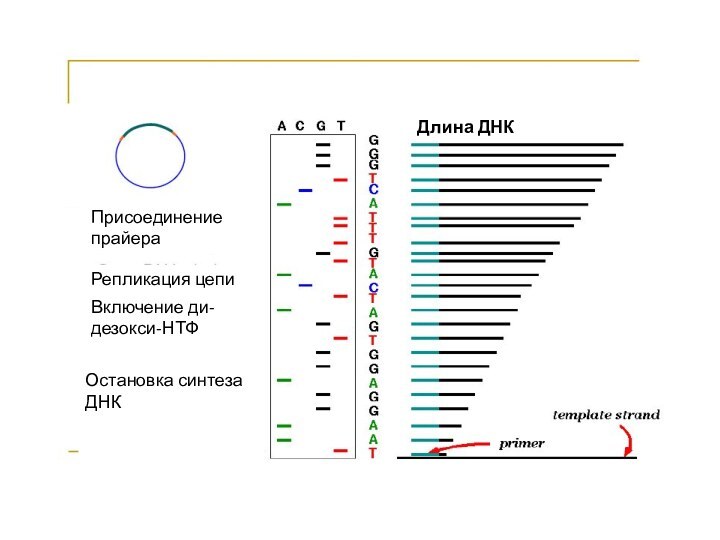
Длина ДНК
Присоединение прайера
Репликация цепи
Включение ди-дезокси-НТФ
Остановка синтеза ДНК
Слайд 33
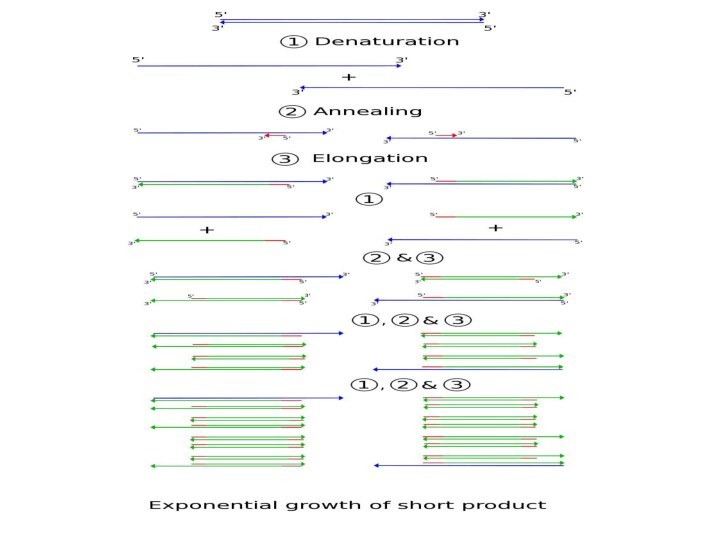
Полимеразная цепная реакция (ПЦР)
Слайд 34
Полимеразная цепная реакция
(ПЦР, PCR, Kary Mullis,1983)
Пусть у
вас есть следовые количества ДНК в косточке неандертальца, а
вам нужно получить ее в высокой концентрации, чтобы секвенировать.
Действующие лица: ваша двуцепочеченая ДНК (образец), праймеры (короткие кусочки по ~ 20 нуклеотидов, комплементарные к 2 участкам вокруг той области, которую вы хотите «поднять»), дезоксиНТФ (кирпичи для постройки ДНК), термоциклер, термоустойчивая полимераза (Taq).
Слайд 36
ПЦР
Когда вы поднимаете температуру, то цепи ДНК друг
от друга отлипают, когда опускаете – происходит отжиг (то
есть слипаются обратно). При отжиге чаще слипаются не полные цепи, а праймеры с цепями (просто потому, что праймеров в растворе много, а цепей – мало). Полимераза начинает удлинять праймеры и так во всем объеме => удвоение концентрации цепей ДНК на каждом шаге.
Дальше с этой ДНК можно делать все, что угодно, например, отсеквенировать.
Слайд 37
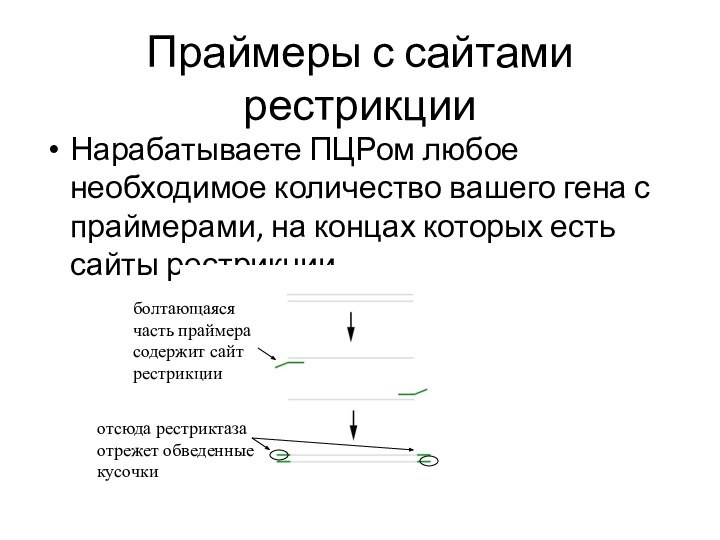
Сайты рестрикции
Когда делаете ПЦР своего гена, подбираете праймеры
к концам вашего фрагмента так, чтобы на них были
сайты узнавания рестриктазы (см. следующие слайды).
рестриктазы
и реакции,
которые они
катализируют
Слайд 38
Рестриктазы часто разрезает ДНК, образуя липкие концы, которые
позволяют склеивать между собой несколько участков ДНК. Если разрезать
сайты на концах праймеров вокруг вашего гена, а также в ДНК плазмиды одной и той же рестриктазой, то можно будет вставить ваш ген в плазмиду – на плазмиде и вокруг гена образуются одинаковые липкие концы, которые имеют шанс слипнуться друг с другом. Разрывы после этого надо «зашить» белком – лигазой.
ген
плазмида
плазмида
липкие концы (одна цепь длиннее другой)