- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Микробные объекты в биотехнологии
Содержание
- 2. Искусственные ассоциации с микроорганизмами как способ модификации
- 3. При получении ассоциаций на основе изолированных протопластов
- 4. Цели создания ассоциаций. Искусственные ассоциации клеток высших
- 5. Повышение продуктивности культур растительных клеток.Растительные клетки в
- 6. Особое значение при этом, очевидно, имеет введение
- 7. Улучшение сельскохозяйственных растений. Другая возможность использования в
- 8. Практика сельскохозяйственного производства поставила вопрос придания способности
- 9. Другой способ — применение методов генетической инженерии
- 10. Ограничения указанных двух подходов по приданию растениям
- 11. Достижение этой цели возможно с использованием техники
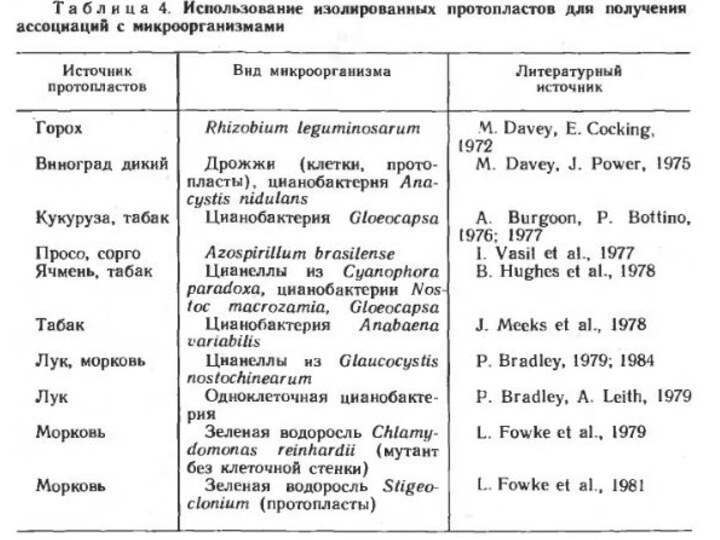
- 12. Введение микроорганизмов в изолированные протопласты растенийПартнеры создаваемых
- 13. бактерии R. leguminosarum, A. brasilense, цианобактерии Gloeocapsa,
- 15. Механизмы проникновения микроорганизмов в протопласты. Введение микроорганизмов
- 16. Слияние зеленых водорослей (протопластов и мутанта без
- 18. Помимо использования ПЭГ в качестве индуктора поглощения
- 19. Характеристика продуктов поглощения и слияния. Системы, полученные
- 20. Введение микроорганизмов в популяции культивируемых клеток растений.
- 22. Ассоциации с клубеньковыми бактериями. Основная задача при
- 23. Таким образом, получение азотфикеирующих ассоциаций при взаимодействии
- 24. Ассоциации с азотфиксирующими свободноживущими бактериями. Эксперименты по
- 25. Как Azotobacter, так и Azospirillum в соответствующих
- 26. Ассоциация с зеленой водорослью. Инокуляция каллуса моркови
- 27. Различные виды грибов по-разному воздействовали на рост
- 28. Особенности цианобактерий в качестве партнера растительных клеток
- 29. Скачать презентацию
- 30. Похожие презентации
Искусственные ассоциации с микроорганизмами как способ модификации растительной клетки и растенияВ последние годы в области клеточной инженерии растительной клетки выделилось направление по созданию новых клеток и клеточных систем путем введения микроорганизмов в клетку или в популяции



























Слайд 2 Искусственные ассоциации с микроорганизмами как способ модификации растительной
клетки и растения
растительной клетки выделилось направление по созданию новых клеток и клеточных систем путем введения микроорганизмов в клетку или в популяции культивируемых клеток растений. Экспериментально создаваемые клеточные системы называют ассоциациями по аналогии с ассоциациями, формирующимися в природе между организмами разных видов. При этом исследования направлены на получение ассоциаций внутриклеточного (эндосимбиотического) или межклеточного (экзосимбиотического) типа. В первом случае проводят индуцированное введение микроорганизмов в изолированные протопласты высших растений. Во втором — совместно культивируют клетки или ткани растений с микроорганизмами. Хотя, как будет видно при дальнейшем изложении, исходно задаваемая в эксперименте локализация микроорганизмов — внутри клеток или в межклетниках тканей — не всегда сохраняется в процессе создания и культивирования таких систем.Слайд 3 При получении ассоциаций на основе изолированных протопластов или
культивируемых клеток высших растений с микроорганизмами предполагается, что клетки
или популяции клеток растений должны приобретать новые свойства, обусловленные присутствием в них клеток микроорганизмов. Возможность получения из изолированного протопласта клетки, если она сохранится у протопластов и после введения в них микроорганизмов, создает предпосылку для модификации клеток. Совместное культивирование растительных клеток и микроорганизмов позволило бы получать популяции растительных клеток с новыми свойствами, приобретенными в результате их взаимодействия с клетками микроорганизмов. И наконец, способность растительной клетки in vitro дать начало целому растению открывает возможность направленного изменения растений. Очевидно, последнее осуществимо при условии, что микроорганизмы, введенные внутрь клеток или в популяции клеток, сохранятся и в растениях, регенерированных из таких клеток.Слайд 4 Цели создания ассоциаций. Искусственные ассоциации клеток высших растений
и микроорганизмов могут быть использованы для решения следующих фундаментальных
научных проблем и практических задач.1. Экспериментальная проверка теории эндосимбиотического происхождения эукариотной клетки, которое происходило, как полагают, через стадию экзосимбиоза.
2. Реконструирование отдельных стадий эволюционного процесса симбиогенеза. Возникновение ныне существующих симбиозов высших растений с микроорганизмами произошло в результате длительного и сложного эволюционного процесса. Воспроизведение природных симбиозов в лаборатории позволило бы понять механизмы возникновения и условия для формирования их заново в природе.
3. Моделирование и изучение на клеточном уровне природных симбиотических отношений (например, бобовых растений с клубеньковыми бактериями), имеющих большое практическое значение в обеспечении растений связанным азотом в природных экосистемах и в агрофитоценозах.
4. Повышение продуктивности растительной клетки при выращивании в культуре.
5. Улучшение экономически важных видов растений.
Остановимся более подробно на возможности применения в биотехнологии искусственных ассоциаций с микроорганизмами, получаемых на основе культур растительных клеток или регенерированных из них растений.
Слайд 5
Повышение продуктивности культур растительных клеток.
Растительные клетки в культуре
проводят биосинтез (или биотрансформацию) важных для медицины и ряда
отраслей промышленности веществ. Одним из требований рентабельности производства на основе растительных клеток является возможность культивирования на простых по составу питательных средах. Между тем культуры растительных клеток требуют присутствия в среде витаминов, фитогормонов, аминокислот, сахарозы и других веществ. Серьезным ограничением практического использования культур растительных клеток является энергетическое обеспечение процессов биосинтеза. Растительные клетки в культурах гетеротрофны или обладают ограниченной способностью к фотосинтезу. Представляется маловероятным совместить в культивируемой клетке способность к собственному фотосинтезу и биосинтезу видоспецифических продуктов. Одним из решений данной проблемы могло бы быть введение в эти культуры микроорганизмов, синтезирующих субстраты для роста растительных клеток или предшественники для биосинтеза.Слайд 6 Особое значение при этом, очевидно, имеет введение в
гетеротрофно растущие клетки или культуры клеток растений фототрофных микроорганизмов.
Последние могли бы обеспечить растительные клетки продуктами фотосинтетической фиксации углерода, что позволило бы упростить состав среды.В литературе отмечается недостаточное использование в биотехнологии принципов организации природных биологических систем, в частности, основанных на взаимоотношениях организмов разных видов. В микробиологии уже накоплен положительный опыт смешанного культивирования. В результате изучения смешанных культур микроорганизмов (выделенных из природы или созданных искусственно) выяснилось, что можно проводить более эффективно (по сравнению с монокультурами) накопление биомассы, кооперативный биосинтез конечных продуктов или трансформацию в нужном направлении исходного субстрата. Такие системы находят все большее применение в микробиологической промышленности и могут быть использованы для очистки сточных вод, биосинтеза белка (ферментов) и биологически активных веществ, таких, как ауксины, витамины, антибиотики. Считается, что в биотехнологии найдут применение смешанные популяции, разнообразные по своему составу, начиная от комбинаций нескольких штаммов одного вида микроорганизма и кончая сочетаниями представителей разных царств — животного и растительного.
Слайд 7 Улучшение сельскохозяйственных растений. Другая возможность использования в биотехнологии
ассоциаций клеток высших растений с микроорганизмами состоит в получении
растений, способных к фиксации молекулярного азота. Повышение урожайности сельскохозяйственных растений в значительной степени зависит от обеспечения их связанным азотом. Растения получают его двумя путями. Один из них — потребление внесенных в почву химических азотных удобрений, на получение которых затрачивается огромная энергия. Растения же используют азотные удобрения частично — от 30 до 50% вносимого количества. Продукты разложения азотных удобрений в почве образуют токсичные соединения, загрязняющие окружающую среду.Другим источником является биологическая фиксация молекулярного азота, которую осуществляют многие группы микроорганизмов. Она безвредна для человека и окружающей среды (в том объеме, в котором она осуществляется в агрофитоценозах и в естественных экосистемах). Большая часть азота в природе фиксируется симбиотическими азотфиксаторами. Они используют продукты фотосинтеза макросимбионта для покрытия энергетических затрат на фиксацию азота и передают связанный азот растению. Способность формировать азотфиксирующие симбиозы, однако, приобрели в процессе эволюции только определенные виды растений и микроорганизмов.
Все это обусловило интерес исследователей к разработке проблемы повышения доли биологического азота в питании растений.
Слайд 8 Практика сельскохозяйственного производства поставила вопрос придания способности к
азотфиксации экономически важным видам растений, которым это не свойственно. В
решении этой задачи предлагаются разные подходы.Растения искусственно инокулируют азотфиксирующими бактериями путем введения микроорганизмов в почву и ризосферу. Однако получаемый при этом эффект повышения урожая растений во многих случаях связан не с фиксацией бактериями азота, а с увеличением под влиянием бактерий числа корней и в результате более активным поглощением растениями ионов и воды. Кроме того, отмечается низкая выживаемость и вытеснение интродуцируемых чистых культур микроорганизмов естественной почвенной микрофлорой. Поэтому этот подход представляется бесперспективным.
Слайд 9 Другой способ — применение методов генетической инженерии для
создания растений, способных к азотфиксации. Предлагается переносить гены азотфиксации
(nif-гены) от микроорганизмов, фиксирующих азот, непосредственно в злаковые или другие экономически важные виды растений. По мнению специалистов, эта процедура методически вполне осуществима; nif-ген может быть введен в протопласты растений с помощью определенных векторов (таких, как плазмиды бактерий, патогенных для растений, или вирусы растений). Последующее культивирование протопластов и их регенерация до целых растений позволили бы получить особи, которые несли бы введенную генетическую информацию в своих клетках и, возможно, в последующих поколениях благодаря передаче через семена. Однако, несмотря на принципиальную возможность применения такого подхода, привлечение методов генетической инженерии вряд ли позволит в ближайшее время перейти к задаче создания азотфиксирующих растений. Основные сложности состоят в следующем: требуется разработка методов введения nif-генов в растительную клетку, их репликации и экспрессии там; у высших растений отсутствуют системы, которые осуществляли бы энергообеспечение фермента азотфиксации — нитрогеназы (процесс азотфиксации связан с затратой большого количества клеточной энергии); растительная клетка не обладает соответствующими системами транспорта и запасания в высокой концентрации ионов железа и молибдена, необходимых для синтеза нитрогеназы; наконец, она не имеет системы защиты нитрогеназы от инактивации кислородом. Последнее обстоятельство считают главным лимитирующим фактором в экспрессии nif-генов при введении их в аэробные организмы.Слайд 10 Ограничения указанных двух подходов по приданию растениям способности
к фиксации молекулярного азота могут быть хотя бы частично
преодолены при введении целых клеток азотфиксирующих микроорганизмов в растение. Речь идет об альтернативном способе решения обсуждаемой проблемы, связанном с конструированием новых искусственных ассоциаций. Такие системы должны быть основаны на симбиотических взаимоотношениях растительного и микробного партнеров. В этих экспериментах должны учитываться особенности организации природных азотфиксирующих симбиозов, а именно: 1) сохранение целостности обоих партнеров; 2) интеграция партнеров в пределах организма макросимбионта; 3) относительная обособленность микросимбионта, компартментация его в специальных структурах (например, локализация клубеньковых бактерий в клубеньках у бобовых растений, цианобактерии Anabaena azollae — в полости листа папоротника Azolla). Азотфиксация в таких искусственно создаваемых системах осуществлялась бы за счет функционирования азотфиксирующих микроорганизмов в клетках или тканях растений.Слайд 11 Достижение этой цели возможно с использованием техники клеточной
инженерии. Введение азотфиксирующих бактерий в клетки или популяции культивируемых
клеток небобовых растений позволяет испытать большое число сочетаний партнеров и выбрать устойчивые ассоциации на уровне культивируемых клеток. В процессе культивирования возможна адаптация партнеров к совместному существованию, аналогичная тем изменениям, которые приобретают компоненты природных симбиотических ассоциаций по сравнению со свободноживущими формами. Последующее получение растения в результате индукции органогенеза при условии сохранения клеточных взаимодействий, складывающихся в клеточных системах, позволило бы решать поставленную задачу — инкорпорирования бактериального симбионта в ткани (клетки) растения, интеграции их в клеточные ансамбли хозяина при сохранении интактности вводимого симбионта.Очевидны преимущества введения в клетки и ткани растений целых клеток азотфиксаторов. Защита нитрогеназы от кислорода, выделяемого растением и необходимого для его роста, в таком случае будет осуществляться с помощью механизмов, которыми обладают бактериальные клетки. Особого внимания заслуживает использование в экспериментах азотфиксаторов, способных к фотосинтезу. Такие организмы могли бы обеспечить нитрогеназу энергией, получаемой в процессе собственного фотосинтеза. В случае применения гетеротрофных азотфиксаторов остро стоит вопрос о том, сможет ли растение в ассоциации с бактериями образовать достаточное количество продуктов фотосинтеза, чтобы обеспечить энергетические потребности нитрогеназы симбионта без ущерба для своего роста и ухудшения потребительских качеств растения (по содержанию углеводов, белка и т. д.).
Слайд 12
Введение микроорганизмов в изолированные протопласты растений
Партнеры создаваемых ассоциаций.
С целью получения ассоциаций внутриклеточного типа предпринимались неоднократные попытки
вводить микроорганизмы в изолированные протопласты разных видов высших растений, среди которых представлены злаковые и другие сельскохозяйственные культуры, не имеющие естественных симбионтов. Протопласты выделяют из тканей растений или клеток суспензионных культур ферментативным способом.В изолированные протопласты растений вводили микроорганизмы разных систематических групп: бактерии, дрожжи, цианобактерии (прежнее их название — синезеленые водоросли), органеллы (называемые цианеллами) водоросли Glaucocystis nostochinearum и криптомонадоподобного простейшего Cyanophora paradoxa. Цианеллы представляют собой эндосимбиотические цианобактерии с отсутствующей или редуцированной клеточной стенкой. Используемые в экспериментах микроорганизмы отличались своими метаболическими возможностями. Зеленые водоросли, все цианобактерии и цианеллы осуществляют фотосинтез;
Слайд 13 бактерии R. leguminosarum, A. brasilense, цианобактерии Gloeocapsa, A.
variabilis и N. macrozamia — азотфиксаторы. Цианобактерия A. variabilis
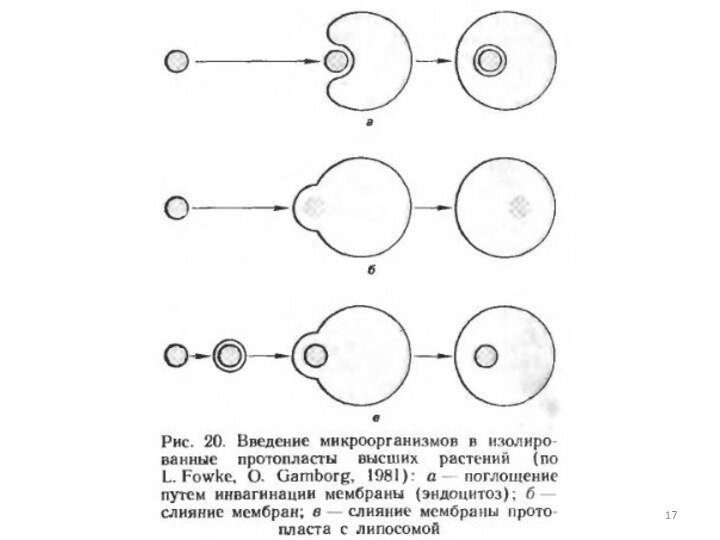
— факультативный фототроф и способна к гетеротрофному росту в темноте. Наряду с диким штаммом в протопласты вводили также ауксотрофные мутанты A.variabilis, испытывающие потребность в определенных факторах роста, которые они могли бы получать от растительной клетки. Такой прием применяют с целью установления возможной зависимости эндосимбионта от роста и метаболизма клетки хозяина.Слайд 15 Механизмы проникновения микроорганизмов в протопласты. Введение микроорганизмов в
изолированные протопласты растений проводят при воздействии на них специальными
индуцирующими факторами. Микроорганизмы могут поглощаться протопластами или сливаться с ними. Протопласты гороха поглощали клетки Rhizobium непосредственно в процессе ферментативного разрушения клеточных стенок клеток мезофилла листа при получении изолированных протопластов. Во всех остальных случаях в качестве индуктора поглощения или слияния применяли полиэтилеигликоль (ПЭГ), который известен как агент, повышающий частоту слияния протопластов высших растений.Поглощение растительными протопластами микроорганизмов (кроме зеленых водорослей) может происходить путем эндо цитоза, т.е. с помощью инвагинации плазмалеммы. При действии ПЭГ микроорганизмы прикрепляются к плазмалемме, образуется инвагинация плазмалеммы вокруг микроорганизма с последующим замыканием конца инвагинации путем слияния плазмалеммы. В результате образования таким образом везикула с микроорганизмом высвобождается в цитоплазму протопласта.
Слайд 16 Слияние зеленых водорослей (протопластов и мутанта без клеточной
стенки) с протопластами моркови индуцируется ПЭГ по аналогии со
слиянием протопластов высших растений. В этом случае происходит интеграция цитоплазматических мембран растительных протопластов и водорослей, а органеллы водорослей высвобождаются в цитоплазму протопластов, но не окружаются плазмалеммой протопласта. В связи с проблемой сохранения интактности вводимых в протопласты органелл или микроорганизмов тот и другой способы имеют свои недостатки. Поглощение путем эндоцитоза приводит к изолированию вводимых в протопласт объектов в везикулах из плазмалеммы протопласта. Поскольку эти везикулы могут сливаться с лизосомальным аппаратом растительного протопласта, существует опасность, что это приведет к разрушению вводимого чужеродного материала. При слиянии происходит интеграция мембраны протопласта растения и микроорганизма, нарушение целостности микроорганизма и освобождение его органелл внутрь растительного протопласта. Обнаруженное для зеленых водорослей слияние с протопластами может рассматриваться, таким образом, как способ введения в растительную клетку не целых микроорганизмов, а интактных органелл. В качестве альтернативного пути, позволяющего преодолеть недостатки обоих рассматриваемых способов, предлагается заключать микроорганизмы в искусственные мембраны — липосомы. Этот прием уже был использован в опытах по введению в протопласты лука одноклеточных цианобактерий, заключенных в липидные капли. Преимущества данного методического приема видятся в том, что искусственные мембраны будут сливаться с плазмалеммой протопласта, освобождая таким образом интактные клетки микроорганизмов в цитоплазму протопласта.Слайд 18 Помимо использования ПЭГ в качестве индуктора поглощения протопластами
микроорганизмов, можно отметить успешное применение в этих целях поливинилового
спирта (ПВС), который также известен как индуктор слияния протопластов. При воздействии ПВС протопласты Vinca rosea поглощали сферопласты Agrobacterium tumefaciens (S. Hasezama et al., 1983), клетки и сферопласты Escherichia coli (С. Matsui et al., 1983) в экспериментах, проводимых с целью генетической трансформации протопластов. В этих опытах ПВС не оказывал токсического эффекта на протопласты, который был отмечен в сравнительных опытах с использованием ПЭГ.Слайд 19 Характеристика продуктов поглощения и слияния. Системы, полученные путем
поглощения протопластами микроорганизмов или слияния с ними, обладали ограниченной
способностью к выживанию или культивированию. В протопластах кукурузы обнаружено быстрое движение цитоплазмы через 14 ч после поглощения ими клеток цианобактерии, что служит признаком их жизнеспособности. В некоторых случаях протопласты, содержащие клетки или органеллы микроорганизмов, в процессе культивирования регенерировали клеточные стенки, и только в случае поглощения органелл С. reinhardii были способны к последующему делению. Клетки табака с внутриклеточной A. variabilis никогда не делились и через 5 сут культивирования разрушались. Есть отдельные данные о сохранении интактности клеток и органелл микроорганизмов внутри протопластов. В протопластах гороха в везикулах наблюдали делящиеся клетки Rhizobium, однако осталось неясным, начали они деление до или после поглощения их протопластом. Морфология бактерий свидетельствует об их интактном состоянии. Не происходило деления цианобактерии A. variabilis в протопластах табака в процессе их культивирования, хотя цианобактерии сохраняли видимую интактность. Ни один из акусотрофных мутантов этой цианобактерии не имел преимуществ в формировании внутриклеточных систем, гибель которых происходила с той же скоростью, что и систем, образуемых с диким штаммом. Органеллы зеленых водорослей в растительных протопластах в процессе культивирования деградировали, и только хлоропласты обнаруживались в цитоплазме клеток моркови через 10 сут.Слайд 20 Введение микроорганизмов в популяции культивируемых клеток растений. Партнеры
ассоциаций и принципы их создания. При получении ассоциаций на
основе культивируемых клеток и тканей используется разнообразный видовой набор растительных объектов и микроорганизмов. Культуры клеток (тканей) получали из бобовых, злаковых, овощных и других экономически важных растений, в том числе — продуцентов природных веществ. Микроорганизмы представлены в основном азотфиксирующими формами, среди которых симбиотические (клубеньковые) и свободноживущие (Azotobacter, Azospirillum) бактерии, а также несимбиотические цианобактерии. Кроме того, для получения ассоциаций с каллусными культурами использовали зеленую водоросль Chlorella и разные виды грибов. Цели создания ассоциаций с отдельными микроорганизмами существенно различаются так же, как и критерии, на основе которых оценивается возникновение ассоциативных взаимодействий в системах. Общим принципом для создания ассоциаций является совместное культивирование клеток и каллусных тканей растений с микроорганизмами. При этом способы введения микроорганизмов в систему для совместного выращивания могут быть разными: внесение клеток микроорганизмов непосредственно в каллусную или суспензионную культуру растения (смешанные культуры); высев на поверхность агаризованной среды рядом с каллусом таким образом, чтобы рост микроорганизмов происходил без соприкосновения (совместные культуры); разделение бактериальных клеток и клеток суспензионной или каллусной культуры специальными фильтрами (мембранами), обеспечивающими обмен продуктами метаболизма, но не допускающими контактов между клетками партнеров.Слайд 22 Ассоциации с клубеньковыми бактериями. Основная задача при получении
ассоциаций с клубеньковыми бактериями первоначально состояла в создании упрощенных
модельных систем для изучения симбиотических взаимоотношений бобового растения с клубеньковыми бактериями. Впервые каллусная ткань сои была инфицирована клетками Rhizobium, вызывающими лигнификацию и дифференцировку растительных клеток. Позже была получена ассоциация, в которой клубеньковые бактерии формировали подобие инфекционных нитеи и бактероиды в каллусных клетках сои. Цитологическое изучение показало сходство процессов инфицирования в искусственной ассоциации и при формировании корневого клубенька в целом растении. Бактерии инфицировали до 10% клеток каллуса, обнаруживаясь в цитоплазме в везикулах, образованных, очевидно, плазмалеммой растительной клетки. В клетке они размножались, заполняя цитоплазму и образуя бактероиды, как и в клубеньке растения. В ассоциации с каллусными клетками клубеньковые бактерии проявляли нитрогеназную активность (НГА), которая отсутствует у них в чистой культуре. Это свидетельствует об азотфиксации клубеньковыми бактериями в ассоциациях с каллусными клетками, которая составляла 1 % от активности азотфиксации в клубеньках растения. В последующих исследованиях была подтверждена индукция НГА у клубеньковых бактерий культурами клеток (тканей) бобовых растений. Существенными для понимания взаимодействия макро- и микроорганизма в природных симбиозах бобовых оказались сообщения об индукции НГА у Rhizobium тканевыми культурами небобовых растений —пшеницы, рапса, табака и других видов.Слайд 23 Таким образом, получение азотфикеирующих ассоциаций при взаимодействии клубеньковых
бактерий с клетками небобовых растений приводит к выводу о
принципиальной возможности распространения симбиоза с клубеньковыми бактериями на небобовые культуры. На этом основании различные комбинации эукариотных клеток и азотфиксирующих микроорганизмов могут быть использованы в экспериментах in vitro для выяснения высокой специфичности природных симбиозов и понимания причин, по которым симбиоз в природе избирательно возник только у некоторых групп растений.Слайд 24 Ассоциации с азотфиксирующими свободноживущими бактериями. Эксперименты по созданию
ассоциаций культур клеток (тканей) бобовых и небобовых растений с
симбиотическими (клубеньковыми) бактериями послужили основой для получения ассоциаций с несимбиотическими азотфиксаторами — бактериями родов Azotobacter и Azospirillum. При создании искусственных ассоциаций на основе культур растительных тканей ставилась задача получить эффективные азотфиксирующие системы, растущие на среде без связанного азота, с перспективой регенерации растений. В этих целях использовали сочетания культур растительных тканей с бактериями A. vinelandii и A. brasilense. Была обнаружена видовая специфичность растительных клеток в формировании ассоциаций с этими бактериями. Каллусные культуры табака, проса и Eremochloa ophiuroides не выживали при инокуляции их Azospirillum. Каллусные культуры быстро «обрастали» бактериями, погибая через 4 недели после инокуляции. Напротив, при инокуляции той же бактерией ткани сахарного тростника была получена ассоциация, которую удалось субкультивировать на протяжении 18 мес. Стабильная ассоциация формировалась только на среде с низким содержанием связанного азота или полностью лишенной его.Бактерии проявляли НГА независимо от того, формировали они ассоциации с растительными тканями или последние погибали.
Слайд 25 Как Azotobacter, так и Azospirillum в соответствующих ассоциациях
были локализованы на поверхности или в межклетниках каллусной ткани
и никогда не проникали в живые растительные клетки.Попытка регенерации растений из ассоциации каллуса моркови с Azotobacter была неудачной. В ассоциации ткани сахарного тростника и Azospirillum при инкубации на свету были регенерированы зеленые побеги, которые не отличались от побегов, полученных в контрольной каллусной культуре. Они были способны к формированию корней и росту в почве. Однако ни в побегах, ни в корнях бактериальные клетки не обнаруживались. Не- возможность проникновения бактерий в побеги в процессе органогенеза в смешанной культуре связывают с анатомическими особенностями каллуса сахарного тростника. Данная каллусная культура имеет очень уплотненные области, характеризующиеся отсутствием межклетников. Рост бактерий происходит в поверхностных участках каллусных агрегатов, что сопровождается отмиранием растительных клеток. Благодаря отсутствию межклетников бактерии не проникают в глубь этих агрегатов, где сохраняется жизнеспособная растительная ткань. Образование меристемоидов происходит в уплотненных участках каллуса, лишенных межклетников, что препятствует включению бактерий в формирующиеся побеги.
Слайд 26 Ассоциация с зеленой водорослью. Инокуляция каллуса моркови одним
из штаммов Chlorella и культивирование системы на дефицитной по
азоту среде на свету приводила к выживанию каллуса в течение нескольких месяцев, в то время как контрольный каллус погибал. Клетки водоросли росли на поверхности каллуса и проникали в межклетники. В инокулированном каллусе обнаружен высокий процент интактных клеток, и большинство из них, очевидно, были живыми. Клетки другого штамма водоросли не росли совместно с каллусом, и в их присутствии обнаружена очень низкая доля интактных клеток моркови. На основании проведенных экспериментов сделан вывод об обеспечении клеток моркови азотистыми веществами, поступающими от водоросли, при культивировании системы на среде с дефицитом азота.Ассоциации с грибами. Способ совместного культивирования ткани руты с различными грибами был применен в качестве нового, нетрадиционного подхода к повышению биосинтеза видоспецифических продуктов, образуемых растительными клетками in vitro (В. Wolters, U. Eilert, 1982). Совместную культуру получали таким образом, чтобы каллус и мицелий гриба не соприкасались, т. е. на биосинтез влияли диффундирующие через агар выделения гриба.





























