Слайд 2
План лекции
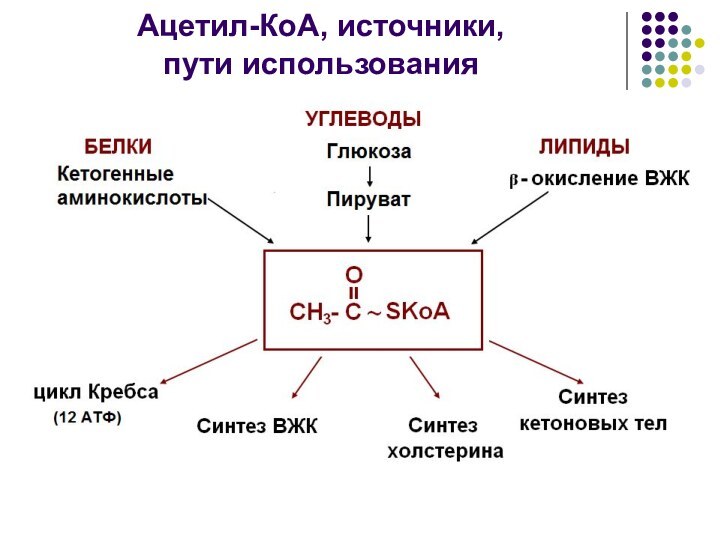
Ацетил-КоА, источники, пути использования
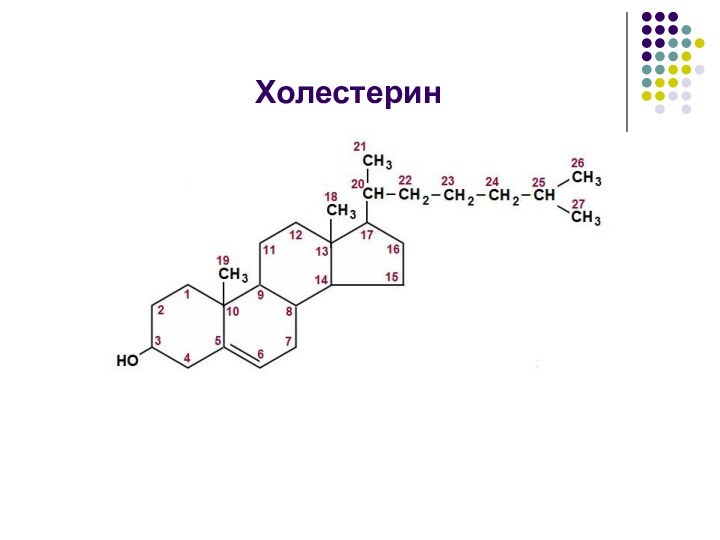
Обмен холестерина
Источники холестерина
Биологическая роль
Биосинтез
холестерина
Выведение холестерина
Кетоновые тела, биосинтез кетоновых тел
Нарушения липидного обмена
Нарушения обмена
холестерина
Жировое перерождение печени
Ожирение
Нарушение обмена липопротеинов
Болезни накопления липидов (липидозы)
Биологические мембраны, строение, роль
Перекисное окисление липидов (ПОЛ)
Слайд 3
Ацетил-КоА, источники,
пути использования
Слайд 5
Переваривание экзогенного холестерина
Холестерин поступает с пищей в виде
свободного или связанного (в виде холестерида – эфира холестерина)
Свободный
холестерин в ЖКТ не переваривается
Связанный холестерин переваривается в тонком кишечнике по следующей схеме
Эфир холестерина холестролэстераза холестерин + ВЖК
Холестерин всасывается в тонком кишечнике в виде холеиновых комплексов
Слайд 6
Транспортные формы холестерина
ЛПНП (β-липопротеины)
ЛПОНП (пре-β-липопротеины)
ЛПНП+ЛПОНП - атерогенные
липопротеины
ЛПВП (альфа- ЛП) - антиатерогенные
липопротеины
Слайд 7
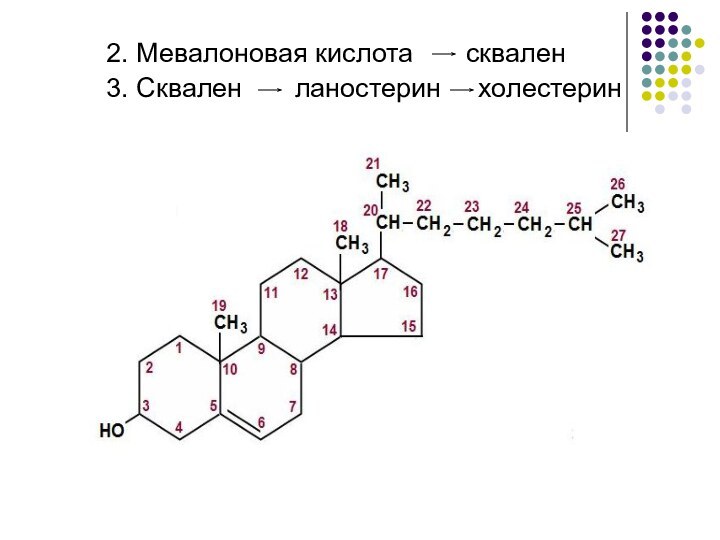
Биосинтез холестерина
За сутки синтезируется 0,3 – 0,5 г
до 1 г/сут эндогенного холестерина:
80% в печени
10 % в
клетках кишечника
5 % в коже
Условно в биосинтезе холестерина можно выделить 3 стадии:
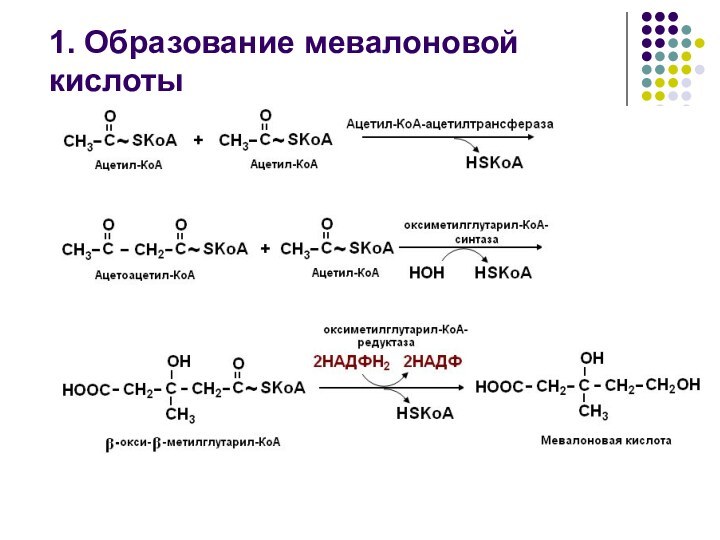
превращение Ацетил-КоА в мевалоновую кислоту
образование из мевалоновой кислоты сквалена
циклизация сквалена в холестерин
Слайд 8
1. Образование мевалоновой кислоты
Слайд 9
2. Мевалоновая кислота сквален
3. Сквален
ланостерин холестерин
Слайд 10
Регуляция биосинтеза холестерина
Биосинтез холестерина регулируется по принципу отрицательной
обратной связи: чем больше в организм человека поступает экзогенного
холестерина, тем меньше синтезируется эндогенного.
Лимитирующей скорость биосинтеза холестерина в организме является
ОМГ-КоА-редуктазная реакция, она необратимая.
Экзогенный холестерин угнетает фермент ОМГ-КоА-редуктазу.
Слайд 11
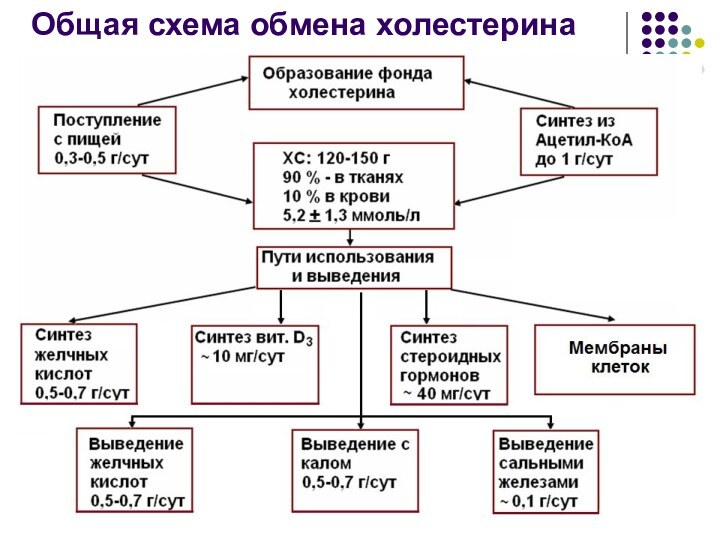
Выведение холестерина
Ежедневно из организма человека выводится около 1,0
г холестерина:
Около 50 % с калом в виде желчных
кислот
Около 50 % с калом в виде копростанола, который образуется в толстом кишечнике под воздействием микрофлоры
0,1 г/сут сальными железами
Слайд 12
Общая схема обмена холестерина организме
Слайд 14
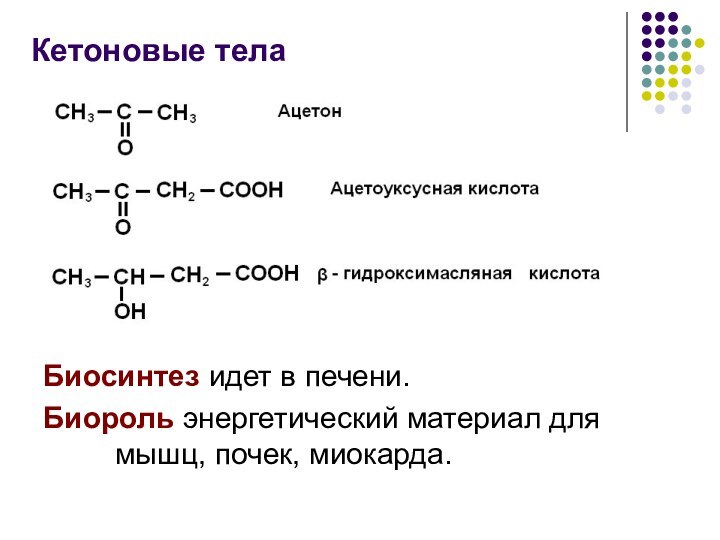
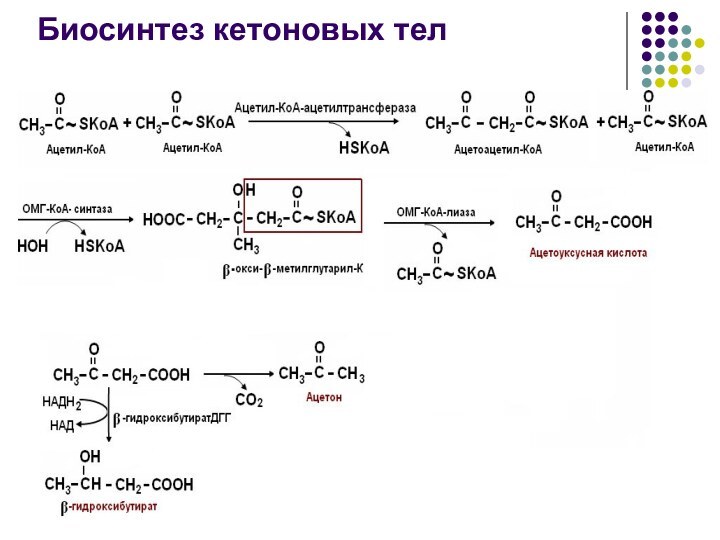
Кетоновые тела
Биосинтез идет в печени.
Биороль энергетический материал для
мышц, почек, миокарда.
Слайд 16
В крови здорового человека кетоновые тела содержатся в
очень небольших концентрациях
Кетонемия – повышение уровня кетоновых тел
в крови (голодание, сахарный диабет). При этом скорость образования кетоновых тел превышает способность периферических тканей их утилизировать.
Кетонурия – появление кетоновых тел в моче вследствие кетонемии.
Слайд 17
Нарушения липидного обмена
1. Нарушения обмена холестерина
Атеросклероз
Атеросклероз – накопление
холестерина и его эфиров в интиме сосудов. (В первую
очередь артерий).
Начальным, пусковым механизмом развития атеросклероза является проникновение атерогенных липопротеинов (ЛПОНП и ЛПНП) через эндотелий сосудов в субэндотелиальное пространство.
Слайд 18
Лабораторный контроль атеросклероза осуществляется по следующим показателям:
Гиперхолестеринемия;
Увеличение содержания
атерогенных липопротеинов (ЛПНП+ЛПОНП)
Рост коэффициента атерогенности больше 4
ЛПНП+ЛПОНП
ЛПВП
(в норме этот показатель меньше 4)
Снижение содержания антиатерогенных липопротеинов (ЛПВП);
Снижение содержания фосфолипидов
Слайд 19
2. Жировое перерождение печени
Из-за недостатка холина, метионина, незаменимых
ВЖК, витаминов В3 и В6 может возникнуть метаболический блок
образования фосфолипидов и, как следствие, липопротеинов плазмы крови. Это приводит к увеличению содержания свободных ВЖК в крови, их постепенному накоплению в тканях, в особенности в печени. При этом печень теряет свою основную функцию – обезвреживающую.
Слайд 20
3. Ожирение – чрезмерное накопление нейтрального (резервного) жира.
Причины:
Чрезмерное
питание, в особенности углеводами;
Эндокринные заболевания;
Наследственная патология
Слайд 21
4. Нарушение обмена липопротеинов
Наследственные заболевания, приводящие к
гиперлипопротеинемии или гиполипопротеинемии
Гиперлипопротеинемии:
I тип. Гиперхиломикронемия. Характеризуется медленным выведением ХМ,
которые постепенно накапливаются в крови. Резко увеличивается в крови концентрация триглицеридов.
Слайд 22
II тип. Гипер-β-липопротеинемия.
IIа – характеризуется увеличением в
крови преимущественно ЛПНП
IIб – характеризуется одновременным увеличением в крови
ЛПНП и ЛПОНП.
При этом типе значительно возрастает концентрация холестерина в крови, что увеличивает вероятность развития атеросклероза
Слайд 23
III тип. Дис-β-липопротеинемия.
Характеризуется появлением в крови липопротеинов с
необычно высоким содержанием холестерина. Такие липопротеины накапливаются в крови
вследствие нарушения превращения ЛПОНП в ЛПНП
IV тип. Гиперпре- β-липопротеинемия.
Характеризуется значительным ростом ЛПОНП при нормальном содержании в крови ЛПНП. При этом уровень холестерина повышен незначительно.
V тип. Гиперпре- β-липопротеинемия и хиломикронемия.
Характеризуется одновременным ростом в крови содержания ЛПОНП и ХМ
Слайд 24
Болезни накопления липидов (Липидозы)
Сфинголипидозы – в тканях, в
особенности в нервной, накапливаются сфинголипиды.
При этом нарушен распад
запасаемых липидов, тогда как скорость биосинтеза сфинголипидов сравнима со скоростью биосинтеза их у здоровых людей
Слайд 25
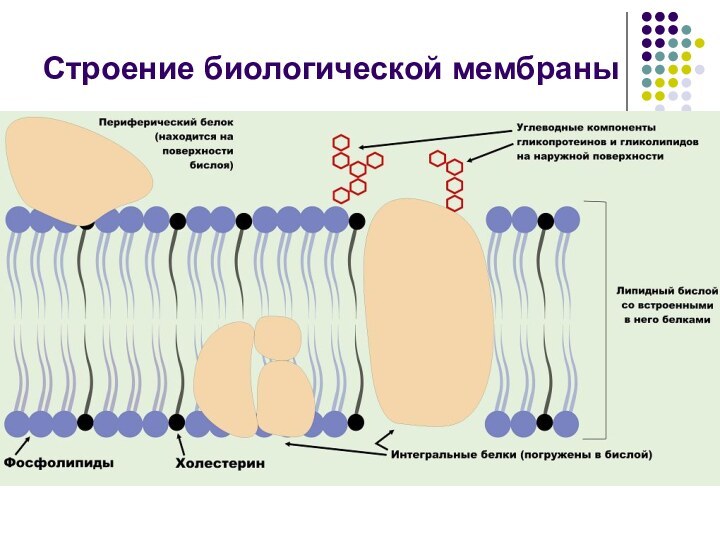
Биологические мембраны
Вязкие, пластичные структуры, окружающие все живые клетки
Мембраны
обладают избирательной проницаемостью и являются барьером, с помощью которого
поддерживается различный химический состав вне- и внутриклеточной среды.
В мембранах локализованы ферменты, обеспечивающие ответ на нервное возбуждение и ферменты, участвующие в преобразовании энергии в клетке.
Слайд 26
Строение биологической мембраны
Слайд 27
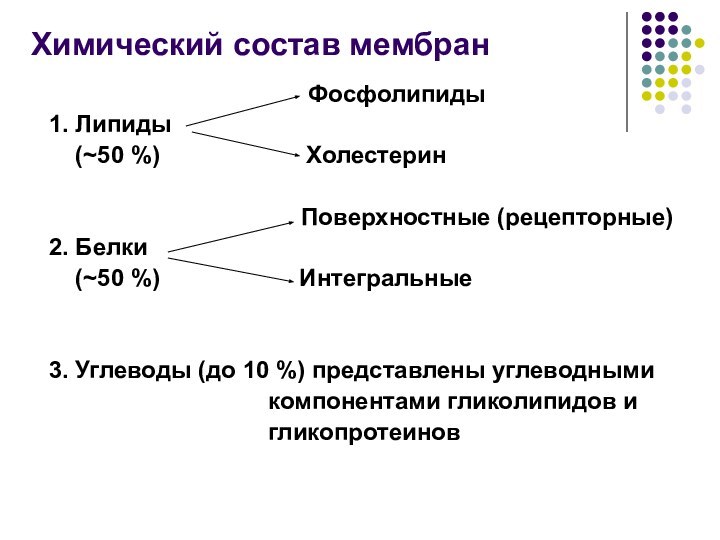
Химический состав мембран
Фосфолипиды
1. Липиды
(~50 %) Холестерин
Поверхностные (рецепторные)
2. Белки
(~50 %) Интегральные
3. Углеводы (до 10 %) представлены углеводными
компонентами гликолипидов и
гликопротеинов
Слайд 28
В различных мембранах различное соотношение белки/липиды
Мембрана миелинового
волокна – 0,23
Мембрана эритроцита – 1,1
Мембрана саркоплазматического ретикулума –
2,0
Внутренняя митохондриальная мембрана – 3,2
Слайд 29
Факторы, определяющие скорость диффузии веществ через мембраны
Трансмембранный концентрационный
градиент веществ;
Трансмембранная разность электрических потенциалов;
Коэффициент проницаемости мембраны для данного
вещества;
Градиент гидростатического давления на мембране;
Температура.
Слайд 30
Перекисное окисление липидов (ПОЛ)
ПОЛ – цепная реакция, обеспечивающая
расширенное воспроизводство свободных радикалов, которые инициируют дальнейшее распространение ПОЛ.
R*
+ O2 ROO* + RH ROOH + R* и т.д.
Слайд 31
Повреждающее действие на липиды мембран оказывают свободные радикалы
(ROO*, RO*, OH*), которые образуются под действием активных форм
кислорода
ОН* – гидроксильный радикал;
Оˉ2 – супероксиданион
Н2О2 – гидроперекись
Наиболее чувствительны к действию активных форм кислорода полиеновые жирные кислоты, локализованные преимущественно в фосфолипидах биологических мембран
Слайд 32
Механизмы токсического действия ПОЛ
В клетке возрастает концентрация Са
++. При этом Na+ и Н2О поступают в клетку
и субклеточное пространство, что приводит к набуханию и разрушению клетки.
Свободные радикалы проникая в ядро и митохондрии клетки повреждают молекулы ДНК, что может привести к мутациям.
Образующийся при ПОЛ малоновый диальдегид
вызывает в мембранах денатурацию белков.
Слайд 33
Регулирование процессов ПОЛ
Используются антиоксиданты, вещества, снижающие повреждающий эффект
ПОЛ на биологические мембраны и уменьшающие скорость инициации данной
реакции
Ферменты (каталаза, пероксидаза, супероксиддисмутаза,
глутатионредуктаза);
Витамины (Е – токоферол,
С – аскорбиновая кислота)
Провитамины (каротин)
Фенолы. Ароматические амины