- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Полимеразная цепная реакция
Содержание
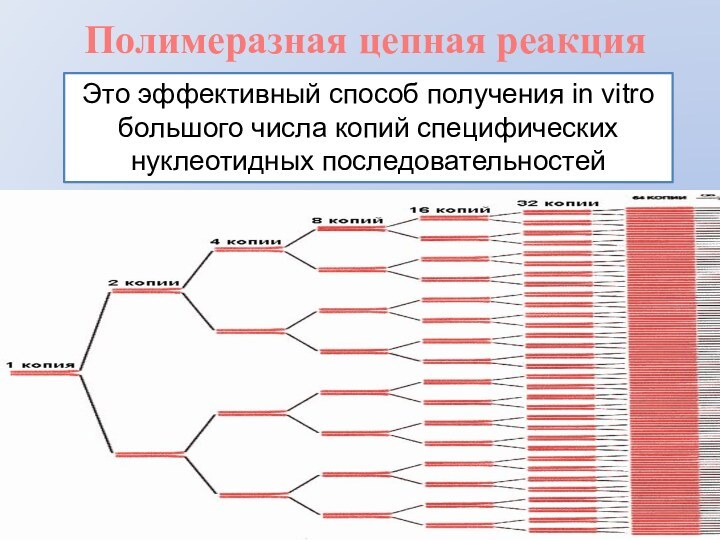
- 2. Полимеразная цепная реакцияЭто эффективный способ получения in vitro большого числа копий специфических нуклеотидных последовательностей
- 3. Полимеразная цепная реакцияМетод ферментативной наработки in vitro
- 4. Изобретение ПЦРВ 1983 г. химик компании Cetus,
- 5. ПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое
- 6. Для ПЦР необходимы: ДНК-матрица, содержащая тот
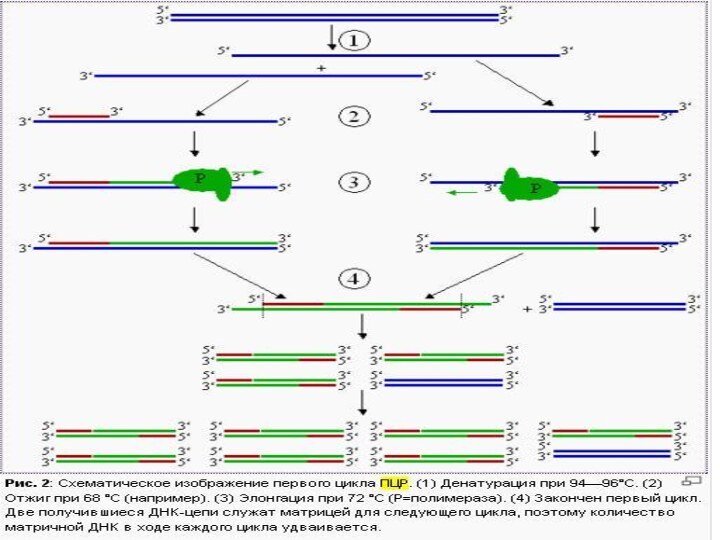
- 7. ПЦР осуществляется в ходе трехэтапного циклического процесса:ДенатурацияРенатурацияСинтез
- 9. ДенатурацияДвухцепочечную ДНК-матрицу нагревают до 94—96°C (или до
- 10. Ренатурация (Отжиг)Когда цепи разошлись, температуру понижают, чтобы
- 11. Синтез (Элонгация)ДНК-полимераза реплицирует матричную цепь, используя праймер
- 12. Состав реакционной смесиИсследуемая ДНКДНК-зависимая-ДНК-полимеразаДезоксирибонуклеотидтрифосфаты (dNTP)ДНК-затравки (праймеры)Интеркалирующих краситель
- 13. Полимеразная цепная реакция с возможностью детекции продукта в реальном времени (RT-PCR).Секвенирование по Сенгеру
- 26. Технология «ПЦР-чип»Анализ экспрессии 84 генов за один раз
- 28. Постгеномная Эра26 июня 2000 года было объявлено
- 29. Контроль качества ПЦРПроверка соответствия праймеров рекомендуемым параметрам,
- 30. Рекомендуемые параметры праймеров:Длина 18-22 осн.Температура плавления 52-60˚ССодержание
- 31. Рекомендуемые параметры праймеров:Повторы:не более 4 динуклеотидных повтораНе
- 32. Контроль качества выделенной РНКОсновной критерий – при
- 33. Различия в коэффициетах αα – это коэфициент
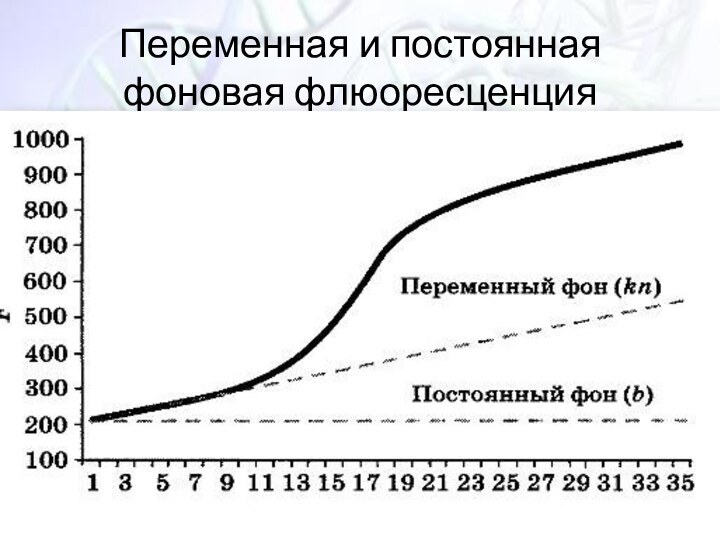
- 34. Переменная и постоянная фоновая флюоресценция
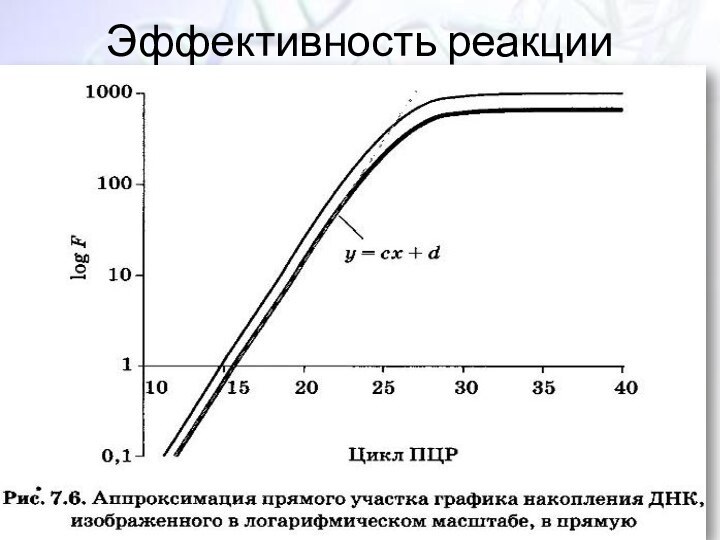
- 35. Эффективность реакции
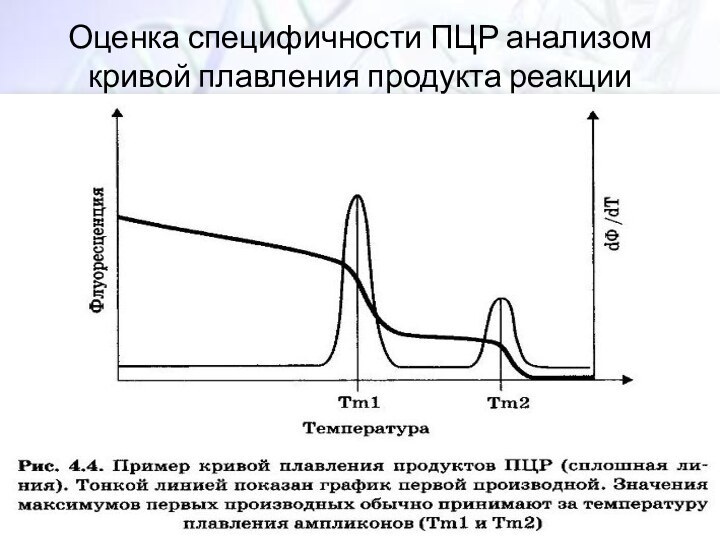
- 36. Оценка специфичности ПЦР анализом кривой плавления продукта реакции
- 37. ПЦР «в реальном времени»ЦиклыФлуоресценцияПороговый цикл (Сt)
- 38. Анализ содержания ГМО в продуктах питания;Установление отцовства;Криминалистика:«Генетические
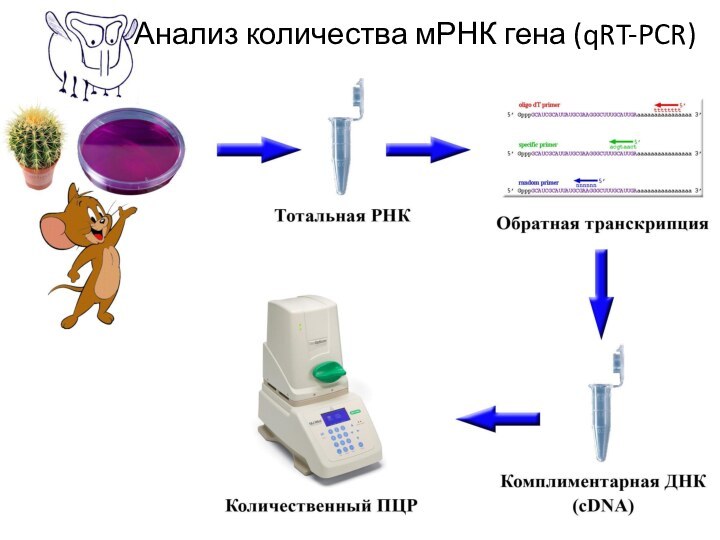
- 39. Анализ количества мРНК гена (qRT-PCR)
- 40. Применение ПЦР:КРИМИНАЛИСТИКАУСТАНОВЛЕНИЕ ОТЦОВСТВАМЕДИЦИНСКАЯ ДИАГНОСТИКАКЛОНИРОВАНИЕ ГЕНОВМУТАГЕНЕЗ
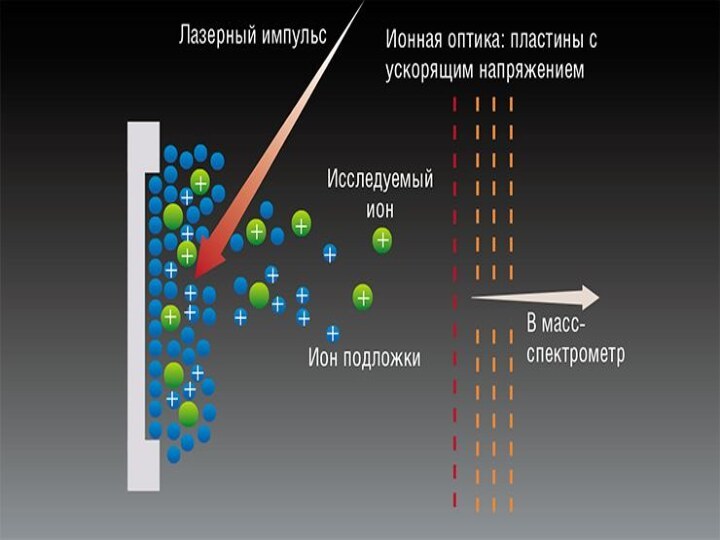
- 41. MALDI
- 42. Матрично-активированная лазерная десорбция/ионизацияМАЛДИ — (от англ. MALDI,
- 43. Что такое матрица?Матрица представляет собой материал, свойства
- 44. Считается, что вещество, используемое в качестве матрицы,
- 46. Немного истории Впервые возможность применения матрицы для подавления
- 47. Схематическое представление механизма МАЛДИ
- 49. Применение MALDI Диапазон применения МАЛДИ достаточно широк и
- 51. МАЛДИ масс-спектрометрия в медицине С конца 2000-х технология
- 52. Применение метода позволило значительно сократить затраты и
- 53. Скачать презентацию
- 54. Похожие презентации







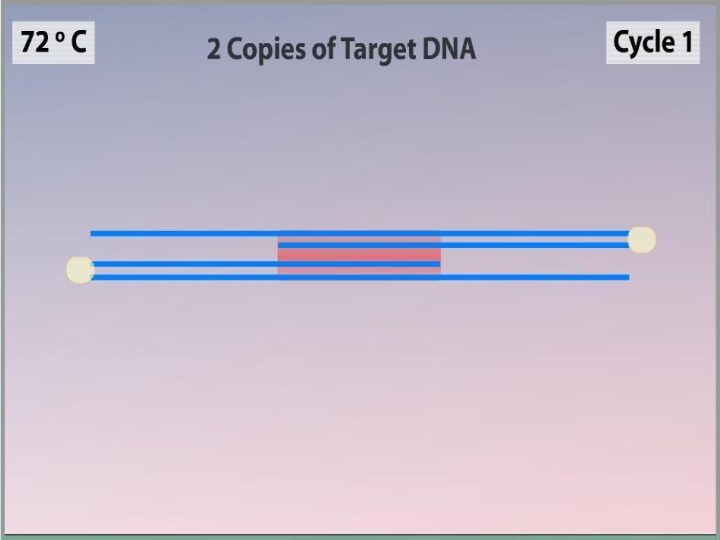

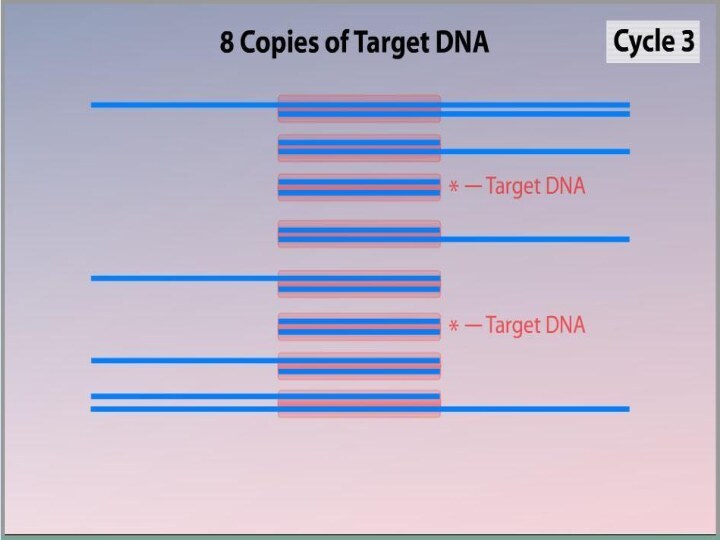















Слайд 3
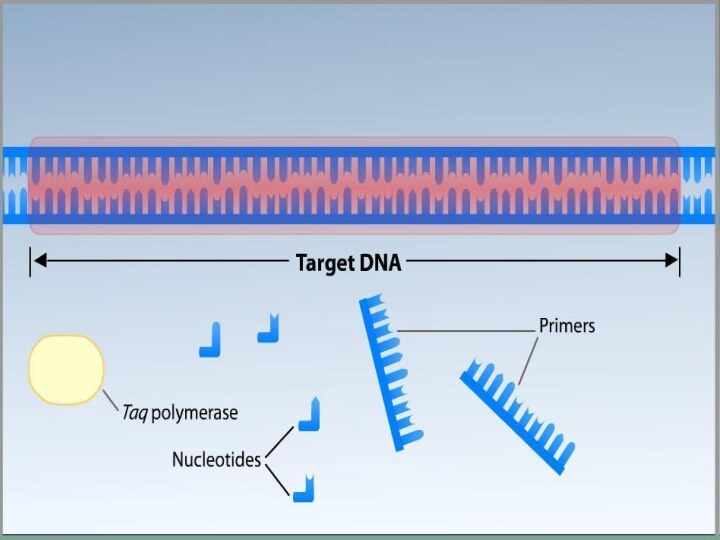
Полимеразная цепная реакция
Метод ферментативной наработки in vitro определённых,
сравнительно коротких (до нескольких тысяч пар нуклеотидов), двуцепочечных фрагментов
ДНК.В основе реакции лежит механизм репликации молекул ДНК ферментом ДНК-полимеразой.
Слайд 4
Изобретение ПЦР
В 1983 г. химик компании Cetus, Кэри
Маллис, оптимизируя метод олигомерной рестрикции для идентификации точечных мутаций
в ДНК, придумал как многократно увеличить количество копий определённого участка ДНК.Kary Mullis, Лауреат Нобелевской
премии 1993 г. по химии
Слайд 5 ПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое охлаждение
и нагревание пробирок, обычно с точностью не менее 0,1 °C.
Современные амплификаторы позволяют задавать сложные программы, в том числе с возможностью «горячего старта», Touchdown ПЦР и последующего хранения амплифицированных молекул при 4 °C.
Амплификатор
Слайд 6
Для ПЦР необходимы:
ДНК-матрица, содержащая тот участок
ДНК, который требуется амплифицировать.
Два праймера, комплементарные противоположным
концам разных цепей требуемого фрагмента ДНК.Термостабильная ДНК-полимераза — фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов — Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfu-полимераза), Pyrococcus woesei (Pwo-полимераза) и другие.
Дезоксинуклеозидтрифосфаты (dATP, dGTP, dCTP, dTTP).
Слайд 9
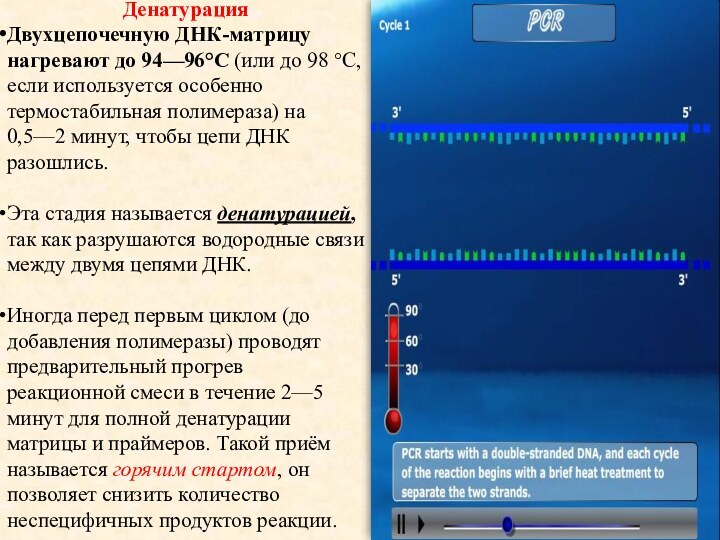
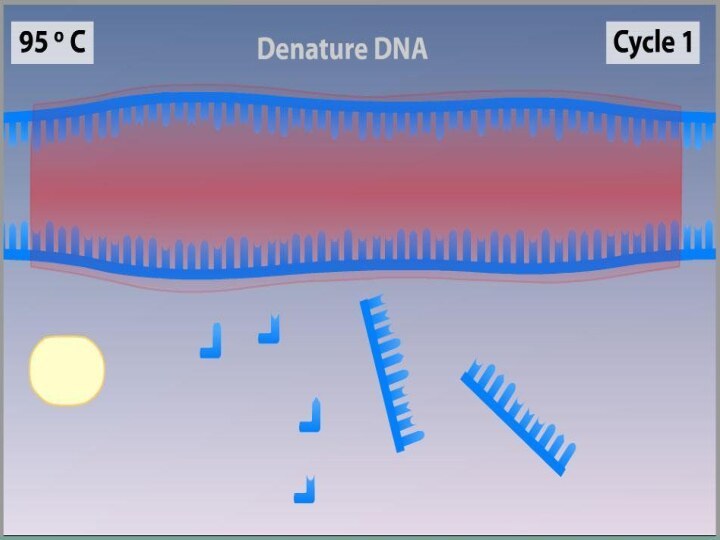
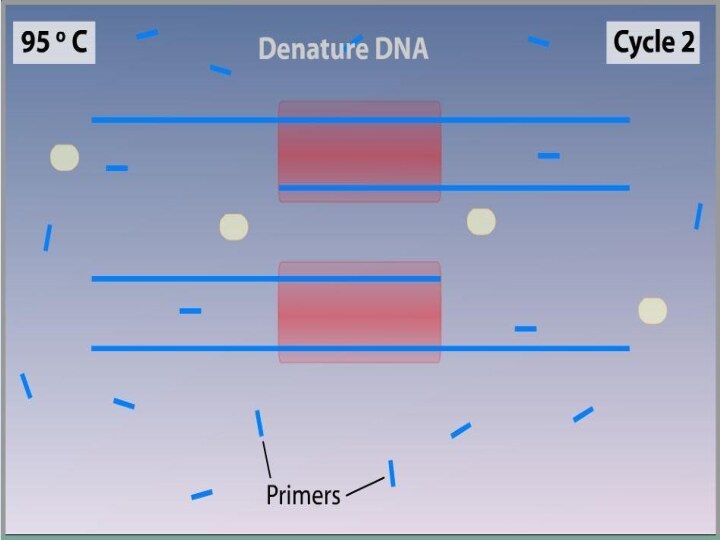
Денатурация
Двухцепочечную ДНК-матрицу нагревают до 94—96°C (или до 98 °C,
если используется особенно термостабильная полимераза) на 0,5—2 минут, чтобы
цепи ДНК разошлись.Эта стадия называется денатурацией, так как разрушаются водородные связи между двумя цепями ДНК.
Иногда перед первым циклом (до добавления полимеразы) проводят предварительный прогрев реакционной смеси в течение 2—5 минут для полной денатурации матрицы и праймеров. Такой приём называется горячим стартом, он позволяет снизить количество неспецифичных продуктов реакции.
Слайд 10
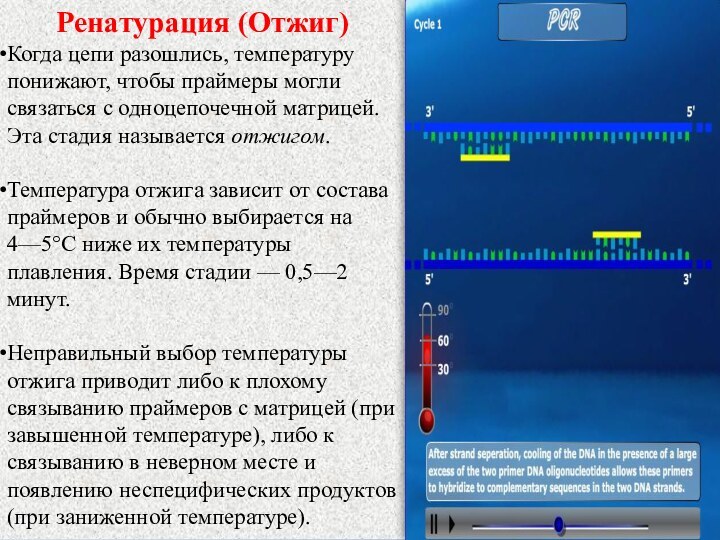
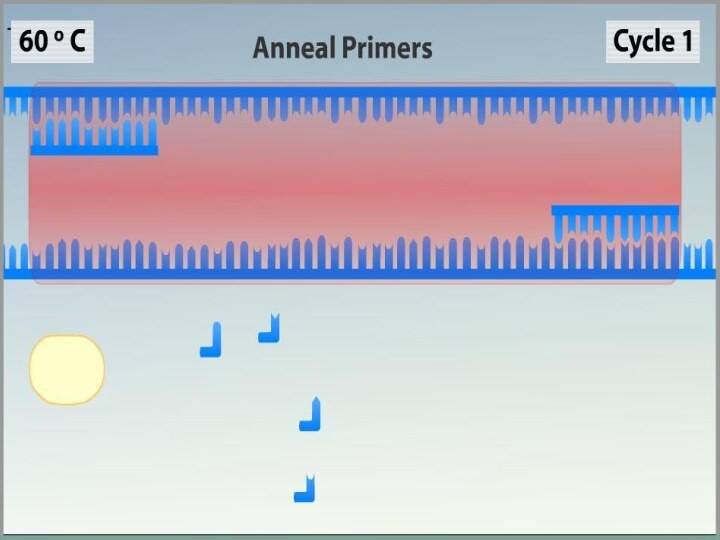
Ренатурация (Отжиг)
Когда цепи разошлись, температуру понижают, чтобы праймеры
могли связаться с одноцепочечной матрицей. Эта стадия называется отжигом.
Температура отжига зависит от состава праймеров и обычно выбирается на 4—5°С ниже их температуры плавления. Время стадии — 0,5—2 минут.
Неправильный выбор температуры отжига приводит либо к плохому связыванию праймеров с матрицей (при завышенной температуре), либо к связыванию в неверном месте и появлению неспецифических продуктов (при заниженной температуре).
Слайд 11
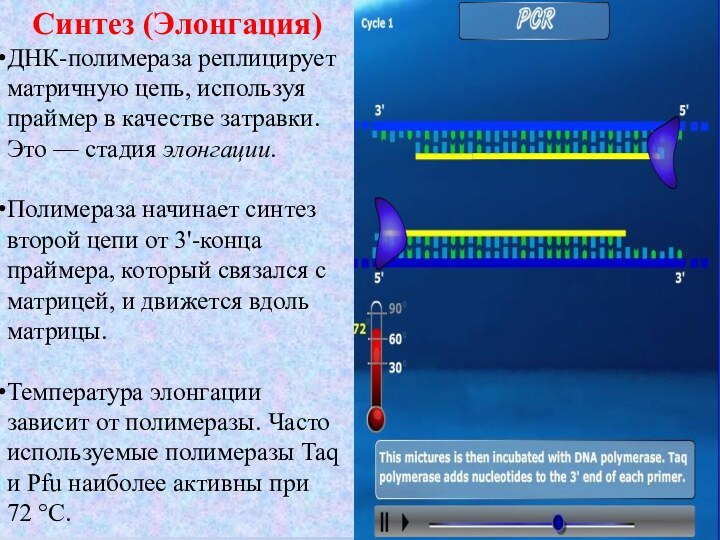
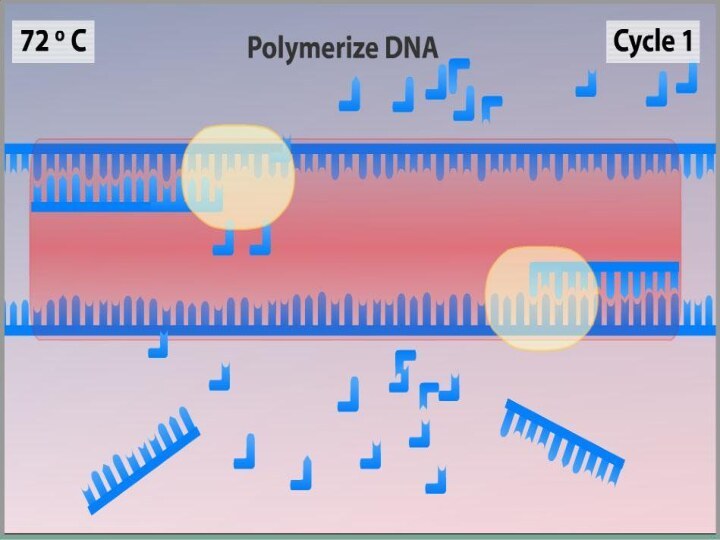
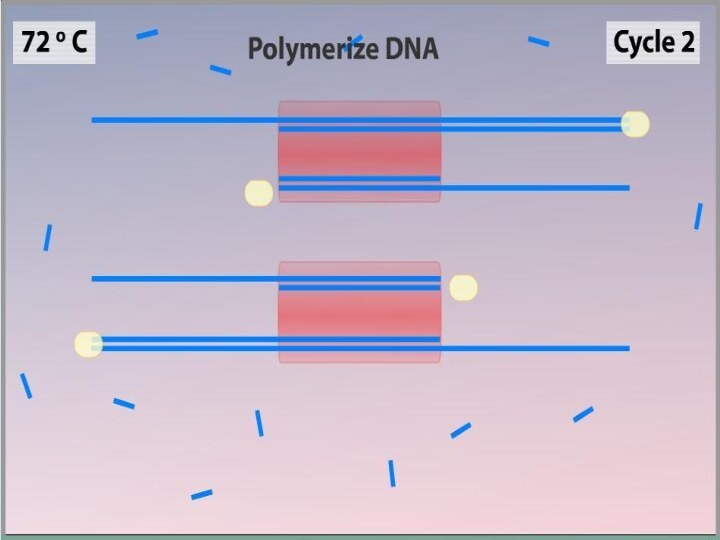
Синтез (Элонгация)
ДНК-полимераза реплицирует матричную цепь, используя праймер в
качестве затравки. Это — стадия элонгации.
Полимераза начинает синтез второй
цепи от 3'-конца праймера, который связался с матрицей, и движется вдоль матрицы.Температура элонгации зависит от полимеразы. Часто используемые полимеразы Taq и Pfu наиболее активны при 72 °C.
Слайд 12
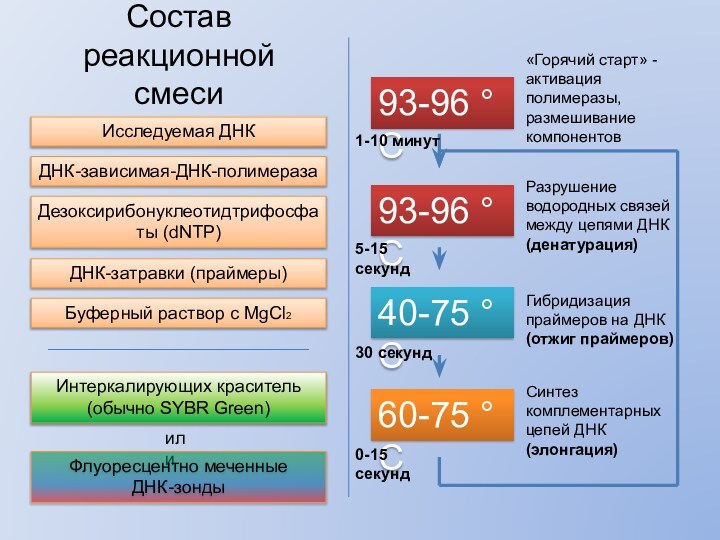
Состав реакционной смеси
Исследуемая ДНК
ДНК-зависимая-ДНК-полимераза
Дезоксирибонуклеотидтрифосфаты (dNTP)
ДНК-затравки (праймеры)
Интеркалирующих краситель (обычно
SYBR Green)
или
Флуоресцентно меченные
ДНК-зонды
Разрушение водородных связей между цепями ДНК
(денатурация)
93-96
°С40-75 °С
Гибридизация праймеров на ДНК
(отжиг праймеров)
60-75 °С
Синтез комплементарных цепей ДНК
(элонгация)
Буферный раствор с MgCl2
93-96 °С
«Горячий старт» - активация полимеразы, размешивание компонентов
5-15 секунд
1-10 минут
30 секунд
0-15 секунд
Слайд 13 Полимеразная цепная реакция с возможностью детекции продукта в
реальном времени (RT-PCR).
Секвенирование по Сенгеру
Слайд 28
Постгеномная Эра
26 июня 2000 года было объявлено о
расшифровке генома человека.
На данный момент известны геномы множества организмов.
Геном
человека, других организмов, последовательности отдельных генов находятся в свободном доступе в интернете.Коммерческий синтез олигонуклеотидов качественен, быстр и доступен по цене.
Всё это предоставляет современным исследователям
огромное, неизведанное поле для творчества,
базовыми инструментами в котором являются
ПЦР и секвенирование, в различных модификациях.
Слайд 29
Контроль качества ПЦР
Проверка соответствия праймеров рекомендуемым параметрам, при
их дизайне;
Подбор стабильного референсного гена;
Контроль качества и количества выделенной
нуклеиновой кислоты;Контроль эффективности обратной транскрипции;
Контроль наличия геномной ДНК в РНК-пробе;
Отрицательный контроль (загрязнение растворов);
Контроль параметров E и α;
Оценка специфичности ПЦР анализом кривой плавления продукта реакции;
Калибровка инструмента, при необходимости нормализация по ROX.
Слайд 30
Рекомендуемые параметры праймеров:
Длина 18-22 осн.
Температура плавления 52-60˚С
Содержание GC:
40-60%
Вторичные структуры:
Шпильки: ΔG>-2 ккал/моль на 3’-конце и ΔG>-3 ккал/моль
- внутренниеГомодимеры: ΔG>-5 ккал/моль
Гетеродимеры: ΔG>-5 ккал/моль
Слайд 31
Рекомендуемые параметры праймеров:
Повторы:
не более 4 динуклеотидных повтора
Не более
4 одинаковых нуклеотидов подряд
Повторы:
Минимум G/C на 3' конце праймеров
(не более трех из пяти последних нуклеотидов)Отсутствие кросс-гомологичности к другим последовательностям в геноме объекта (проверяется в системе BLAST).
Слайд 32
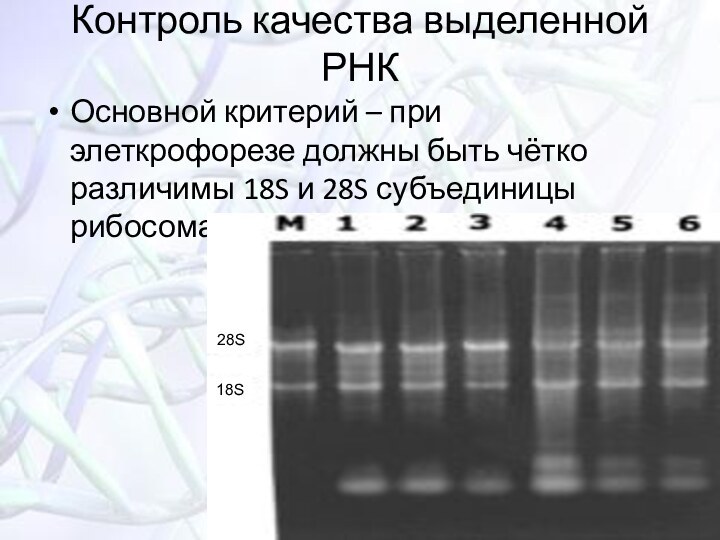
Контроль качества выделенной РНК
Основной критерий – при элеткрофорезе
должны быть чётко различимы 18S и 28S субъединицы рибосомальной
РНК!28S
18S
Слайд 33
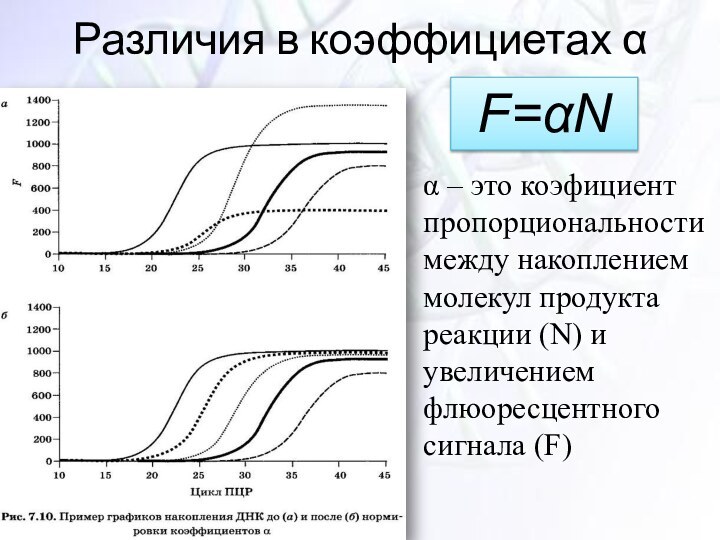
Различия в коэффициетах α
α – это коэфициент пропорциональности
между накоплением молекул продукта реакции (N) и увеличением флюоресцентного
сигнала (F)F=αN
Слайд 38
Анализ содержания ГМО в продуктах питания;
Установление отцовства;
Криминалистика:
«Генетические отпечатки
пальцев»;
В медицине:
Диагностика наследственных заболеваний;
Диагностика инфекционных заболеваний;
Контроль эффективности лечения;
Персонализированная медицина.
Прикладное
применение ПЦР
Слайд 40
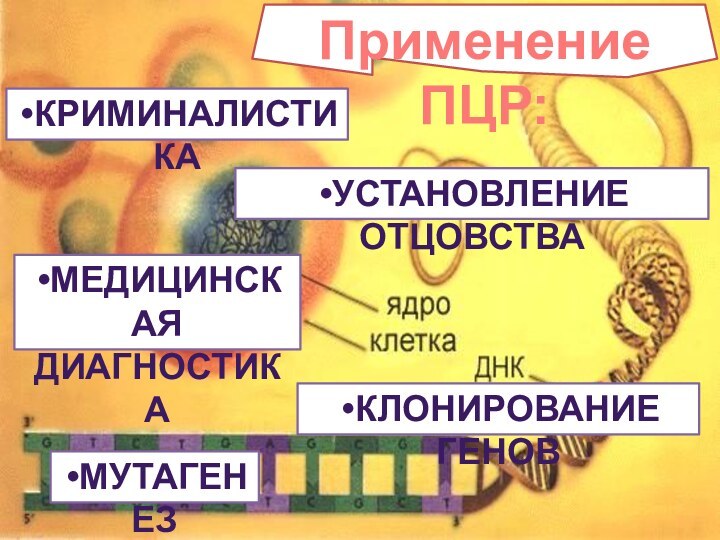
Применение ПЦР:
КРИМИНАЛИСТИКА
УСТАНОВЛЕНИЕ ОТЦОВСТВА
МЕДИЦИНСКАЯ
ДИАГНОСТИКА
КЛОНИРОВАНИЕ ГЕНОВ
МУТАГЕНЕЗ
Слайд 42
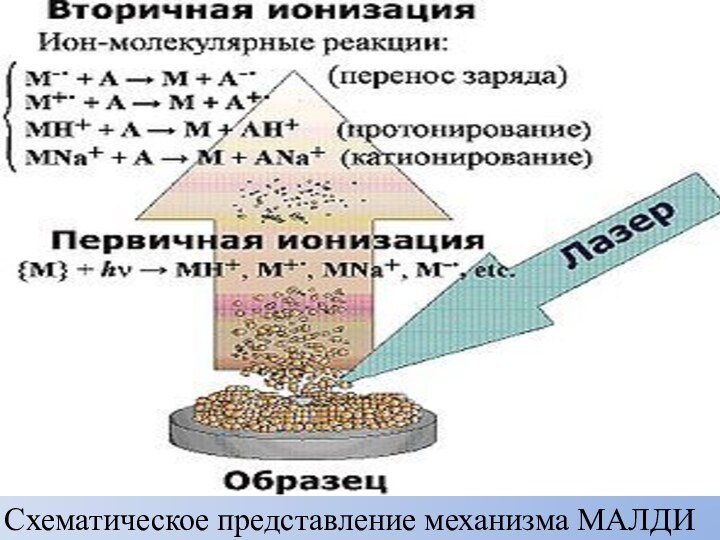
Матрично-активированная лазерная десорбция/ионизация
МАЛДИ — (от англ. MALDI, Matrix
Assisted Laser Desorption/Ionization) — десорбционный метод «мягкой» ионизации, обусловленной
воздействием импульсами лазерного излучения на матрицу с анализируемым веществом.
Слайд 43
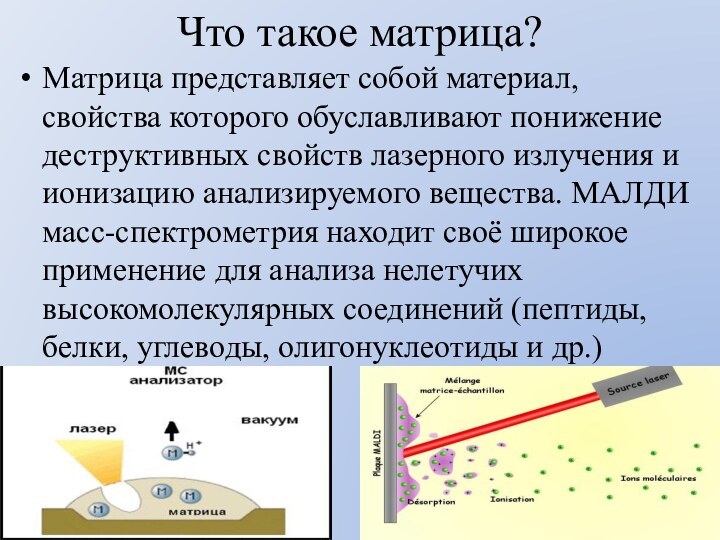
Что такое матрица?
Матрица представляет собой материал, свойства которого
обуславливают понижение деструктивных свойств лазерного излучения и ионизацию анализируемого
вещества. МАЛДИ масс-спектрометрия находит своё широкое применение для анализа нелетучих высокомолекулярных соединений (пептиды, белки, углеводы, олигонуклеотиды и др.)Слайд 44 Считается, что вещество, используемое в качестве матрицы, должно
отвечать следующим основным требованиям:
1) обладать высоким коэффициентом экстинкции при
длине волны лазерного излучения;2) иметь способность к ионизации нейтральных молекул анализируемого вещества путём переноса заряда или заряженной частицы;
3) обладать хорошей растворимостью в растворителях, применяемых в процессе пробоподготовки;
4) быть химически инертным по отношению к анализируемому веществу;
5) иметь низкую летучесть и термическую устойчивость.
Слайд 46
Немного истории
Впервые возможность применения матрицы для подавления фрагментации
при анализе нелетучих органических соединений на примере белков и
пептидов была продемонстрирована в 1987 году группой ученых в Германии (M. Karas and F. Hillenkamp). За открытие метода МАЛДИ японский инженер Коити Танака известной японской приборостроительной корпорации Shimadzu получил в 2002 году Нобелевскую премию.Коити Танака со своей женой
Слайд 49
Применение MALDI
Диапазон применения МАЛДИ достаточно широк и охватывает
многие классы химических соединений:
Биоорганические соединения (пептиды, белки, олигонуклеотиды, олигосахариды
и т. п.);Синтетические полимеры;
Органические комплексные соединения;
Высокомолекулярные материалы;
Синтетические дендримеры;
Фуллерены и др.
Слайд 51
МАЛДИ масс-спектрометрия в медицине
С конца 2000-х технология MALDI-TOF
начала применяться в практической медицине для быстрой идентификации видовой
принадлежности.Идентификация микроорганизмов основывалась на получения общего масс-спектра белков в диапазоне 1000-10000 Dа и биоинформационного сравнения полученного спектра с базой данных рефренсных спектров.





























