- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Принципы генной инженерии микроорганизмов
Содержание
- 2. Вектор - молекула ДНК или РНК, состоящая
- 3. Можно выделить 2 группы маркерных генов, позволяющие
- 4. Типы векторов для введения гена в клеткуВекторами
- 5. Векторами для клонирования являются: Плазмиды – кольцевые
- 7. Космиды – векторы, объединяющие в себе свойства
- 8. В качестве примера рассмотрим процесс клонирования участка
- 10. Предположим, что в плазмиду необходимо встроить фрагмент,
- 11. Поскольку плазмиды со встроенным фрагментом являются целью
- 12. В результате этих действий выделяются колонии E.
- 13. Вирусы Есть вирусы, которые не ведут к
- 14. В последние годы сконструированы многочисленные "челночные" векторы
- 15. Существуют гибридные вектора, содержащие ДНК фага и
- 16. Вироиды Из всех известных в настоящее время
- 17. Каким образом вироиды продуцируют симптомы болезни в
- 18. Модель доменной структуры РНК вироида веретеновидности картофеля (А) и
- 19. При работе с вироидами получают 1-нитевую ДНК-
- 20. Транспозоны Транспозоны - сегменты ДНК, которые контролируют
- 21. «Прыжки» транспозонов придают причудливую окраску кукурузным початкам.
- 22. Оказалось, что гены, ассоциированные с регуляторными элементами,
- 23. Биологический смысл перемещения отдельных сегментов ДНК: -
- 24. У бактерий были обнаружены 2 класса подвижных
- 25. Поскольку подвижные гены могут перемещаться в пределах
- 26. Генетическая трансформация клеток бактерийВ настоящее время бактерия
- 28. Липополисахаридный слой внешней мембраны грамотрицательной бактерии стабилизирован
- 29. Обнаружено, что на инфекционность существенное влияние оказывает
- 30. Успешное проведение экспериментов на кишечной палочке стало
- 31. Чужеродные гены клонируют в так называемых челночных
- 32. Для конструирования рекомбинантной ДНК, содержащей в своем
- 33. Однако удобнее встраивать ген в специальный вектор
- 34. В качестве примера маркирования вектора могут служит
- 35. Конструирование рекомбинантных ДНКПод рекомбинантными понимают ДНК, образованные
- 36. Сшивка по одноименным "липким" концам (рестриктазно лигазный
- 37. Но любые два фрагмента (независимо от их
- 38. Сшивка по "тупым" концам (коннекторный метод) Липкие
- 39. Если к 3'-концам одного из рекомбинируемых in
- 40. Поскольку можно формировать достаточно длинные взаимокомплементарные одноцепочечные
- 41. Сшивка фрагментов с разноименными липкими концами В
- 42. Естественно, что при использовании линкеров должна учитываться
- 43. Скачать презентацию
- 44. Похожие презентации
Вектор - молекула ДНК или РНК, состоящая из двух компонентов: векторной части (носителя) и клонируемого чужеродного гена. Задача вектора – донести выбранную ДНК в клетку-рецепиент, встроить ее в геном, позволить идентификацию трансформированных клеток, обеспечить стабильную экспрессию








































Слайд 3 Можно выделить 2 группы маркерных генов, позволяющие отличить
трансформированные клетки:
1. Селективные гены, отвечающие за устойчивость к
антибиотикам (канамицину, тетрациклину, неомицину и др.), гербицидам (у растений). Это могут быть гены ауксотрофности по какому-либо субстрату и т.д. Основной принцип работы такого маркера – способность трансформированных клеток расти на селективной питательной среде, с добавкой определенных веществ, ингибирующих рост и деление нетрансформированных, нормальных клеток. 2. Репортерные гены, кодирующие нейтральные для клеток белки, наличие которых в тканях может быть легко тестировано.
Чаще всего в качестве репортерных используются гены β-глюкуронидазы (GUS), зеленого флюоресцентного белка (GFP), люциферазы (LUC), хлорамфениколацетилтрансферазы (CAT).
Слайд 4
Типы векторов для введения гена в клетку
Векторами для
молекулярного клонирования являются молекулы ДНК, которые могут доставлять в
клетку-хозяина чужеродную ДНК. Вектор должен быть небольшого размера, иметь сайт рестрикции, в который может быть осуществлена вставка, иметь один или более селективный генетический маркер для отбора реципиентных клеток, несущих чужеродную ДНК.
Слайд 5
Векторами для клонирования являются:
Плазмиды – кольцевые двухцепочечные
экстрахромосомные самореплицирующиеся молекулы ДНК бактерий. В плазмидах клонируют фрагменты
ДНК до 10 т.п.н.Фаги. Первыми были разработаны векторы на основе фага λ E. coli. ДНК фага λ составляет примерно 50 т.п.н. Значительная часть (20 т.п.н.) несущественна для размножения фага и может быть заменена на чужеродную ДНК. В фаге можно клонировать фрагмент ДНК до 20 т.п.н.
Слайд 7 Космиды – векторы, объединяющие в себе свойства плазмиды
и фага. Созданы искусственно. Могут амплифицироваться в бактерии как
плазмиды и упаковываться в фаговые головки. Могут включать вставку чужеродной ДНК до 40 т.п.н.Искусственная дрожжевая хромосома (yeast artificial chromosome – YAC). Вектор разработан на основе ДНК дрожжей. Применяются для клонирования больших фрагментов ДНК (от 100 до 1000 т.п.н.) эукариот.
Слайд 8 В качестве примера рассмотрим процесс клонирования участка чужеродной
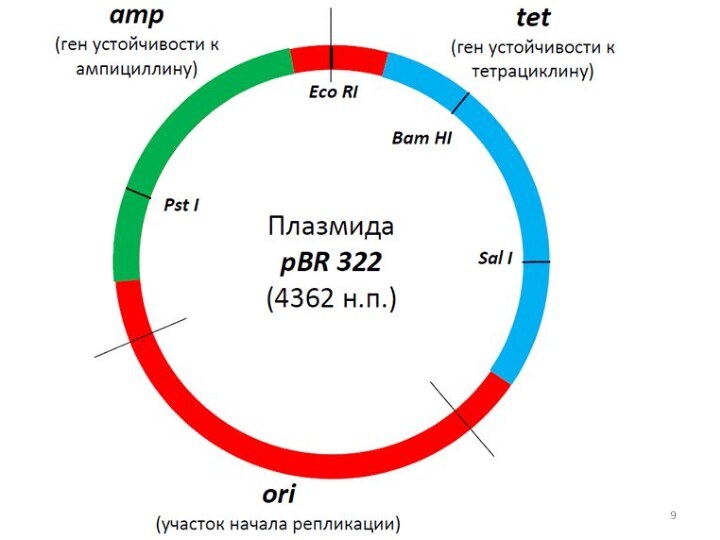
ДНК бактерией E. coli при помощи плазмиды pBR322.
pBR322 — искусственная
плазмида, созданная Франциско Боливаром и Раймондом Родригесом с целью клонирования генетического материала. Она представляет собой циклический фрагмент ДНК длиной 4361 нуклеотидных пары. Плазмида содержит ген устойчивости к тетрациклину tet, взятый из естественной плазмиды pSC 101; ген устойчивости к ампициллину amp, взятый из транспозона Tn3; и участок начала репликации ori, заимствованный из плазмиды pMB 1. Тетрациклин и ампициллин — сильные антибиотики. Наличие в плазмиде генов устойчивости к ним (активных или блокированных) играет существенную роль в выделении бактерий со встроенным участком чужеродной ДНК. Плазмида содержит также сайты рестрикции Pst I, Bam HI и Sal I, причём первый находится в гене amp, а два остальных — в гене tet. Это важное обстоятельство помогает модифицировать плазмиду.Слайд 10 Предположим, что в плазмиду необходимо встроить фрагмент, который
ранее был вырезан из другой ДНК рестриктазой Bam HI
(то есть он имеет на концах последовательность нуклеотидов, характерную для сайта рестрикции Bam HI). Для этого плазмиды обрабатываются рестриктазой Bam HI, (которая разрежет кольцевую молекулу в сайте рестрикции и образует линейный участок ДНК) и добавляются участки чужеродной ДНК. Поскольку на концах всех фрагментов ДНК находятся комплементарные последовательности нуклеотидов, они начнут «склеиваться», причём возможны два варианта склейки :Соединятся концы линейной плазмиды pBR 322, образовав исходную (восстановленную) кольцевую плазмиду.
Между концами линейной плазмиды pBR 322 вклинится участок чужеродной ДНК, образовав кольцевую плазмиду со встроенным фрагментом.
Слайд 11 Поскольку плазмиды со встроенным фрагментом являются целью процесса,
необходимо выделить такие плазмиды и клонировать их. Процесс идёт
следующим образом:Плазмиды внедряются в клетки E. coli. Для этого клетки обрабатываются ионами Ca2+, что делает их мембраны проницаемыми для ДНК.
Полученные бактерии высевают на среду, содержащую ампициллин. В этой среде нормально растут колонии бактерий, содержащие плазмиды, остальные колонии угнетаются. По этому признаку можно отличить бактерии, содержащие плазмиды;
Колонии, содержащие плазмиды, перепечатываются на среду, содержащую тетрациклин. Поскольку чужеродная ДНК вклинивается внутрь гена tet, дезактивируя его, колонии бактерий с модифицированными плазмидами угнетаются тетрациклином.
Слайд 12 В результате этих действий выделяются колонии E. coli,
в плазмиды которых встроен участок чужеродной ДНК. Они высеваются
в обычную среду для дальнейшего клонирования.Процедуру клонирования можно также вести с помощью рестриктаз Sal I и Pst I. В первом случае процесс будет аналогичен, в последнем бактерии с модифицированными плазмидами будут, наоброт, чувствительны к ампициллину и нечувствительны к тетрациклину.
Слайд 13
Вирусы
Есть вирусы, которые не ведут к гибели
клетки, но встраиваются в геном клетки-хозяина и размножаются вместе
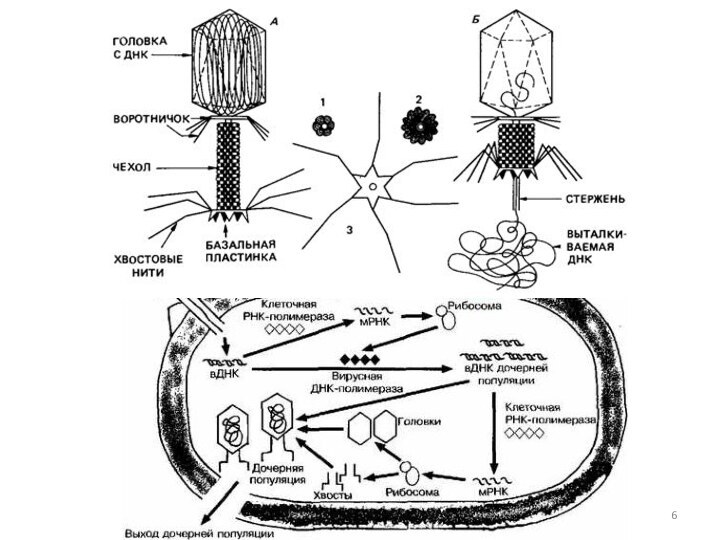
с ней, либо вызывают ее неконтролируемый рост, т.е. превращают в раковую. К таким относятся ДНК-вирусы SV-40 и вирус полиомы. Внедрение некоторых опухолевых РНК-вирусов ведет к отпочковыванию вирусных частиц от клетки без ее лизиса. К таким вирусам относятся, например, ретровирусы (вирус саркомы Рауса и СПИДа). Для бактериальных клеток в качестве вектора часто используют бактериофаги.Вирусы являются одними из главных кандидатов на роль векторов для введения чужеродной ДНК. При вирусной инфекции каждая клетка может получить большое число копий чужеродного гена. ДНК можно встраивать так, чтобы она находилась под контролем сильных вирусных промоторов, что обеспечит высокий уровень экспрессии гена, и его продукты будут более доступны для исследования.
Слайд 14 В последние годы сконструированы многочисленные "челночные" векторы и
их рекомбинантные производные, способные к репликации в животной и
бактериальной клетке и эффективно экспрессирующие клонируемый ген в животной клетке. Наиболее распространенные векторы состоят из плазмиды рВR322 и интактного раннего района транскрипции ДНК SV40, а нужный ген встраивается под контроль промотора поздних генов или дополнительного раннего промотора. Например, в ДНК SV40 был встроен ген β-глобина кролика, который экспрессировался в линии клеток обезьяны, зараженных рекомбинантным вирусом: в клетках синтезировались и мРНК гена глобина, и сам белок.Вирус должен быть жизнеспособным после рекомбинирования его ДНК. Легче всего вирусы вводятся в бактерии. Недостатком вирусов как векторов является их небольшая емкость. Кроме того, вирусы заражают небольшой круг хозяев.
Слайд 15 Существуют гибридные вектора, содержащие ДНК фага и плазмиды.
К ним относятся, например, космиды и фазмиды.
Космиды –
плазмидные вектора, в которые встроен участок генома фага λ, обеспечивающий возможность упаковки этой молекулы ДНК в фаговую частицу. Фаговые частицы обеспечивают хорошее проникновение гибридной ДНК в клетку (путем инъекции), после чего происходит замыкание ДНК в кольцо по липким концам и репликация ее по плазмидному типу. Фазмиды также являются гибридами между фагом и плазмидой. После встройки чужеродной ДНК могут в одних условиях развиваться как фаги, в других – как плазмиды.
Слайд 16
Вироиды
Из всех известных в настоящее время инфекционных
агентов имеют ранг наиболее странных. Известно, что самые мелкие
вирусы, способные к независимой репликации, имеют размеры генома, соответствующие около 1500 тыс. пар оснований. Это считали минимальным количеством генетической информации, необходимой для кодирования вирусоспецифических продуктов и подавления метаболизма хозяйской клетки.Однако в 1971 году были открыты инфекционные агенты, представляют собой очень короткую цепь 1 нитевой ковалентно связанной кольцевой РНК, состоящую из 270-300 нуклеотидов (на три порядка меньше самых минимальных вирусов), не заключенную в белковую оболочку. Это необычные патогены - самые простые и самые маленькие из всех известных.
Слайд 17 Каким образом вироиды продуцируют симптомы болезни в инфицированных
растениях, не известно до сих пор. Установлено, что они
реплицируются ферментами клетки-хозяина, не транслируются в видоспецифичные полипептиды, интегрируются в геном клетки-хозяина.Вироиды заражают персиситентно (не происходит выздоровления). Вызывают системную инфекцию, т.е. мигрируют из сайта внедрения в другие части растений, переносятся механически или через клеточный сок, через семена, пыльцу. Вироиды также связаны с ядерными фракциями растений и могут размножаться в ядрах.
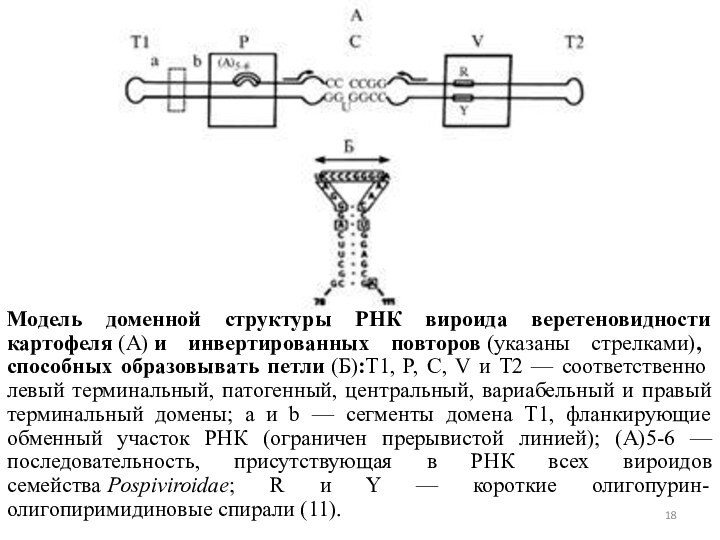
Слайд 18 Модель доменной структуры РНК вироида веретеновидности картофеля (А) и инвертированных
повторов (указаны стрелками), способных образовывать петли (Б):T1, P, C, V и
T2 — соответственно левый терминальный, патогенный, центральный, вариабельный и правый терминальный домены; a и b — сегменты домена T1, фланкирующие обменный участок РНК (ограничен прерывистой линией); (А)5-6 — последовательность, присутствующая в РНК всех вироидов семейства Pospiviroidae; R и Y — короткие олигопурин-олигопиримидиновые спирали (11).Слайд 19 При работе с вироидами получают 1-нитевую ДНК- копию
РНК и достраивают комплементарную нить для получения 2-нитевой ДНК
вироида. Такая 2-цепочечная ДНК вcтраивается в плазмиду и передается в клетки E. coli для клонирования. Считывание гена начинается с промотора, который узнается РНК-полимеразой, отвечающей за транскрипцию ДНК в матрицу РНК. Обычно это фрагмент ДНК из 41-44 пар оснований. Ген считывается слева направо, от 5’ к 3’ концу гена и заканчивается в терминальной области гена. За промотором начинается стартовый сайт транскрипции, за которым следует смысловая часть гена. Промоторная область гена содержит определенные короткие сочетания нуклеотидов, характерные для бактериальных генов, или для генов высших организмов. Такие сочетания служат сигналами для РНК-полимеразы, которая присоединяется к промоторной части гена и начинает его считывать.
Слайд 20
Транспозоны
Транспозоны - сегменты ДНК, которые контролируют собственную
транспозицию (перемещение) из одного сайта ДНК в другой путем
вырезания из исходного сайта и внедрения в новый сайт хромосомы или плазмиды. Впервые были открыты в 40-х годах американской ученой Барбарой Мак-Клинток у кукурузы. Эти гены, индентифицированные по их способности подавлять экспрессию других генов кукурузы, находящихся рядом с ними, не имели фиксированного положения в хромосоме. Они как бы передвигались по всему геному растения. Регуляторные элементы могли встраиваться и выщепляться, причем после их выщепления зачастую начинали функционировать ранее молчащие гены.Слайд 21 «Прыжки» транспозонов придают причудливую окраску кукурузным початкам. Фото
PIXFOLIO/ALAMY из статьи: Christian Biémont and Cristina Vieira. Genetics: Junk
DNA as an evolutionary force // Nature. V. 443. P. 521–524 (5 October 2006)Слайд 22 Оказалось, что гены, ассоциированные с регуляторными элементами, становились
нестабильными и часто мутировали из-за нестабильности самих этих элементов.
В течение многих лет кукуруза оставалась единственной системой, в которой обнаруживались такие подвижные генетические элементы. Сейчас - и у бактерий, дрозофил и других организмов.Механизм перемещения фрагментов ДНК по геному до конца не выяснен. ДНК переносится ферментом транспозазой. Фермент кодируется последовательность длиной около 20 нуклеотидов в середине транспозона. Он специфически взаимодействует с концевыми инвертированными повторами мобильного элемента и может вырезать его из хромосомы.
Слайд 23
Биологический смысл перемещения отдельных сегментов ДНК:
- прерывание
соответствующего гена, что ведет к эволюции;
- регуляция деятельности
генов, так как транспозоны могут нести сигналы для начала считывания генов. В новых областях усиливают или запрещают работу гена. Транспозоны также участвуют в горизонтальном переносе генов.
Слайд 24 У бактерий были обнаружены 2 класса подвижных генов,
различающихся по длине и сложности организации.
1. Инсерционные последовательности,
или IS элементы, имеющие длину около тысячи пар нуклеотидов и содержащие только ген, отвечающий за их перемещение. 2. Транспозоны, длиной от 3 до 20 т. н. п., состоящие из ряда дополнительных генов, отвечающих за устойчивость бактерий к различным токсическим веществам.
Слайд 25 Поскольку подвижные гены могут перемещаться в пределах генома
с одного места на другое, то они могут быть
весьма эффективными векторами для передачи рекомбинантной ДНК. Генетическая трансформация с помощью векторов на основе транспозонов была впервые осуществлена на дрозофиле. С помощью транспозируемого элемента Р дрозофиле был передан ген, обуславливающий коричневую окраску глаз. Перенос генов при помощи транспозонов имеет большие преимущества, так как он происходит с высокой частотой и не влечет значительных перестроек интегрируемой ДНК. Кроме того, этим методом можно переносить достаточно большие фрагменты ДНК.
Слайд 26
Генетическая трансформация клеток бактерий
В настоящее время бактерия E.
coli является самой изученной клеткой из всех существующих. У
большинства наиболее полно изученных фагов клеткой - хозяином является также E. coli.Протопласт E. coli одет в муреиновый мешок, прилегающий к внешней мембране. E. coli относится к микроорганизмам, не обладающим физиологической компетентностью к поглощению экзогенной ДНК. Поэтому необходимо создать условия, позволяющие преодолеть барьер клеточной стенки. Сначала получают сферопласты путем обработки клеток лизоцимом в изотоническом растворе.
Слайд 28 Липополисахаридный слой внешней мембраны грамотрицательной бактерии стабилизирован двухвалентными
катионами, поэтому для разрыхления внешней мембраны E. coli используется
комплексообразователь этилендиаминтетрауксусная кислота (EDTA), которая связывает двухвалентные катионы. При обработке EDTA часть липополисахаридов высвобождается из внешней мембраны клетки, и лизоцим может достигнуть муреинового мешка и гидролизовать его. Это ведет к повышению проницаемости клеточной оболочки. Усовершенствование методов получения сферопластов E. coli и их трансфекции позволили достичь достаточно высокой эффективности трансформации молекулами ДНК различных фагов.Слайд 29 Обнаружено, что на инфекционность существенное влияние оказывает форма
молекул фаговых ДНК, которую они принимают in vivo. Фаги
с кольцевой или линейной, но быстро замыкающейся ДНК (лямбоидные фаги) характеризуются наибольшей эффективностью трансфекции.Слайд 30 Успешное проведение экспериментов на кишечной палочке стало стимулом
для проведения аналогичных исследований с другими прокариотическими организмами. Наибольших
успехов удалось достичь с клетками Bacillus subtilis. B. subtilis - непатогенный почвенным микроорганизм, растущий в строго аэробных условиях. Бациллы не образуют токсинов и непатогенны ни для животных, ни для человека, тогда как клеточная стенка E. coli содержит эндотоксин, который довольно трудно отделить от продуктов генной инженерии. Кроме того, клеточная стенка бацилл имеет простую структуру и бактерии могут секретировать многие белки в культуральную жидкость.Слайд 31 Чужеродные гены клонируют в так называемых челночных векторах.
Эти вектора с одинаковым успехом реплицируются в клетках нескольких
хозяев, в данном случае, в клетках E. coli и B.subtilis. Векторы были получены комбинацией in vitro фрагментов этих плазмид.Гены E. coli со своими регуляторными районами не функционируют в B.subtilis, поэтому были использованы собственные гомологичные районы B.subtilis.
Слайд 32 Для конструирования рекомбинантной ДНК, содержащей в своем составе
ген, который должен экспрессироваться, придерживаются следующей стратегии. Синтезируют кДНК
или из клонотеки выделяют клетки, несущие фрагмент генома с нужным геном, и клонируют их в соответствующем векторе. Фрагменты геномной ДНК подвергают модификации - удаляют из них некодирующие области и участки соседних генов. Часто для проведения этой операции необходимо секвенирование данного фрагмента ДНК. Затем конструируются промежуточные рекомбинантные ДНК, в которых ген помещается под контроль бактериальных регуляторных элементов (промотор, оператор, точка связывания с рибосомами). Эти регуляторные элементы выделяют из гибридных плазмид, сконструированных специально как источники регуляторных элементов. Полученная конструкция встраивается в подходящий вектор, например, pBR 322, и ген экспрессируется в бактериальной клетке.Слайд 33 Однако удобнее встраивать ген в специальный вектор для
экспрессии, который уже содержит регуляторные элементы, обеспечивающие активную экспрессию
после введения рекомбинантной плазмиды в бактериальную клетку. К таким эффективным регуляторным участкам относится, например, сильный промотор гена бэта-лактамазы (ген устойчивости к пенициллину, входящий в состав плазмиды pBR 322). Ряд генов, в том числе и ген инсулина, встраивали в сайт рестрикции Pst I, который расположен в структурной части гена. Промотор этого гена обеспечивает эффективную транскрипцию, которая продолжается до тех пор, пока РНК-полимераза не дойдет до сигнала терминации встроенного гена.Слайд 34 В качестве примера маркирования вектора могут служит первые
эксперименты с E. coli, а точнее с одной из
ее плазмид рBR322, проведенные Гилбертом для получения инсулина. Плазмида pBR322 содержит 2 гена, которые определяют устойчивость к ампициллину и тетрациклину. Рестриктаза PstI расщепляет плазмиду в средней части гена, кодирующего фермент устойчивости к апициллину. После расщепления плазмиды на ее концы с помощью концевой трансферазы надстраивали последовательность из четырех нуклеотидов с остатками гуанина. Затем, как обычно, с помощью лигаз "вшивали" ген проинсулина, получая рекомбинантную ДНК. Встроенный в плазмиду фрагмент ДНК нарушал синтез фермента, разрушающего ампициллин, но ген, обеспечивающий устойчивость к тетрациклину, оставался активным. Трансформированные таким образом клетки E. coli синтезировали гибридный белок, содержащий последовательности пенициллазы и проинсулина, поэтому биологически активный инсулин получали путем отщепления пенициллазы и средний сегмент проинсулина.
Слайд 35
Конструирование рекомбинантных ДНК
Под рекомбинантными понимают ДНК, образованные объединением
in vitro (в пробирке) двух или более фрагментов ДНК,
выделенных из различных биологических источников. Ключевыми в этом определении являются слова "фрагмент ДНК" и "объединение in vitro", что указывает на сущность генетической инженерии и ее отличие от всех остальных методов получения гибридных (или химерных) организмов, таких как генетическая селекция, эмбриональная инженерия и т.д.Фрагменты ДНК, в том числе и фрагменты, содержащие гены, получают с использованием ферментов рестриктаз. Рестриктазы могут образовывать фрагменты как с тупыми, так и с липкими концами. Сшивка фрагментов ДНК производится тремя основными методами, зависящими от того, какие концы имеют фрагменты сшиваемых ДНК.
Слайд 36 Сшивка по одноименным "липким" концам (рестриктазно лигазный метод)
Этот метод является самым распространенным и популярным. Впервые этим
способом гибридная ДНК была получена С. Коэном с сотрудниками в 1973 году. Некоторые рестриктазы, например Pst I, внося в цепи ДНК симметричные, расположенные наискось друг от друга разрывы на равных расстояниях от центра сайта узнавания и образующие "ступеньку». Эти комплементарные друг другу участки имеют тенденцию к ассоциации за счет спаривания оснований, и поэтому их называют комплементарными или липкими концами. Спаривание оснований происходит только между комплементарными последовательностями, поэтому ААТТ-концы, образуемые Eco RI, не будут спариваться, например, с АГЦТ-концами, образуемыми Hind III. Слайд 37 Но любые два фрагмента (независимо от их происхождения),
образовавшиеся под действием одной и той же рестриктазы, могут
слипаться за счет образования водородных связей между однонитевыми участками комплементарных нуклеотидов.Однако после такого спаривания полной целостности двойной спирали не восстановится, поскольку останется два разрыва в фосфодиэфирном остове. Для его восстановления, то есть сшивания, или лигирования нитей используют фермент ДНК-лигазу. Этот фермент в живой клетке выполняет ту же функцию - сшивание фрагментов ДНК, синтезирующихся при репликации.
Слайд 38
Сшивка по "тупым" концам (коннекторный метод)
Липкие концы
не абсолютно необходимы для связывания фрагментов ДНК. Тупые концы
также могут быть соединены за счет действия ДНК-лигазы, если и лигаза, и тупые концы присутствуют в реакционной смеси в высоких концентрациях. В этом случае реакция лигирования имеет свои особенности и ее эффективность ниже, чем при сшивке по липким концам. Впервые такие эксперименты были выполнены в 1972 году Полем Бергом в Стенфордском университете, США. Липкие концы также можно ферментативным путем присоединить к молекулам ДНК с тупыми концами. Для этого используют фермент - концевую трансферазу из тимуса теленка, которая присоединяет нуклеотиды к 3 -концам цепей ДНК.Слайд 39 Если к 3'-концам одного из рекомбинируемых in vitro
фрагментов ДНК с помощью концевой дезоксинуклеотидилтрансферазы достроить одноцепочечные олиго
(dA)-сегменты определенной длины, а к концам другого фрагмента — олиго (dT)-сегменты примерно такой же длины, то при смешении полученных таким образом фрагментов происходит спаривание за счет образования водородных связей между олиго (dА)- и олигo (dT) -последовательностями. Для ковалентного соединения двух фрагментов используется ДНК-лигаза. Эти процедуры составляют основу для второго общего метода получения рекомбинантных молекул ДНК.Слайд 40 Поскольку можно формировать достаточно длинные взаимокомплементарные одноцепочечные концы,
гибридные молекулы образуются с высокой эффективностью. В частности, поэтому
при клонировании ДНК-копий матричных РНК, которые доступны в ограниченных количествах, обычно используют коннекторный метод. При таком способе соединения между фрагментами встраиваются участки ААААА. Такие дополнительные последовательности ТТТТТ могут влиять на функции соединяемых молекул и поэтому всегда, когда только возможно, для получения рекомбинантных молекул ДНК пользуются липкими концами, образовавшимися в результате действия рестриктаз.
Слайд 41
Сшивка фрагментов с разноименными липкими концами
В ситуации,
когда необходимо сшить фрагменты, образованные разными эндонуклеазами рестрикции, и
имеющие разные, то есть некомплементарные друг другу липкие концы, применяют так называемые линкеры (или "переходники"). Линкеры - это химически синтезированные олигонуклеотиды, представляющие собой сайты рестрикции или их комбинацию. Впервые эту идею предложил Шеллер с сотрудниками в 1977 году.Существуют большие наборы таких генных "переходников".
Слайд 42 Естественно, что при использовании линкеров должна учитываться необходимость
соблюдения правил экспрессии генетической информации. Часто в середину линкера
помещают какой-либо регуляторный генетический элемент, например, промотор или участок, связанный с рибосомой. В этом случае линкеры обеспечивают не только объединение генов, но и обуславливают их экспрессию. Существуют линкеры "тупой конец - липкий конец".При необходимости липкие концы можно превратить в тупые. Это достигается либо отщеплением липких концов с помощью фермента - эндонуклеазы S1, которая разрушает только одноцепочечную ДНК, либо липкие концы "застраивают", то есть с помощью ДНК-полимеразы I на однонитевых липких концах синтезируют вторую нить.