- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Рекомбинантные белки и пептиды
Содержание
- 2. Генная инженерия — совокупность приёмов, методов и
- 3. Красная биотехнология (red biotechnology) [греч. bios —
- 4. Белковая инженерия (protein engineering) [франц. ingenier —
- 5. Рекомбинантные белки, созданные некоторыми генно-инженерными микроорганизмамиВАКЦИНЫПоверхностный антиген
- 6. Некоторые генетические модифицированные микроорганизмы, использующиеся в биотехнологииBacillius brevisBacillius subtilisCorinebacterium spp.Erwinia spp.Escherichia coliPseudomonas spp.Streptomyces spp.Saccharomyces cerevisiae
- 7. Требования, предъявляемые к микроорганизмам1.Микроорганизм-реципиент не должен обладать
- 8. Типы векторов для введения гена в клеткуСуществует
- 9. Существуют гибридные вектора, содержащие ДНК фага и
- 10. Плазмиды агробактерий В качестве векторов могут
- 11. Требования, предъявляемые к плазмидам1) должна быть достаточно
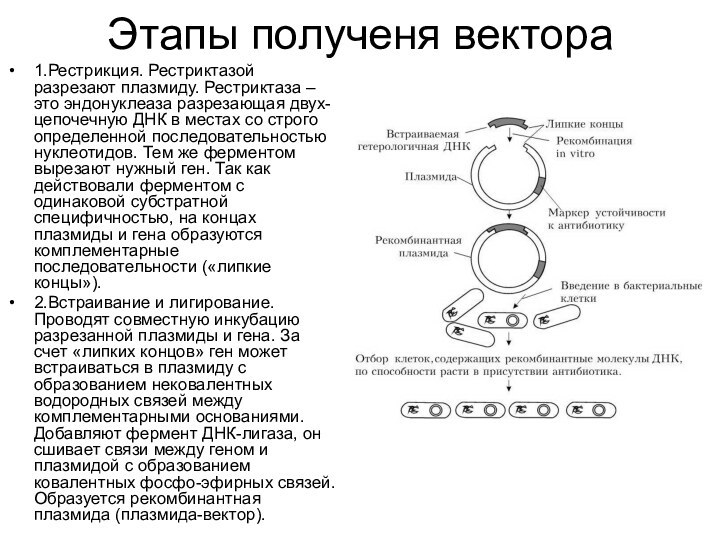
- 12. Этапы полученя вектора1.Рестрикция. Рестриктазой разрезают плазмиду. Рестриктаза
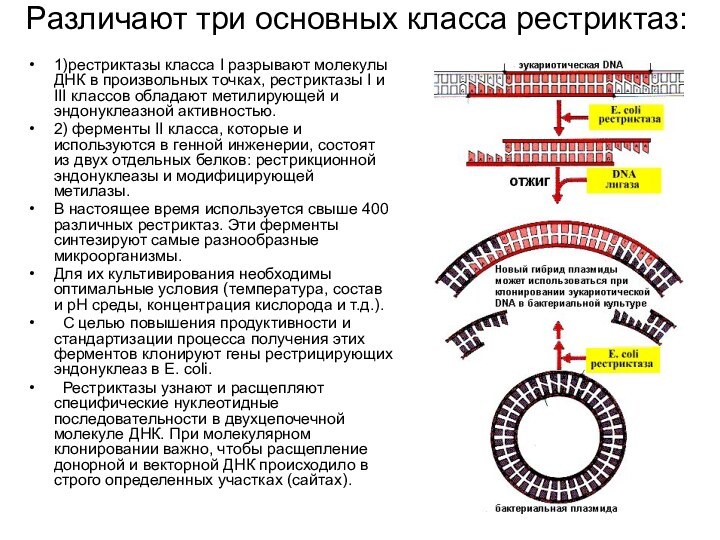
- 13. Различают три основных класса рестриктаз: 1)рестриктазы класса
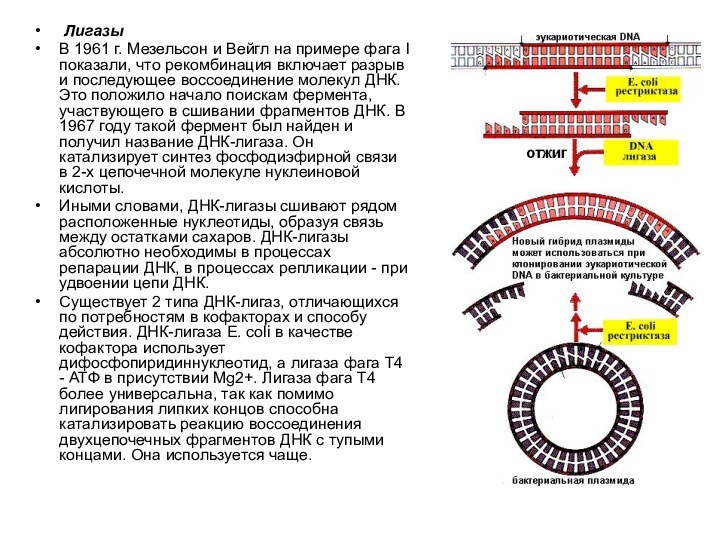
- 14. ЛигазыВ 1961 г. Мезельсон и Вейгл
- 15. Способы прямого введения гена
- 16. При трансфекции ДНК адсорбируется на кристаллах фосфата
- 17. Микроинъекция ДНК в клетки млекопитающих стала возможной
- 18. Электропорация основана на том, что импульсы высокого
- 19. «Мини-клетки» получают путем блокирования донорных клеток
- 20. Метод биологической баллистики (биолистики) является одним из
- 21. ИнсулинИнсулин - пептидный гормон, выделяемый β-клетками о.
- 22. Недостатки животного инсулина1)недостаток в поголовье скота; 2)сложности
- 23. Способы получения инсулина1) модификацией свиного инсулина синтетико-ферментативным
- 24. Варианты получения биотехнологического инсулина2.1. раздельный синтез А-
- 27. АВГалактозаИНСУЛИНАВ
- 28. В 1975 г. У.Гилберт предложил следующую схему
- 29. Escherichia coliC помощью E.coli синтезированы обе цепи
- 30. Способ синтеза инсулина человеческого с помощью E.coli
- 31. В Институте РАН получен рекомбинантный инсулин с
- 32. «+»:Идентичен по составу человеческому инсулину
- 33. Примеры препаратов инсулина, полученные путем генной инженерии:Хумулин РХумулин-цинкХумулин-НИнсуран РИнсуран НПХИнсуман КомбГенсулин Ми др.
- 34. Инсулин-лекарство для умных, а не дураков. Будь
- 35. I. По происхождению различают : а) природные
- 36. II. По способу очистки и чистоте препаратов
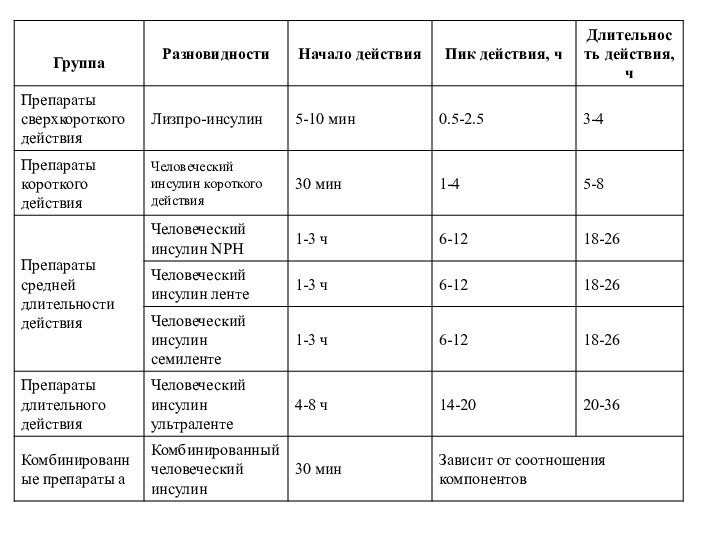
- 37. III. По скорости наступления эффектов и их
- 38. г) препараты длительного действия : ультраленте, ультраленте
- 39. АКТРАПИД НМ, получаемый из бета-клеток островков поджелудочной
- 41. Соматотропин (Гормон роста)Секретируется передней долей гипофиза и
- 42. По способу получения выделяют:гомологичные, добываемые из гипофизов
- 43. Получение соматотропинаНа первом этапе клонировали двунитевую ДНК-копию
- 44. Лекарственные формы соматотропинаЛиофилизат (порошок лиофилизированный, сухое вещество)
- 45. Показано, что соматропин и/или человеческий гормон роста
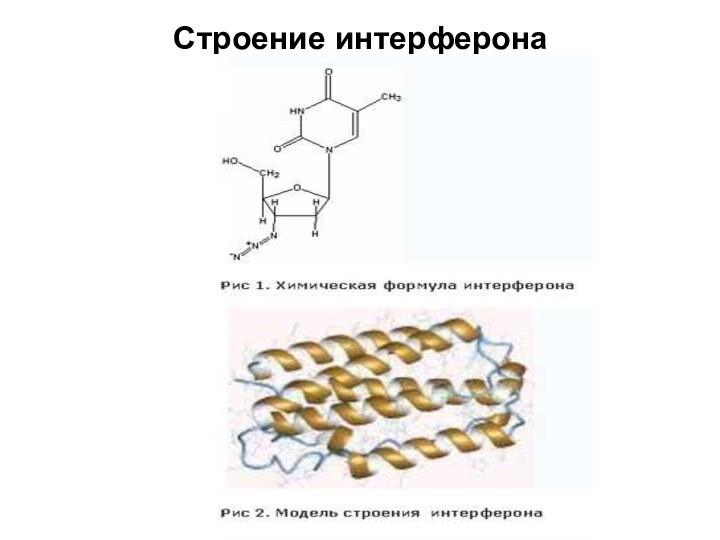
- 46. Рекомбинантные белковые факторы врожденного иммунитета Интерферон –
- 47. Строение интерферона
- 48. Классификация интерфероновЛейкоцитарные интерфероны, в зависимости от типа
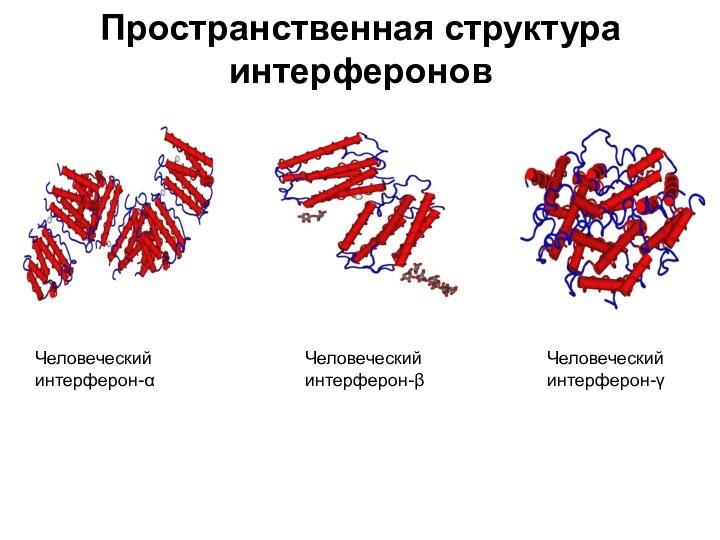
- 49. Пространственная структура интерфероновЧеловеческий интерферон-α Человеческий интерферон-β Человеческий интерферон-γ
- 50. Основные эффекты интерферонов: Противовирусный: подавление синтеза вирусной
- 51. По способу получения интерфероны делятся на:
- 52. Технология получения1. Культивирование рекомбинантного штамма E.coli,2. Замораживание
- 53. Технологическая схема получения генно-инженерных интерферонов (как одна
- 54. Основные представители. ПРЕПАРАТЫ РЕКОМБИНАНТНОГО АЛЬФА-ИНТЕРФЕРОНА Виферон
- 55. ПРЕПАРАТЫ РЕКОМБИНАНТНОГО АЛЬФА-ИНТЕРФЕРОНАРеаферонСостоит из человеческого рекомбинантного интерферона
- 56. Препараты рекомбинантного интерферона - альфаВиферон
- 57. Лекарственные формы интерферона- βСуществует 2 типа бета-интерферона,
- 58. Технология получения интерферона - βОба вида интерферона
- 59. Контроль качестваИнтерферон-бета подвергают следующим видам контроля:Физическомуполному химическомуБиологическомуконтролю на пирогенностьиспытаниям на механические включенияиспытаниям на токсичность.
- 60. ПРЕПАРАТЫ РЕКОМБИНАНТНОГО БЕТА-ИНТЕРФЕРОНА Бетаферон Рекомбинантный интерферон бета
- 61. Интерферон (ИНФ) - γ ИНФ-γ - гликопротеин
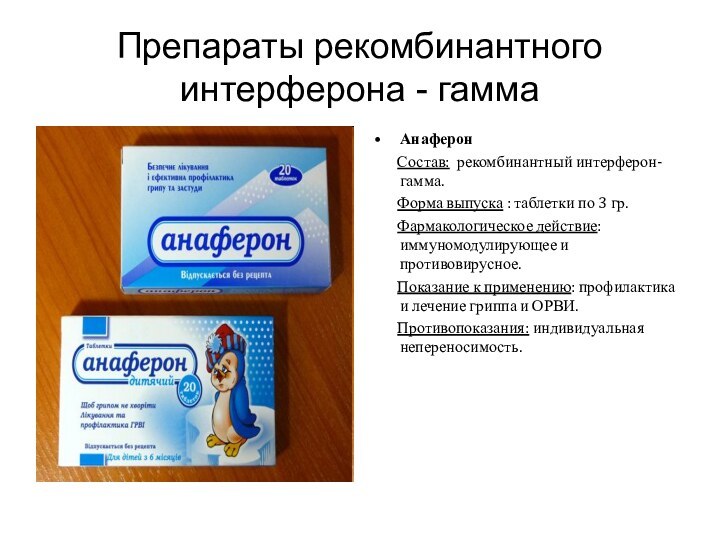
- 62. Препараты рекомбинантного интерферона - гаммаАнаферон
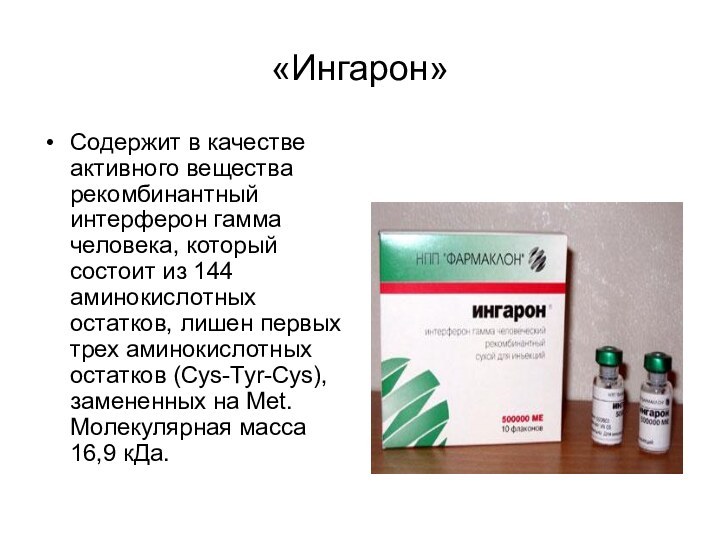
- 63. «Ингарон» Содержит в качестве активного вещества рекомбинантный
- 64. ЭритропоэтинЭритропоэтин (ЭПО) -гемопоэтический фактор роста, гликопротеин со
- 65. Способ полученияСпособ получения рекомбинантного эритропоэтина имеет важную
- 66. Выделение эритропоэтина с применением методов генной инженерииВо
- 67. Исследование механизмов взаимодействия эритропоэтина с клетками- мишенями
- 68. Лекарственные формы эритропоэтина и технология их получения.эпоэтин
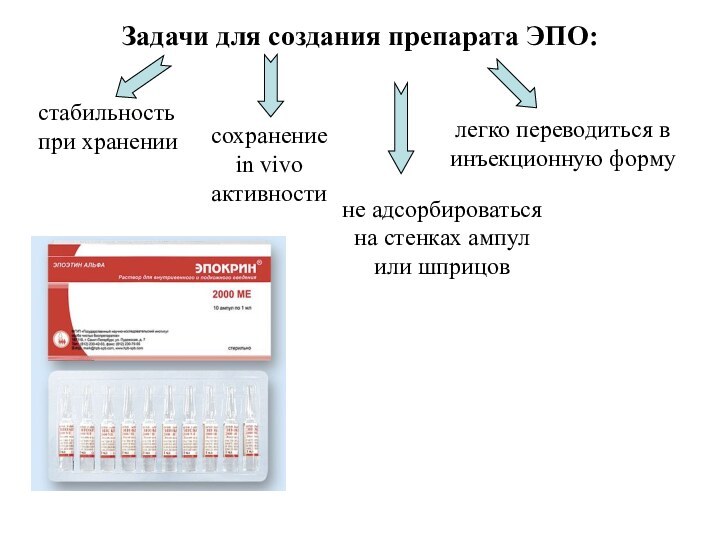
- 69. Задачи для создания препарата ЭПО:стабильность при хранениисохранение
- 70. Поставленные задачи решались комбинацией различных компонентов:Для стабилизации
- 71. Генно-инженерные (рекомбинантные) вакцины Генно-инженерные вакцины содержат антигены
- 72. • Внесение генов вирулентности в авирулентные или
- 73. Ряд современных противовирусных вакцин сконструирован путём введения
- 74. Для активной иммунопрофилактики гепатита В также предложена
- 75. ЭнджериксСпецифическая профилактика вирусного гепатита В у детей,
- 76. Цитокины, как основа для получения новых лекарственных
- 77. К наиболее важным биологическим свойствам цитокинов относят:-
- 78. Структурно-функциональная классификация и классификация цитокинов по строению.
- 79. Классификация цитокинов по биологическим функциям
- 80. Препараты цитокинов Естественные: Лейкинферон, Суперлимф — содержат
- 81. Препараты цитокинов:БЕТАЛЕЙКИН (IL-1b)1) Активация всех клеток врожденного
- 82. Препараты цитокинов:Основное свойство всех этих препаратов —
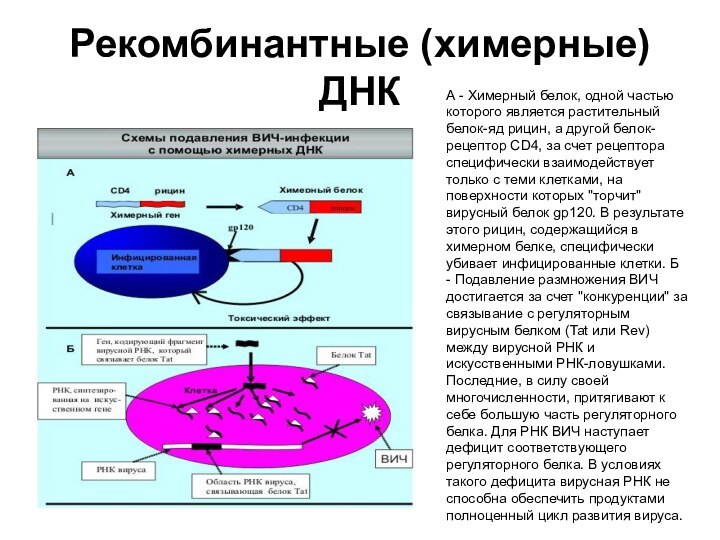
- 83. Рекомбинантные (химерные) ДНКА - Химерный белок, одной
- 84. Бесклеточные белоксинтезирующие системыБесклеточные системы создаются для моделирования
- 85. Скачать презентацию
- 86. Похожие презентации






























































Слайд 3 Красная биотехнология (red biotechnology) [греч. bios — жизнь,
techne — искусство, мастерство и logos — учение] —
использование биотехнологических процессов и методов в медицине, напр. в создании биофармацевтических препаратов (белков, ферментов, антител), а также в генной и клеточной терапии. Термин «К.б.» предложен в 2003 г. на Всемирном форуме по биологическим наукам.Слайд 4 Белковая инженерия (protein engineering) [франц. ingenier — инженер,
от лат. ingenium — способность, изобретательность] — совокупность генно-инженерных
и биохимических методов, с помощью которых создают рекомбинантные белки и осуществляют модификацию физико-химических или биологических свойств природных белков с целью улучшения их качества. Замены отдельных аминокислот или комбинирование крупных блоков полипептидных цепей (доменов) разных белков используются в биотехнологии для создания белков с новыми свойствами. Примером методов, используемых в Б.и., является мутагенез in vitro, позволяющий изменять кодирующую способность гена в определенном месте (напр., в пределах области, кодирующей активный центр белка).
Слайд 5
Рекомбинантные белки, созданные некоторыми генно-инженерными микроорганизмами
ВАКЦИНЫ
Поверхностный антиген вируса
гепатита В
Белок малярийного плазмодия
Белок оболочки НIV-1
Белок капсида НIV
ДИАГНОСТИКА
Белок вируса гепатита С
Антигены НIV -1
Антиген вируса сибирской язвы
Антиген вируса денге типа I
ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА
Фактор роста эпидермиса
Инсулин
Инсулиноподобный фактор роста
Тромбоцитарный фактор роста
Фактор роста фибробластов
Фактор ХШа системы свертывания крови
Интерфероны
Эритропоэтин
Соматотропин
Слайд 6
Некоторые генетические модифицированные микроорганизмы, использующиеся в биотехнологии
Bacillius brevis
Bacillius
subtilis
Corinebacterium spp.
Erwinia spp.
Escherichia coli
Pseudomonas spp.
Streptomyces spp.
Saccharomyces cerevisiae
Слайд 7
Требования, предъявляемые к микроорганизмам
1.Микроорганизм-реципиент не должен обладать патогенностью
и токсигенностью.
2.Безопасность генно-инжененрных производных.
3.Быстро размножающиеся штаммы.
4.Желателен рост на простых
питательных средах.5.Возможность образования суспензий высокой плотности.
Слайд 8
Типы векторов для введения гена в клетку
Существует несколько
типов векторов:
Бактериальные плазмиды
Как правило, плазмиды имеют в
своем составе гены устойчивости к антибиотикам, ионам тяжелых металлов (R-плазмиды), а также гены, контролирующие катаболизм некоторых органических соединений (плазмиды биодеградации, или D-плазмиды). Поскольку эти гены находятся в плазмидах, они представлены гораздо большим числом копий. Высокая копийность плазмид обеспечивает клетке синтез большого количества ферментов, химически нейтрализующих антибиотики или ксенобиотики, что и обеспечивает устойчивость к последним. Вирусы
Есть вирусы, которые не ведут к гибели клетки, но встраиваются в геном клетки-хозяина и размножаются вместе с ней, либо вызывают ее неконтролируемый рост, т.е. превращают в раковую. К таким относятся ДНК-вирусы SV-40 и вирус полиомы. Для бактериальных клеток в качестве вектора часто используют бактериофаги.
Вирусы являются одними из главных кандидатов на роль векторов для введения чужеродной ДНК. При вирусной инфекции каждая клетка может получить большое число копий чужеродного гена. ДНК можно встраивать так, чтобы она находилась под контролем сильных вирусных промоторов, что обеспечит высокий уровень экспрессии гена, и его продукты будут более доступны для исследования.
Слайд 9 Существуют гибридные вектора, содержащие ДНК фага и плазмиды.
К ним относятся, например, космиды и фазмиды.
Космиды –
плазмидные вектора, в которые встроен участок генома фага λ, обеспечивающий возможность упаковки этой молекулы ДНК в фаговую частицу. Фаговые частицы обеспечивают хорошее проникновение гибридной ДНК в клетку (путем инъекции), после чего происходит замыкание ДНК в кольцо по липким концам и репликация ее по плазмидному типу. Фазмиды также являются гибридами между фагом и плазмидой. После встройки чужеродной ДНК могут в одних условиях развиваться как фаги, в других – как плазмиды.
Вироиды
Из всех известных в настоящее время инфекционных агентов имеют ранг наиболее странных.
Однако в 1971 году были открыты инфекционные агенты, представляют собой очень короткую цепь 1 нитевой ковалентно связанной кольцевой РНК, состоящую из 270-300 нуклеотидов (на три порядка меньше самых минимальных вирусов), не заключенную в белковую оболочку.
Слайд 10
Плазмиды агробактерий
В качестве векторов могут использоваться
опухолеобразующие плазмиды бактерий. Виды Agrobacterium эволюционно родственны клубеньковым бактериям,
относящимся к роду Rhizobium, и имеют много общих с ними черт. Однако характер взаимодействия агробактерий с растением имеет своеобразные особенности.Хлоропластная и митохондриальная ДНК также привлекают внимание ученых в качестве возможных векторов для переноса генов в клетку. Структурная организация этих клеточных субгеномов существенно различается.
Хлоропласты и другие пластиды обладают одинаковой генетической информацией, так называемым пластомом. Для синтеза пластид необходимо значительно больше белков. Остальные белки кодируются ядром, синтезируются в цитоплазме и поступают в хлоропласты.
Транспозоны
Транспозоны - сегменты ДНК, которые контролируют собственную транспозицию (перемещение) из одного сайта ДНК в другой путем вырезания из исходного сайта и внедрения в новый сайт хромосомы или плазмиды. Транспозоны также участвуют в горизонтальном переносе генов.
У бактерий были обнаружены 2 класса подвижных генов, различающихся по длине и сложности организации.
1. Инсерционные последовательности, или 1S элементы, имеющие длину около тысячи пар нуклеотидов и содержащие только ген, отвечающий за их перемещение.
2. Транспозоны, длиной от 3 до 20 т. н. п., состоящие из ряда дополнительных генов, отвечающих за устойчивость бактерий к различным токсическим веществам.
Слайд 11
Требования, предъявляемые к плазмидам
1) должна быть достаточно большой,
чтобы включать протяженные участки чужеродной ДНК;
2) должна реплицироваться
в клетке-хозяине; 3) должна иметь участок узнавания для фермента – рестриктазы;
4) должна иметь какую-либо метку, позволяющую в дальнейшем отобрать рекомбинантные микроорганизмы (например, ген устойчивости к антибиотику).
Слайд 12
Этапы полученя вектора
1.Рестрикция. Рестриктазой разрезают плазмиду. Рестриктаза –
это эндонуклеаза разрезающая двух-цепочечную ДНК в местах со строго
определенной последовательностью нуклеотидов. Тем же ферментом вырезают нужный ген. Так как действовали ферментом с одинаковой субстратной специфичностью, на концах плазмиды и гена образуются комплементарные последовательности («липкие концы»).2.Встраивание и лигирование. Проводят совместную инкубацию разрезанной плазмиды и гена. За счет «липких концов» ген может встраиваться в плазмиду с образованием нековалентных водородных связей между комплементарными основаниями. Добавляют фермент ДНК-лигаза, он сшивает связи между геном и плазмидой с образованием ковалентных фосфо-эфирных связей. Образуется рекомбинантная плазмида (плазмида-вектор).
Слайд 13
Различают три основных класса рестриктаз:
1)рестриктазы класса I разрывают
молекулы ДНК в произвольных точках, рестриктазы I и III
классов обладают метилирующей и эндонуклеазной активностью.2) ферменты II класса, которые и используются в генной инженерии, состоят из двух отдельных белков: рестрикционной эндонуклеазы и модифицирующей метилазы.
В настоящее время используется свыше 400 различных рестриктаз. Эти ферменты синтезируют самые разнообразные микроорганизмы.
Для их культивирования необходимы оптимальные условия (температура, состав и рН среды, концентрация кислорода и т.д.).
С целью повышения продуктивности и стандартизации процесса получения этих ферментов клонируют гены рестрицирующих эндонуклеаз в Е. соli.
Рестриктазы узнают и расщепляют специфические нуклеотидные последовательности в двухцепочечной молекуле ДНК. При молекулярном клонировании важно, чтобы расщепление донорной и векторной ДНК происходило в строго определенных участках (сайтах).
Слайд 14
Лигазы
В 1961 г. Мезельсон и Вейгл на
примере фага l показали, что рекомбинация включает разрыв и
последующее воссоединение молекул ДНК. Это положило начало поискам фермента, участвующего в сшивании фрагментов ДНК. В 1967 году такой фермент был найден и получил название ДНК-лигаза. Он катализирует синтез фосфодиэфирной связи в 2-х цепочечной молекуле нуклеиновой кислоты.Иными словами, ДНК-лигазы сшивают рядом расположенные нуклеотиды, образуя связь между остатками сахаров. ДНК-лигазы абсолютно необходимы в процессах репарации ДНК, в процессах репликации - при удвоении цепи ДНК.
Существует 2 типа ДНК-лигаз, отличающихся по потребностям в кофакторах и способу действия. ДНК-лигаза E. coli в качестве кофактора использует дифосфопиридиннуклеотид, а лигаза фага Т4 - АТФ в присутствии Mg2+. Лигаза фага Т4 более универсальна, так как помимо лигирования липких концов способна катализировать реакцию воссоединения двухцепочечных фрагментов ДНК с тупыми концами. Она используется чаще.
Слайд 15
Способы прямого введения гена в
клетку
Трансфекция
Микроинъекция
Электропорация
Метод «мини-клеток»
Упаковка в липосомы
Электронная пушка
Слайд 16 При трансфекции ДНК адсорбируется на кристаллах фосфата кальция
(Грэхем Ван дер Эб, 1973). Образуются частицы кальциевого преципитата.
Они поглощаются клеткой путем фагоцитоза. Для повышения эффективности трансформации к специфической ДНК, содержащей ген, по которому будет производится селекция, добавляется неспецифическая ДНК-носитель. Обычно для этой цели берут ДНК из тимуса теленка или спермы лосося. Часть ДНК связывается с мембраной и не попадает в клетки. ДНК акцептируют от 15 до 90% клеток. Через несколько суток после введения небольшая доля клеток способны экспрессировать чужеродные гены, но затем уровень экспрессии падает и более или менее стабильную трансформацию претерпевает 10-3 - 10-5 клеток. В клетки можно вводить любой ген, если заранее лигировать его с клонированным селективным маркером. Однако дальнейшие исследования показали, что лигирование вне клетки не обязательно. Клетки, поглощающие селективный ген, вместе с ним поглощают и другую ДНК, имеющуюся в кальциевом преципитате.Для трансфекции можно использовать хромосомы или фрагменты хромосом. Клетки-доноры блокируются на стадии митоза. Митотические хромосомы высвобождаются под воздействием осмотического шока и гомогенизации. Их очищают путем дифференциального центрифугирования. Хромосомы осаждают на поверхности клеток хлористым кальцием, а через несколько часов обрабатывают реагентом, способным перфорировать мембраны (например, глицерином).
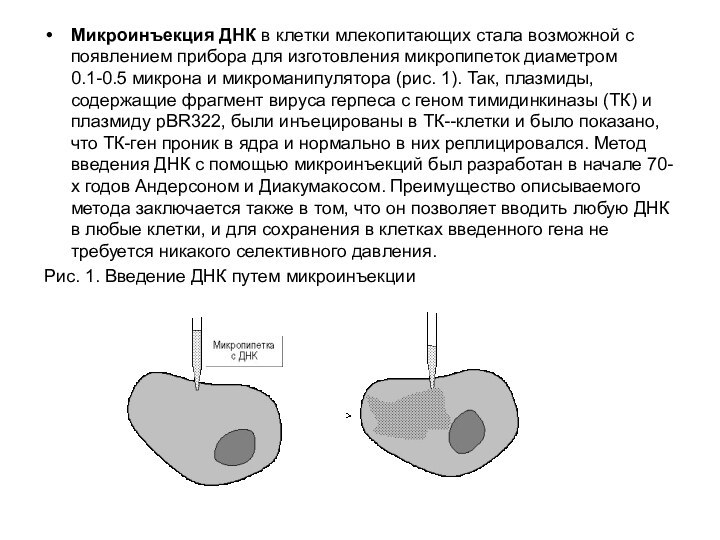
Слайд 17 Микроинъекция ДНК в клетки млекопитающих стала возможной с
появлением прибора для изготовления микропипеток диаметром 0.1-0.5 микрона и
микроманипулятора (рис. 1). Так, плазмиды, содержащие фрагмент вируса герпеса с геном тимидинкиназы (ТК) и плазмиду рВR322, были инъецированы в ТК--клетки и было показано, что ТК-ген проник в ядра и нормально в них реплицировался. Метод введения ДНК с помощью микроинъекций был разработан в начале 70-х годов Андерсоном и Диакумакосом. Преимущество описываемого метода заключается также в том, что он позволяет вводить любую ДНК в любые клетки, и для сохранения в клетках введенного гена не требуется никакого селективного давления.Рис. 1. Введение ДНК путем микроинъекции
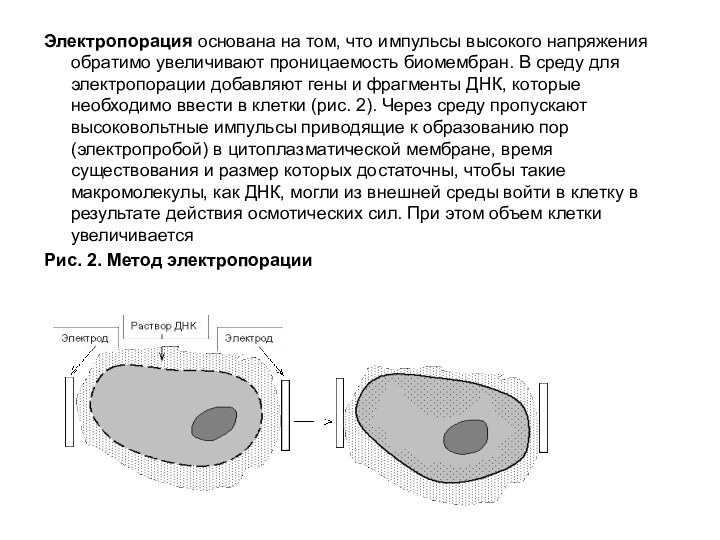
Слайд 18 Электропорация основана на том, что импульсы высокого напряжения
обратимо увеличивают проницаемость биомембран. В среду для электропорации добавляют
гены и фрагменты ДНК, которые необходимо ввести в клетки (рис. 2). Через среду пропускают высоковольтные импульсы приводящие к образованию пор (электропробой) в цитоплазматической мембране, время существования и размер которых достаточны, чтобы такие макромолекулы, как ДНК, могли из внешней среды войти в клетку в результате действия осмотических сил. При этом объем клетки увеличиваетсяРис. 2. Метод электропорации
Слайд 19 «Мини-клетки» получают путем блокирования донорных клеток митозе
колцемидом. При продолжительной обработке клеток колцемидом в них вокруг
каждой хромосомы формируется новая ядерная мембрана. Обработка цитохалазином В и центрифугирование приводит к образованию мини-клеток, представляющих микроядра, инкапсулированные в цитоплазматическую мембрану.Полученные мини-клетки очень чувствительны к разного рода воздействиям, поэтому для слияния подбирают специальные мягкие условия. Метод трудный, капризный, эффективность низкая – 10-6 – 10-7.
Упаковка в липосомы используется для защиты экзогенного генетического материала от разрушающего действия рестриктаз.
Липосомы - сферические оболочки, состоящие из фосфолипидов. Получают их путем резкого встряхивания смеси водного раствора и липидов, либо обрабатывая ультразвуком водные эмульсии фосфолипидов. Липосомы, состоящие из фосфатидилсерина и холестерина наиболее пригодны для введения ДНК в клетки животных и растений. Системы переноса с помощью липосом низкотоксичны по отношению к клеткам.
Слайд 20
Метод биологической баллистики (биолистики) является одним из самых
эффективных на сегодняшний день методов трансформации растений, особенно однодольных.
Суть метода заключается в том, что на мельчайшие частички вольфрама, диаметром 0,6—1,2 мкм, напыляется ДНК вектора, содержащего необходимую для трансформирования генную конструкцию. Вольфрамовые частички, несущие ДНК, наносятся на целлофановую подложку и помещаются внутрь биолистической пушки. Каллус или суспензия клеток наносится в чашку Петри с агаризированной средой и помещается под биолистическую пушку на расстоянии 10—15 см. В пушке вакуумным насосом уменьшается давление до 0,1 атм. В момент сбрасывания давления вольфрамовые частички с огромной скоростью выбрасываются из биолистической пушки и, разрывая клеточные стенки, входят в цитоплазму и ядро клеток.
Обычно клетки, располагающиеся непосредственно по центру, погибают из-за огромного количества и давления вольфрамовых частиц, в то время как в зоне 0,6—1 см от центра находятся наиболее удачно протрансформированные клетки. Далее клетки осторожно переносят на среду для дальнейшего культивирования и регенерации.
Слайд 21
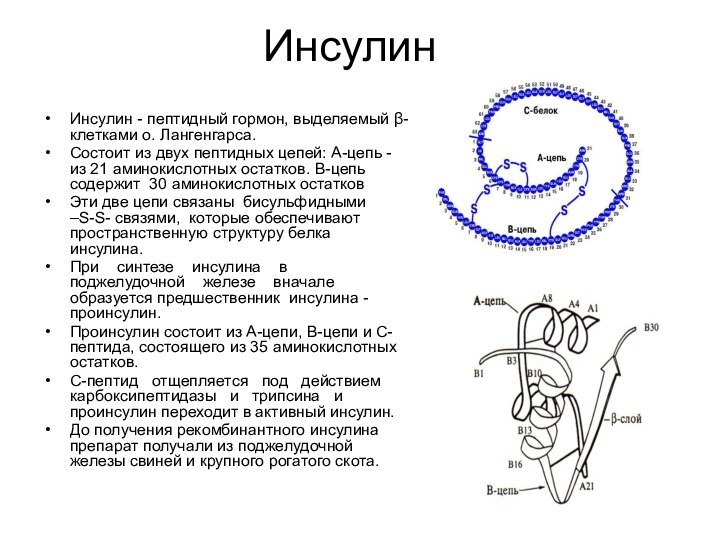
Инсулин
Инсулин - пептидный гормон, выделяемый β-клетками о. Лангенгарса.
Состоит
из двух пептидных цепей: А-цепь - из 21 аминокислотных
остатков. В-цепь содержит 30 аминокислотных остатковЭти две цепи связаны бисульфидными –S-S- связями, которые обеспечивают пространственную структуру белка инсулина.
При синтезе инсулина в поджелудочной железе вначале образуется предшественник инсулина - проинсулин.
Проинсулин состоит из А-цепи, В-цепи и С-пептида, состоящего из 35 аминокислотных остатков.
С-пептид отщепляется под действием карбоксипептидазы и трипсина и проинсулин переходит в активный инсулин.
До получения рекомбинантного инсулина препарат получали из поджелудочной железы свиней и крупного рогатого скота.
Слайд 22
Недостатки животного инсулина
1)недостаток в поголовье скота;
2)сложности хранения
и транспортировки сырья;
3)трудности выделения и очистки гормона;
4)возможность
развития аллергических реакций.
Слайд 23
Способы получения инсулина
1) модификацией свиного инсулина синтетико-ферментативным методом
Метод основан на том, что свиной инсулин
отличается от инсулина человека одной заменой на С-конце В-цепи Ala30Thr. Замену аланина на треонин осуществляют путем катализируемого ферментом отщепления аланина и присоединение вместо него защищенного по карбоксильной группе остатка треонина, присутствующего в реакционной смеси в большом избытке. После отщепления защитной О-трет-бутильной группы получают инсулин человека.2) генно-инженерным способом
Существует два основных подхода для получения генно-инженерного инсулина человека.
Слайд 24
Варианты получения биотехнологического инсулина
2.1. раздельный синтез А- и
В-цепей с последующим заключением между ними дисульфидных связей.
осуществляют
раздельное (разные штаммы-продуценты) получение обеих цепей с последующим фолдингом молекулы (образование дисульфидных мостиков) и разделением изоформ.Недостатки подобного метода: надо получать два отдельных штамма-продуцента, проводить две ферментации, две процедуры выделения и очистки, а самое главное, трудно обеспечить правильное замыкание дисульфидных связей, то есть получить активный инсулин.
2.2. синтез проинсулина с последующим выщеплением С-_пептида.
получение в виде предшественника (проинсулина) с последующим ферментативным расщеплением трипсином и карбоксипептидазой В до активной формы гормона.
При этом конформация проинсулина обеспечивает правильное замыкание дисульфидных связей, что делает второй способ микробиологического синтеза более перспективным.
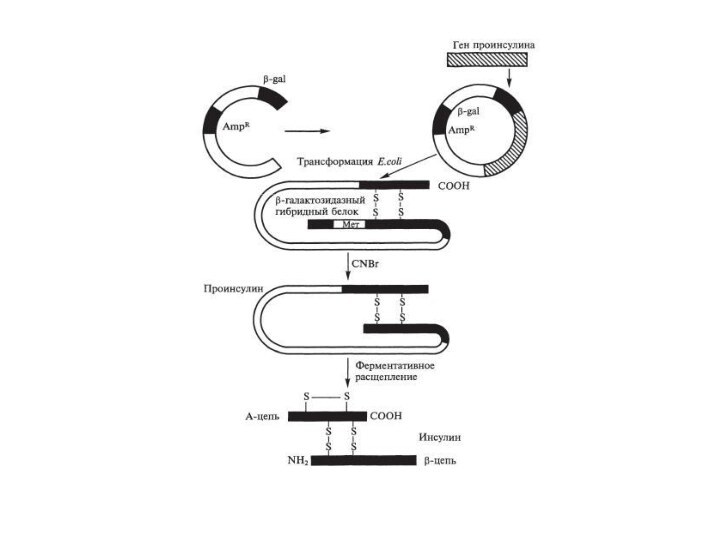
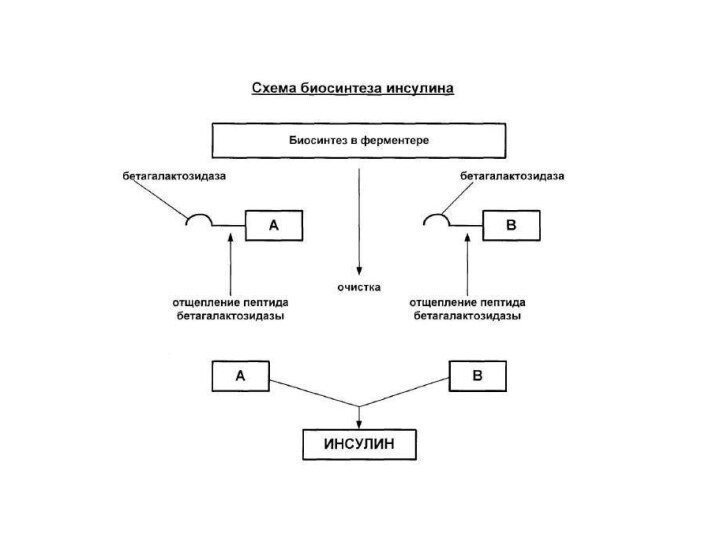
Слайд 28 В 1975 г. У.Гилберт предложил следующую схему синтеза
инсулина:
Из опухолевых клеток поджел. железы выделяется мРНК инсулина.
С помощью
обратной транскриптазы мРНК получают кДНК.Полученную кДНК встраивают в плазмиду рBR322 E. Coli в среднюю часть гена пенициллинидазы.
Рекомбинантная плазмида содержит информацию о структуре проинсулина.
В результате трансляции мРНК в клетках синтезируется гибридный белок, содержащий последовательности пенициллинидазы и проинсулина.
Проинсулин выщепляли из данного белка трипсином.
Из проинсулина выделяется инсулин.
Слайд 29
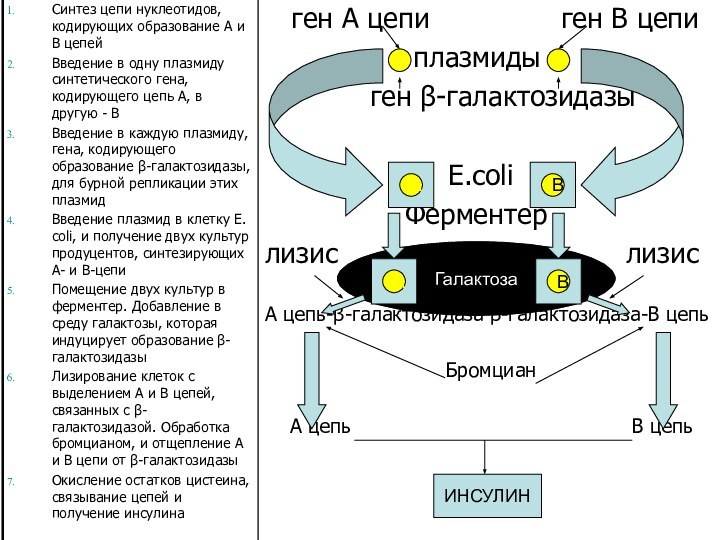
Escherichia coli
C помощью E.coli синтезированы обе цепи человеческого
инсулина, которые затем были соединены в молекулу биологически активного
гормона. Чтобы одноклеточный организм мог синтезировать на своих рибосомах молекулы инсулина, необходимо снабдить его нужной программой, то есть ввести ему ген гормона.Химическим способом получают ген, программирующий биосинтез предшественника инсулина или два гена, программирующие в отдельности биосинтез цепей А и В инсулина.
Следующий этап – включение гена предшественника инсулина (или гены цепей порознь) в геном E.coli – особого штамма кишечной палочки, выращенного в лабораторных условиях. Эту задачу выполняет генная инженерия.
Из E.coli вычленяют плазмиду соответствующей рестриктазой. синтетический ген встраивается в плазмиду (клонированием с функционально активной С-концевой частью β-галактозидазы E.coli). В результате E.coli приобретает способность синтезировать белковую цепь, состоящую из галактозидазы и инсулина. Синтезированные полипептиды отщепляют от фермента химическим путем, затем проводят и очистку. В бактериях синезируется около 100000 молекул инсулина на бактериальную клетку.
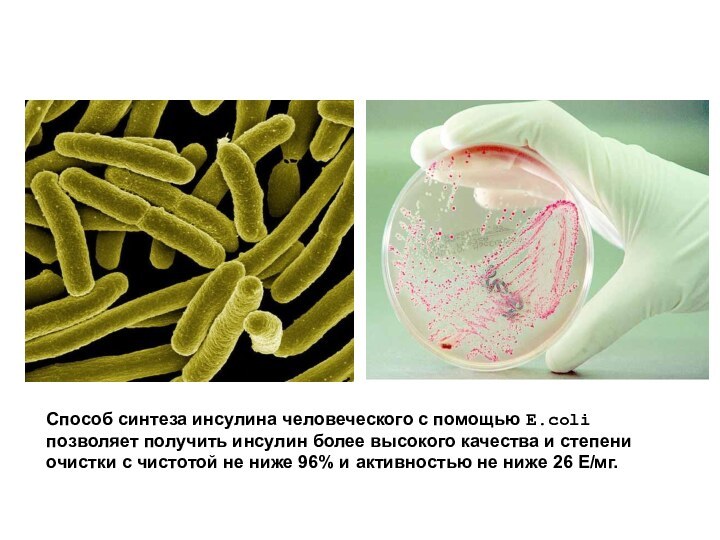
Слайд 30 Способ синтеза инсулина человеческого с помощью E.coli позволяет
получить инсулин более высокого качества и степени очистки с
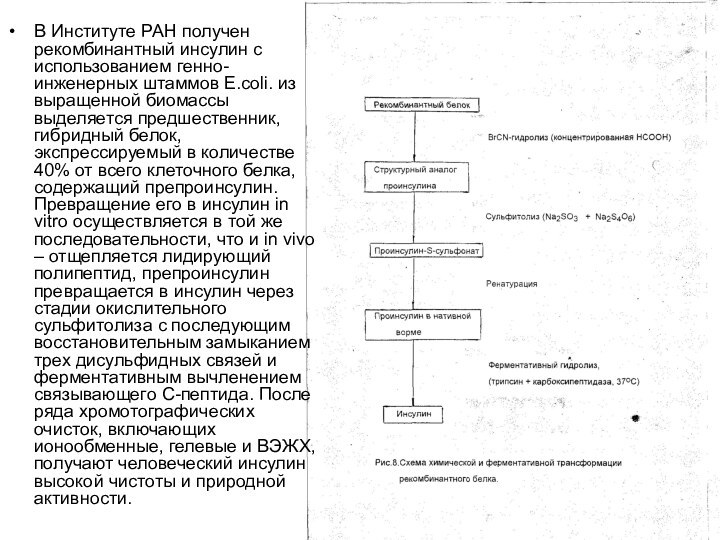
чистотой не ниже 96% и активностью не ниже 26 Е/мг.Слайд 31 В Институте РАН получен рекомбинантный инсулин с использованием
генно-инженерных штаммов E.coli. из выращенной биомассы выделяется предшественник, гибридный
белок, экспрессируемый в количестве 40% от всего клеточного белка, содержащий препроинсулин. Превращение его в инсулин in vitro осуществляется в той же последовательности, что и in vivо – отщепляется лидирующий полипептид, препроинсулин превращается в инсулин через стадии окислительного сульфитолиза с последующим восстановительным замыканием трех дисульфидных связей и ферментативным вычленением связывающего С-пептида. После ряда хромотографических очисток, включающих ионообменные, гелевые и ВЭЖХ, получают человеческий инсулин высокой чистоты и природной активности.
Слайд 32
«+»:
Идентичен по составу человеческому инсулину →
нет аллергических реакций.
Более экономичен по сравнению с животным инсулином
(1 кг инсулина можно получить в 25 кубовом ферментере, используя кишечную палочку, или необходимо 35 тыс. голов с/х животных.«-»:
Тщательный контроль выделения и очистки, т.к. примесь микробных липо- и глико-протеинов, обладают пирогенными свойствами.
Преимущества и недостатки рекомбин6инантного инсулина
Слайд 33
Примеры препаратов инсулина, полученные путем генной инженерии:
Хумулин Р
Хумулин-цинк
Хумулин-Н
Инсуран
Р
Инсуран НПХ
Инсуман Комб
Генсулин М
и др.
Слайд 34 Инсулин-лекарство для умных, а не дураков. Будь то
врачи или пациенты.
Э. П. Джослин (США)
Все препараты инсулина, выпускаемые
мировыми фармацевтическими фирмами, различаются в основном по трем
основным признакам :
1) по происхождению;
2) по скорости наступления эффектов и их продолжительности;
3) по способу очистки и степени чистоты препаратов
Слайд 35
I. По происхождению различают :
а) природные (биосинтетические),
естественные, препараты инсулинов, изготавливаемые из поджелудочных желез крупного рогатого
скота, например, инсулин ленте GPP, ультраленте МС а чаще свиней (например, инсулрап СПП, монотард МС, семиленте и др. );б) синтетические или, более точно, видоспецифические, человеческие инсулины. Эти препараты получают с помощью методов генной инженерии путем ДНК-рекомбинантной технологии, а потому чаще всего их называют ДНК-рекомбинантными препаратами инсулина (актрапид НМ, хомофан, изофан НМ, хумулин, ультратард НМ, монотард НМ и др. ).
Слайд 36 II. По способу очистки и чистоте препаратов различают
:
а) кристаллизованные (плохо очищенные), но не хроматографированные -
это большинство так называемых «традиционных" препаратов инсулина, выпускаемых ранее в нашей стране (инсулин для инъекций), но снятых с производства. Они содержат различные примеси в виде молекул проинсулина, глюкагона, С-пептида (связывающего Аи В-цепи проинсулина), соматостатина и других белков. В этих препаратах содержание проинсулина составляет более 10000 частиц на миллион. б) кристаллизованные и фильтрованные через гели – так называемые одно или монопиковые инсулины (актрапид, инсулрап и др. ). Высокоочищенные препараты инсулина (путем фильтрации через гели),
называемые монопиковыми, так как на хроматограмме виден только
один пик, содержат примесей менее 3000 (от 50 до 3000), а еще более
улучшенные - монокомпонентные - менее 10 частиц на миллион частиц
инсулина.
в) кристаллизованные и очищенные посредством "молекулярного сита" и ионообменной хроматографии - так называемые монокомпонентные инсулины (актрапид МС, семиленте МС, монотард МС, ультраленте МС).
Слайд 37 III. По скорости наступления эффектов и их продолжительности
различают : а) препараты быстрого короткого действия (актрапид МС,
актрапид НМ, инсулрап, хоморап 40, инсуман рапид и др. ). Начало действия этих препаратов - через 15-30 минут, длительность действия составляет 6-8 часов; б) препараты средней продолжительности действия (начало действия через 1-2 часа, общая продолжительность эффекта - 12-16 часов); - семиленте МС; - хумулин Н, хумулин ленте, хомофан; - ленте, ленте МС, монотард МС (2-4 часа и 20-24 часов соответственно); - илетин I НПХ, илетин II НПХ и др. в) препараты средней продолжительности в смеси с инсулином короткого действия: (начало действия 30 минут; длительность - от 10 до 24 часов); актрафан НМ; хумулин М-1; М-2; М-3; М-4 (продолжительность действия до 12-16 часов); инсуман комб. 15/85; 25/75; 50/50 (действует в течение 10-16 часов).
Слайд 38
г) препараты длительного действия : ультраленте, ультраленте МС,
ультраленте НМ (до 28 часов); инсулин суперленте СПП (до
28 часов); хумулин ультраленте, ультратард НМ (до 24-28 часов).д) инсулины пролонгированного действия. Наличие в этих препаратах основных белков - протамина и глобина, цинка, а также солевого буфера изменяет скорость наступления сахароснижающего эффекта, время максимального действия, то есть пик действия и общую продолжительность действия. В результате такой смеси получается суспензия, которая медленно всасывается, поддерживая невысокую дозу препарата в крови в течение длительного времени.
Вводятся все эти препараты только подкожно.
Достоинства пролонгированных препаратов инсулина :
1) препараты вводятся всего два или один раз в сутки;
2) препараты имеют высокий рН, что делает их инъекции менее болезненными и инсулин действует быстрее.
Недостатки :
1) отсутствие физиологического пика, из чего следует, что эти препараты нельзя вводить больным с тяжелой формой сахарного диабета и их следует использовать при относительно легких и среднетяжелых формах;
2) препараты категорически нельзя вводить в вену (во избежание гипогликемии);
Слайд 39 АКТРАПИД НМ, получаемый из бета-клеток островков поджелудочной железы
свиньи, выпускается как официнальный препарат во флаконах по 10
мл, чаще всего с активностью по 40 ЕД в 1 мл.Вводят его парентерально, чаще всего под кожу. Этот препарат (как и все препараты подгруппы инсулинов быстрого короткого действия) оказывает быстрое сахаропонижающее действие. Эффект развивается через 15-20 минут, а пик действия отмечается через 2-4 часа. Общая продолжительность сахароснижающего влияния - 6-8 часов у взрослых, а у детей до 8-10 часов.
Достоинства препаратов инсулина быстрого короткого действия (актрапида) :
1) действуют быстро;
2) дают физиологический пик концентрации в крови;
3) действуют кратковременно.
Основной недостаток - кратковременность действия, что требует повторных инъекций . Показания для использования препаратов инсулина быстрого короткого действия :
Слайд 41
Соматотропин (Гормон роста)
Секретируется передней долей гипофиза и содержит
191 аминокислотный остаток.
В организме человека этот гормон необходим
для роста костей. Синтез и секреция ГР осуществляются высокоспециализированными клетками гипофиза – соматотрофами.
Регулируется секреция ГР гипоталамическими структурами через рилизинг-гормоны, оказывающие стимулирующий (соматолиберин) или подавляющий (соматостатин) эффект.
До развития генной инженерии соматотропин получали из гипофизов трупов
С 1980 г. гормон роста человека получают при помощи кишечное палочки
Слайд 42
По способу получения выделяют:
гомологичные, добываемые из гипофизов трупов;
синтетические, имеющие в своем составе на одну аминокислоту (метионин)
больше, чем человеческий гормон роста; рекомбинантные, получаемые с помощью генной инженерии.
Слайд 43
Получение соматотропина
На первом этапе клонировали двунитевую ДНК-копию мРНК
и расщеплением рестриуционными эндонуклеазами получили последовательность, которая кодирует всю
аминокислотную последовательность гормона, за исключением первых 23 аминокислот.Затем клонировали синтетический полипептид, соответствующий аминокислотам от первой до 23-й.
Далее два фрагмента объединяли, затем подстроили к паре промоторов и участку связывания рибосом.
Конечный выход гормона составляет 2,4 млг на мл культуры Е. соli
( 100000 молекул гомона на клетку).
Слайд 44
Лекарственные формы соматотропина
Лиофилизат (порошок лиофилизированный, сухое вещество) для
приготовления раствора для инъекций (в ампулах, флаконах, картриджах).
Готовые
раствор для инъекций (в картриджах). Предварительно заполненная мультидозовая одноразовая шприц-ручка для многократных инъекций.
Биосома;
Генотропин;
Крескормон;
Нордитропин (НордиЛет, ПенСет, Симплекс);
Растан;
Сайзен;
Соматропин;
Хуматроп
Слайд 45 Показано, что соматропин и/или человеческий гормон роста гипофизарного
происхождения обладают следующим действием:
проявляет анаболическое действие (стимулирует транспорт аминокислот
в клетку и стимулирует синтез белка), противодействует катаболизму; стимулирует рост скелета, костей;
вызывает увеличение числа и размера мышечных клеток;
увеличивает массу тела;
вызывает задержку в организме азота, минеральных солей (кальция, фосфора, натрия) и жидкости;
стимулирует абсорбцию кальция из ЖКТ;
стимулирует липолиз, вызывает уменьшение жировых накоплений, уменьшает поступление триглицеридов в жировые депо (особенно чувствительна к соматропину висцеральная жировая ткань);
вызывает увеличение концентрации жирных кислот в плазме;
повышает содержание сахара в крови (изначально снижает чувствительность к инсулину, которая позже может быть восстановлена или даже улучшена вследствие благоприятных эффектов гормона роста на цитоархитектонику тела).
Слайд 46
Рекомбинантные белковые факторы врожденного иммунитета
Интерферон – полипептид, вырабатывающийся
и аккумулирующийся во всех ядросодержащих клетках крови и эпителиальных
клетках слизистых оболочек. Он является основным звеном противоинфекционной защиты человека. Интерфероны вырабатываются и выделяются местно, в околоклеточное пространство. Действуют преимущественно на близлежащие клетки.Интерфероны - общее название, под которым в настоящее время объединяют ряд белков со сходными свойствами, выделяемые клетками организма в ответ на вторжение вируса. Благодаря интерферонам клетки становятся невосприимчивыми по отношению к вирусу. «Определяемый в качестве интерферона фактор должен быть белковой природы, обладать антивирусной активностью по отношению к разным вирусам, по крайней мере, в гомологичных клетках, опосредованной клеточными метаболическими процессами, включающими синтез РНК и белка»
Слайд 48
Классификация интерферонов
Лейкоцитарные интерфероны, в зависимости от типа клеток
в которых они образуются, подразделяются на:
1.L-группа (лейкоцитарный интерферон)
2.В-группа (интерфероны
фибробластов)3.G-группа (иммунный интерферон Т-лимфоциты)
Или по-другому:
альфа (alpha) - вырабатывается лейкоцитами,
бета (beta) - вырабатывается фибробластами, и
гамма (gamma) - вырабатывается лимфоцитами.
Все они не только обладают антивирусным и противоопухолевым
действием, но что важнее, обладают свойством активировать - понуждать к действию такие клетки иммунной системы как макрофаги.
Слайд 49
Пространственная структура интерферонов
Человеческий интерферон-α
Человеческий интерферон-β
Человеческий интерферон-γ
Слайд 50
Основные эффекты интерферонов:
Противовирусный: подавление синтеза вирусной РНК, подавление
синтеза белков оболочки вируса.
Иммуномодулирующий – способность интерферонов регулировать взаимодействие
клеток участвующих в иммунном ответе. Противоопухолевый эффект интерферонов связан с их способностью активировать цитотоксические лимфоциты, модулировать продукцию антител, подавлять действие опухолевых ростовых факторов.
Антипролиферативный эффект заключается в способности интерферонов проявлять свойства цитостатиков – подавлять рост клеток за счет ингибирования факторов стимулирующих пролиферацию клеток.
Подавление вирусной инфекции
Слайд 51
По способу получения интерфероны делятся на:
1.Природные:
получаемые из культуры клеток лейкоцитов человека, стимулированных
вирусами.
2.Рекомбинантные: получают генноинженерным методом путем культивирования
бактериальных штаммов, содержащих в своем генетическом аппарате
встроенную рекомбинантную плазмиду гена интерферона человека.
До недавнего времени интерфероны из человеческих клеток были доступны лишь в малых количествах. Как медицинский препарат использовался лейкоцитарный интерферон. Его источником служила кровь , получаемая из родильных домов.
Технология получения заключается в культивировании штамма-продуцента E. coli с последующими выделением и очисткой путем денатурации, ренатурации и хроматографией.
Слайд 52
Технология получения
1. Культивирование рекомбинантного штамма E.coli,
2. Замораживание полученной
биомассы при температуре не выше -70°С,
3. Размораживание,
4. Разрушение
клеток микроорганизма лизоцимом,5. Удаление ДНК и РНК, введение в лизат ДНК-азы и очистка выделенной нерастворимой формы интерферона, отмывка буферным раствором с детергентами,
6. Растворение осадка интерферона в растворе гуанидин гидрохлорида,
7. Ренатурация и одностадийная очистка ионообменной хроматографией.
В качестве продуцента используют штамм E.coli SS5, полученный с помощью рекомбинантной плазмиды pSS5, содержащей три промотора: Plac, Pt7 и Ptrp , и ген альфа -интерферона с введенными нуклеотидными заменами
Слайд 53 Технологическая схема получения генно-инженерных интерферонов (как одна из
возможных) принципиально сводится к следующему:
Индукция синтеза и выделение интерфероновой
мРНК из клеток;Получение кДНК, комплементарной интерфероновой мРНК из лейкоцитов;
Встраивание кДНК в плазмиду;
Введение реконструированной плазмиды в клетки E.coli;
Размножении бактерий, содержащих реконструированную плазмиду, в культуральной среде;
Сепарирование клеток E.coli;
Дезинтеграция и экстракция клеток E.coli;
Осаждение (например, полиэтиленамином) с последующим центрифугированием;
Высаливание интерферона из супернатанта аммония сульфатом;
Диализ осадка интерферона;
Растворение интерферона, пропусканием раствора через колонку с иммуносорбентом (пришитыми моноклональными антителами);
Элюция интерферона с последующей хроматографией на целлюлозном катионообменнике.
Из указанных стадий, только 8 последних фактически реализуются в производственных условиях, тогда как первые 4 стадии выполняются в лабораторных условиях. Именно эти первые 4 этапа являются наиболее трудными и сложными.
Слайд 54
Основные представители.
ПРЕПАРАТЫ РЕКОМБИНАНТНОГО АЛЬФА-ИНТЕРФЕРОНА
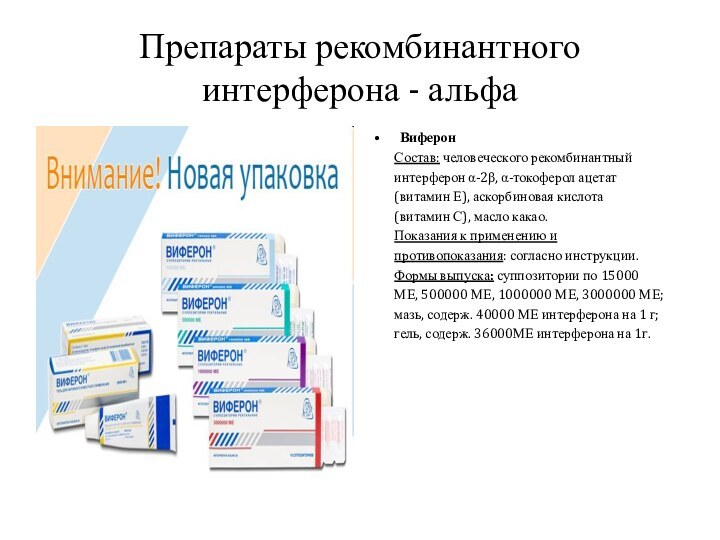
Виферон
Состоит из
человеческого рекомбинантного интерферона α2β, α-токоферола ацетата (витамин Е), аскорбиновой
кислоты (витамин С), масла какао.Виферон обладает иммуномодулирующим ( стимулирует фагоцитарную активность нейтрофилов в очагах поражения) , противовирусным и противоопухолевым действием.
Показания к применению:
- у беременных: ОРВИ, негоспитальная атипичная пневмония, пиелонефрит, гломерулонефрит, вирусные гепатиты В, С;
- у новорожденных (недоношенных детей): ОРВИ, атипичная пневмония, сепсис, цитомегалия, гепатит, кишечный дисбактериоз, энтеровирусные инфекции, менингит;
для лечения онкологических заболеваний: волосато-клеточный лейкоз, острый лимфобластный лейкоз, лимфогрануломатоз, неходжкинская лимфома, солидные опухоли;
-для лечения острых и хронических вирусных гепатитов В, С и Д;
- для лечения герпеса, уреаплазмоза, хламидиоза, микоплазмоза, цитамегаловирусной инфекции, трихомониаз, гарднереллез, папилломавирусная инфекция, бактериальный вагиноз, рецидивирующий влагалищный кандидоз;
- бронхиальная астма;
- гнойно-септические состояния.
Слайд 55
ПРЕПАРАТЫ РЕКОМБИНАНТНОГО АЛЬФА-ИНТЕРФЕРОНА
Реаферон
Состоит из человеческого рекомбинантного интерферона α2β,
стабилизированного человеческим сывороточным альбумином.
Форма выпуска: ампулы с лиофизированным
порошком по 1Х 10 5 МЕ Обладает иммуномодулирующим, противовирусным и противоопухолевым действием.
Противопоказания: беременность, аллергические заболевания.
Гриппферон
Состоит из человеческого рекомбинантного интерферона α2.
Форма выпуска : капли в нос во флаконе-капильнице по 5,0 и 10,0 мл.
Обладает иммуномодулирующим, противовирусным, противомикробным и противовоспалительным действием.
Показания к применению: профилактика и лечение ОРВИ и гриппа.
Слайд 56
Препараты рекомбинантного интерферона - альфа
Виферон
Состав: человеческого рекомбинантный
интерферон α-2β,
α-токоферол ацетат (витамин Е), аскорбиновая кислота
(витамин С), масло какао.
Показания к применению и
противопоказания: согласно инструкции.
Формы выпуска: суппозитории по 15000
МЕ, 500000 МЕ, 1000000 МЕ, 3000000 МЕ;
мазь, содерж. 40000 МЕ интерферона на 1 г;
гель, содерж. 36000МЕ интерферона на 1г.
Слайд 57
Лекарственные формы интерферона- β
Существует 2 типа бета-интерферона, используемых
в медицине - это бета-интерферон-1б и бета-интерферон-1а.
Однако, учитывая отсутствие
согласованности в методах определения биологической активности интерферонов, прямое сравнение активности различных препаратов затруднено.В настоящее время интерферон-бета выпускается в следующих формах:
Сухое вещество для инъекций 1 млн. ME во флаконах в упаковке по 3 шт. + физиологический раствор в ампулах по 1 мл в упаковке по 3 шт.
Сухое вещество для инъекции 3 млн. ME во флаконах в упаковке по 1 и 3 шт. + физиологический раствор в ампулах по 2 мл в упаковке по 1 и 3 шт.
Сухое вещество для приготовления глазных капель 600 000 ME во флаконах; растворитель 1,2 мл в шприце - по 3 флакона с активным веществом, по 3 шприца с растворителем и по 3 пипетки-капельницы в упаковке.
Мазь 500 000 ME в шприце, 5 г.
Слайд 58
Технология получения интерферона - β
Оба вида интерферона –
β в настоящее время получают методом рекомбинантного синтеза на
основе ДНК человека. Интерфероны-бета-1a нарабатываются в культуре клеток яичника китайского хомячка, а интерферон-бета-1б - в культуре бактериальных клеток (Е. Coli).
Слайд 59
Контроль качества
Интерферон-бета подвергают следующим видам контроля:
Физическому
полному химическому
Биологическому
контролю на
пирогенность
испытаниям на механические включения
испытаниям на токсичность.
Слайд 60
ПРЕПАРАТЫ РЕКОМБИНАНТНОГО БЕТА-ИНТЕРФЕРОНА
Бетаферон
Рекомбинантный интерферон бета -
1β
Форма выпуска: флаконы по 9,6 MIU
Обладает противовирусным
и противоопухолевым действием. Противопоказания: беременность, повышенная чувствительность, эпилепсия, заболевания печени
Слайд 61
Интерферон (ИНФ) - γ
ИНФ-γ - гликопротеин
с молекулярной массой 20–25 кДа
два типа ИНФ-γ:
1а и 2а, различаются последовательностью аминокислот в своей цепочке в 1 и 139 положении. выраженное действие – иммуномодулирующее (индуктор клеточного звена иммунитета);
Противовирусные и противоопухолевые свойства выражены слабее чем у ИНФ-α и ИНФ-β;
Ген ИНФ-γ расположен в 12 хромосоме;
основные клетки-продуценты - Т-лимфоциты и натуральные или естественные киллеры (NK-клетки);
Индуцирующий сигнал для выработки интерферона - любой антиген или другие цитокины.
Слайд 62
Препараты рекомбинантного интерферона - гамма
Анаферон
Состав: рекомбинантный интерферон-гамма.
Форма выпуска
: таблетки по 3 гр. Фармакологическое действие: иммуномодулирующее и противовирусное.
Показание к применению: профилактика и лечение гриппа и ОРВИ.
Противопоказания: индивидуальная непереносимость.
Слайд 63
«Ингарон»
Содержит в качестве активного вещества рекомбинантный интерферон
гамма человека, который состоит из 144 аминокислотных остатков, лишен
первых трех аминокислотных остатков (Cys-Tyr-Cys), замененных на Met. Молекулярная масса 16,9 кДа.
Слайд 64
Эритропоэтин
Эритропоэтин (ЭПО) -гемопоэтический фактор роста, гликопротеин со свойствами
гормона, физиологическая роль которого состоит в регуляции продукции эритроцитов
в зависимости от потребности организма в кислороде.
Слайд 65
Способ получения
Способ получения рекомбинантного эритропоэтина имеет важную особенность
- ген эритропоэтина человека встраивается не в микробные, а
в животные клетки(яйцеклетки китайсакого хомячка), где белок может быть гликолизирован. При этом, продуцентом эритропоэтина является монослойная культура этих клеток.
Слайд 66
Выделение эритропоэтина с применением методов генной инженерии
Во всех
случаях получение эритропоэтина ограничивается трудностями, связанными с выделением и
культивированием клеток, нестабильностью продукции гормона и, наконец, низкой концентрацией его в культуральных жидкостях.Принципиально иной подход к получению больших количеств высоко очищенного эритропоэтина был связан с применением методов генной и клеточной инженерии.
1. Попытка создания бактериального продуцента ЭПО.
2. Получение ЭПО на основе клеток насекомых.
3. Получение ЭПО продуцируемого трансфецированными клет-ками.
4. Получение высокоэффективного продуцента ЭПО трансфе-цированными клетками.
Слайд 67 Исследование механизмов взаимодействия эритропоэтина с клетками- мишенями долгое
время было невозможно из-за отсутствия радиоактивно меченого эритропоэтина, сохраняющего
биологическую активность ( Goldwasser E., 1981 ). Эта проблема было решена благодаря получению рекомбинантного эритропоэтина. Меченый эритропоэтин получают несколькими способами:1) мечение тритием по углеродной части ( Krantz S., Goldwasser E., 1984 );
2) иодирование ( Sawyer S. et al., 1987 , Todokoro K. et al., 1987 );
3) включение меченных радиоактивной серой аминокислот в процессе биосинтеза рекомбинантного эритропоэтина в трансфецированных клетках ( Mufson P., Gesner T., 1987 )
Слайд 68
Лекарственные формы эритропоэтина и технология их получения.
эпоэтин альфа:
Рэпоэтин-СП; Эпокомб; Эпокрин; Эпрекс; Эральфон.
эпоэтин бета: Веро-эпоэтин; Рекормон;
Эпостим; Эпоэтин; Эпоэтин-веро; Эритропоэтин; Эритростим. эпоэтин омега: Эпомакс.
Все лекарственные препараты выпускаются в виде раствора для инъекций.
ЭПО стандартизирован по единицам активности (ME) и измеряется в ME и/или мг.
Активное-действующее вещество / начало: эритропоэтин
эпоэтин альфа
эпоэтин бета
эпоэтин омега
Слайд 69
Задачи для создания препарата ЭПО:
стабильность при хранении
сохранение in
vivo активности
не адсорбироваться на стенках ампул или шприцов
легко переводиться
в инъекционную форму
Слайд 70
Поставленные задачи решались комбинацией различных компонентов:
Для стабилизации добавка
мочевины и различных аминокислот
Для создания нужной рН области
добавляют физиологически совместимый буфер Адсорбирование ЭПО к стенкам ампул и шприцов снижается за счет добавления незначительных количеств детергента
В качестве растворителя используют воду для инъекций с добавлением хлорида натрия для установления изотонии
Получение препарата:
Вспомогательные вещества растворяют в необходимом количестве воды и примешивают ЭПО-препарат
Стерильно фильтруют в соответствующие ампулы
Замораживают
Осторожно лиофилизируют при низких температурах
Слайд 71
Генно-инженерные (рекомбинантные) вакцины
Генно-инженерные вакцины содержат антигены возбудителей, полученные
с использованием методов генной инженерии, и включают только высокоиммуногенные
компоненты, способствующие формированию защитного иммунитета.
Слайд 72
• Внесение генов вирулентности в авирулентные или слабовирулентные
микроорганизмы.
• Внесение генов вирулентности в неродственные микроорганизмы с
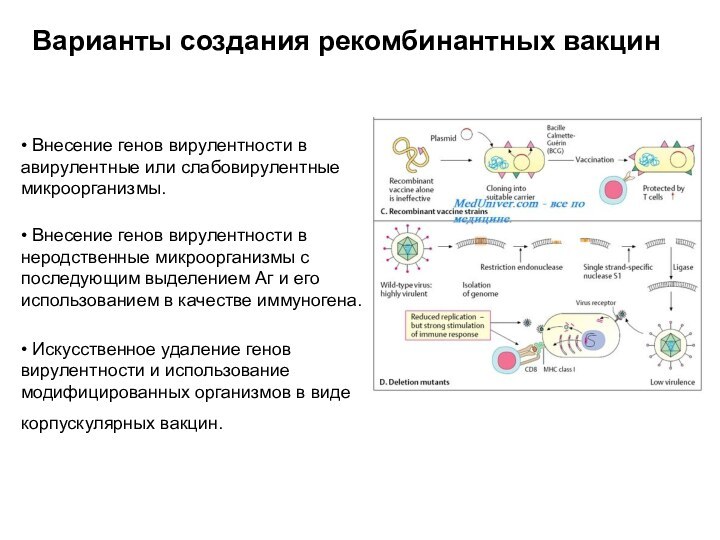
последующим выделением Аг и его использованием в качестве иммуногена. • Искусственное удаление генов вирулентности и использование модифицированных организмов в виде корпускулярных вакцин.
Варианты создания рекомбинантных вакцин
Слайд 73 Ряд современных противовирусных вакцин сконструирован путём введения генов,
кодируюших основные Аг патогенных вирусов и бактерий в геном
вируса осповакцины (HBsAg вируса гепатита В( ПОВЕРХНОСТНЫЙ АНТИГЕН ВИРУСА ГЕПАТИТА В (Hepatitis В surface antigen - HBsAg) - антиген, составляющий наружную оболочку вируса гепатита В (ВГВ).) и непатогенных для человека сальмонелл (HBsAg вируса гепатита В и Аг токсина столбнячной палочки). Другим примером служит введение генов возбудителя туберкулёза в вакцинный штамм БЦЖ, что придаёт ему большую активность в качестве дивергентной вакцины. Такие препараты известны как векторные вакцины.Слайд 74 Для активной иммунопрофилактики гепатита В также предложена вакцина,
представляющая собой HBsAg вируса. Его получают из дрожжевых клеток,
в которые введён вирусный ген (в форме плазмиды), кодирующий синтез HBsAg. Препарат очищают от дрожжевых белков и используют для иммунизации. В качестве метода более быстрой и дешёвой наработки бактериальных экзотоксинов в настоящее время разработаны методы их получения при помощи неприхотливых микроорганизмов, в геном которых искусственно внесены гены токсинообразования (например, в виде плазмид).
Слайд 75
Энджерикс
Специфическая профилактика вирусного гепатита В у детей, подростков
и взрослых.
В соответствии с Национальным календарем профилактических прививок и
календарем профилактических прививок по эпидемическим показаниям, вакцинация против вирусного гепатита В всех групп населения, не привитых ранее.Вакцинация против вирусного гепатита В в группах риска, в т.ч.:
— персонал медицинских и стоматологических учреждений, включая сотрудников клинических и серологических лабораторий;
— пациенты, которым проводится или планируются переливание крови и ее компонентов; плановые хирургические вмешательства; инвазивные лечебные и диагностические процедуры, трасплантация органов;
— дети, рожденные матерями-носителями вируса гепатита В;
— лица, у которых повышенный риск заболевания связан с их сексуальным поведением;
— лица, употребляющие инъекционные наркотики;
— лица, направляющиеся в регионы, эндемичные по гепатиту В;
— лица, проживавшие в эндемичных по гепатиту В регионах;
— больные серповидно-клеточной анемией;
— пациенты с хроническим заболеванием печени, или лица, относящиеся к группе риска развития заболеваний печени (в т.ч. пациенты с хроническим гепатитом С и носители вируса гепатита С, злоупотребляющие алкоголем);
— лица, имеющие тесный контакт с больными острым или хроническим гепатитом В; а также, в соответствии с календарем профилактических прививок по эпидемическим показаниям:
— дети домов ребенка, детских домов и интернатов;
— лица, занятые в производстве иммунобиологических препаратов из донорской и плацентарной крови;
— студенты медицинских институтов и учащиеся средних медицинских учебных заведений (в первую очередь выпускники).
Слайд 76
Цитокины, как основа для получения новых лекарственных средств
Цитокины
представляют собой пептиды или гликопротеиды с молекулярной массой от
6 до 60 кДа. Они действуют как гуморальные регуляторы в пикомолярных и наномолярных концентрациях, модулируя при нормальных или патологических состояниях организма функциональную активность индивидуальных клеток и тканей.
Слайд 77
К наиболее важным биологическим свойствам цитокинов относят:
- индуцибельность
- продукция цитокинов осуществляется в ответ на действие стимулирующих
факторов;- локальность действия;
- избыточность – каждый тип клеток может вырабатывать несколько цитокинов, а каждый цитокин может продуцироваться несколькими типами клеток;
- взаимосвязь и взаимодействие – одни цитокины могут индуцировать выработку других или повышать экспрессию соответствующих рецепторов.
Слайд 78
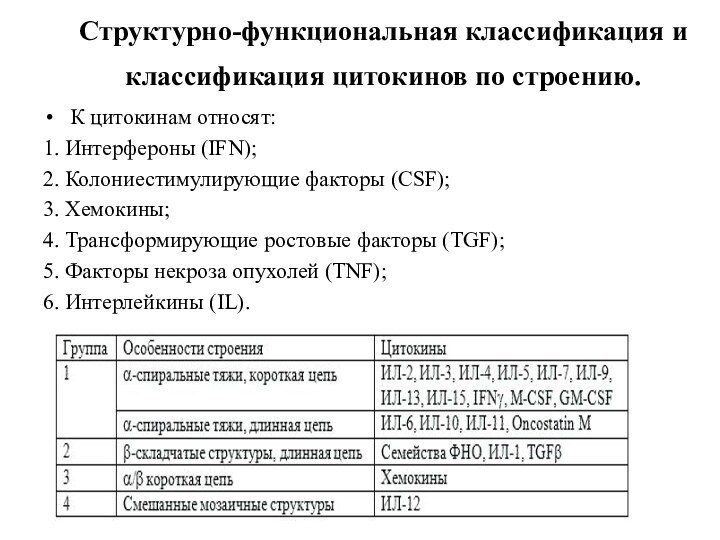
Структурно-функциональная классификация и
классификация цитокинов по строению.
К цитокинам
относят:
1. Интерфероны (IFN);
2. Колониестимулирующие факторы (CSF);
3. Хемокины;
4. Трансформирующие ростовые
факторы (TGF);5. Факторы некроза опухолей (TNF);
6. Интерлейкины (IL).
Слайд 80
Препараты цитокинов
Естественные: Лейкинферон, Суперлимф — содержат широкий спектр
цитокинов. Влияют на клетки-эффекторы врожденного иммунитета. Обладают антиоксидантной активностью,
прямым противовирусным и антибактериальным эффектом.2) Рекомбинантные:
РОНКОЛЕЙКИН (IL-2). Активатор и индуктор T-, B-, NK-клеток. Через выработку соответствующих цитокинов влияет на:
1. Выработку IFMc Th.
2. Усиление цитотоксической активности СD8 T-лимфоцитов
3. Усиление пролиферации В-лимфоцитов в плазматические клетки с последующей активацией
выработки иммуноглобулинов.
4. Повышение функциональной активности антигенпрезентирующих клеток.
Слайд 81
Препараты цитокинов:
БЕТАЛЕЙКИН (IL-1b)
1) Активация всех клеток врожденного иммунитета.
2)
Инициация первых фаз врожденного иммунитета.
3) Активация клеточного иммунитета (повышение
продукции IFNc, IL-2, CSF, усиление пролиферациилимфоцитов и функциональной активности NK-клеток).
Препараты интерферонов
1)Естественные: интерферон (лейкоцитарный интерферон из донорской крови человека).
2)Рекомбинантные: реальдирон, интрон, реаферон, роферон-А, бетаферон, виферон.
Препараты индукторов интерферонов:
1)Синтетические: Камедон, Амексин, Арбидол, Циклоферон, Неовир, Курантил.
2)Природные: Ларифан, Ридостин, Кагоцел, Рагосин, Гозалидон, Саврац, Мегасин.