Слайд 2
Практически все реакции в живом организме протекают с
участием природных биокатализаторов, называемых ферментами, или энзимами.
Слово «фермент»
происходит от лат. fermentum– закваска, а «энзим» – от греч. еn – в, внутри и zyme – дрожжи.
В настоящее время известно более 3700 ферментов.
Понятие о ферментах
Слайд 3
Идея W. Jencks (1969) о способности белков-антител катализировать
химические реакции была подтверждена в конце 80-х годов прошлого
века. Были введены термины «каталитические антитела» или «абзимы» (от antibody enzyme). В настоящее время известны несколько классов химических реакций, катализируемых антителами: ацилтрансферазные, изомеразные, бимолекулярной ассоциации и окислительно-восстановительные.
Слайд 4
Молоко здоровых женщин содержит каталитически активные антитела с
протеинкиназой, АРТ-, ДНК- и РНК- гидролизующей активностями.
http://www.nsc.ru/win/sbras/rep/96/biol96.html
Слайд 5
Каталитические РНК (рибозимы) были описаны в 80-х годах
прошлого века (T.R.Chech et al., 1981; C.Guerrier-Takada et al.,
1983). Рибозимы достаточно широко представлены в природе и играют важную роль в эволюции живых организмов, поскольку они могут обеспечивать репродукцию и процессинг РНК без участия белков-ферментов. В частности, рибозимы участвуют в удалении неинформативных интронов из пре-м-РНК, на этапе синтеза белков путем созревания тРНК с помощью рибонуклеазы Р РНК, а также в процессе саморепликации вирусного РНК генома (патогенные вирусы для растений и человека). Ранее неоднократно сообщалось, что синтез белка в рибосомах зависит от уровня рРНК.
Слайд 6
1) катализируют только энергетически возможные реакции, т. е.
те реакции, которые могут протекать и без них;
2) не
изменяют свободную энергию субстратов и продуктов реакции;
3) не сдвигают равновесие обратимой реакции,
а лишь ускоряют его наступление;
4) не расходуются в процессе реакции и выходят из реакции в первоначальном виде.
Сходство ферментов с небиологическими катализаторами заключается в том, что ферменты:
Слайд 7
Ферменты (большинство белковой природы) катализируют реакции в очень
мягких условиях (давление 1 атм., нейтральная рН, ≈37ºС);
Ферменты обладают
физико-химическими свойствами, характерными для белков: высокой молекулярной массой, амфотерностью, не способны к диализу, подвергаются высаливанию и денатурации.
Для ферментов характерна более высокая эффективность. Например, энергия активации разложения перекиси водорода Н2О2 → Н2О + ½О2 равна 75,2 кДж/моль. При добавлении неорганического катализатора платины энергия активации снижается до 50,2 кДж/моль. Фермент каталаза снижает энергию активации до 8,3 кДж/моль.
Отличия ферментов от небиологических катализаторов заключаются в том, что:
Слайд 8
активность ферментов в клетках строго регулируется как на
генетическом уровне (на этапе синтеза белка-фермента и его фолдинга),
так и посредством определённых низкомолекулярных соединений (субстратов, продуктов реакции и других низкомолекулярных эффекторов);
Ферменты обладают субстратной и каталитической специфичностью.
Различают 4 вида субстратной специфичности ферментов:
Абсолютная специфичность
Относительная специфичность
Относительная групповая специфичность
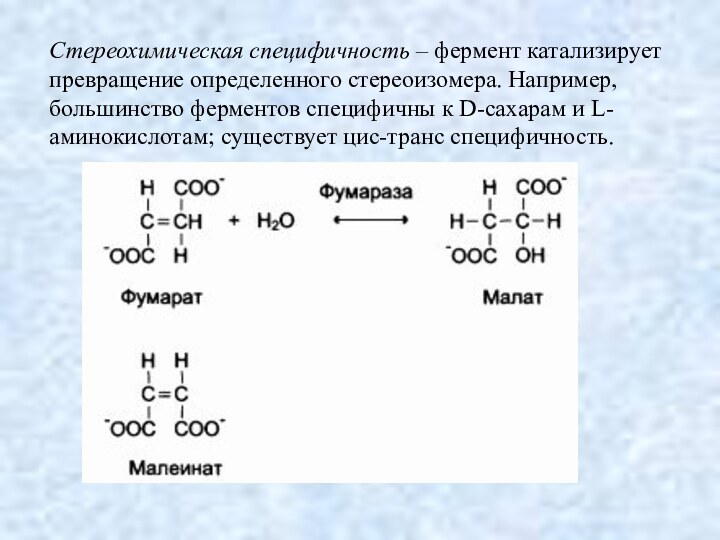
Стереохимическая специфичность
Слайд 9
Абсолютная специфичность – фермент катализирует превращение только одного
субстрата. Например, аргиназа расщепляет аргинин, уреаза – мочевину.
Слайд 10
Относительная специфичность – фермент расщепляет определенный тип связи.
Например, липаза гидролизует жиры по месту сложноэфирной связи на
глицерин и жирные кислоты.
Слайд 11
Относительная групповая специфичность – фермент расщепляет определенный тип
связи, но в ее образовании участвуют определенные функциональные группы.
Такие ферменты обычно участвуют в процессе пищеварения. Например, пищеварительные ферменты гидролизующие пептидную связь в белках относятся к протеиназам (относительная специфичность), но среди них пепсин расщепляет пептидную связь, образованную аминогруппой ароматических аминокислот; трипсин – пептидную связь, образованную карбоксильной группой основных аминокислот, а химотрипсин – карбоксильной группой ароматических аминокислот (относительная групповая специфичность).
Слайд 12
Стереохимическая специфичность – фермент катализирует превращение определенного стереоизомера.
Например, большинство ферментов специфичны к D-сахарам и L-аминокислотам; существует
цис-транс специфичность.
Слайд 13
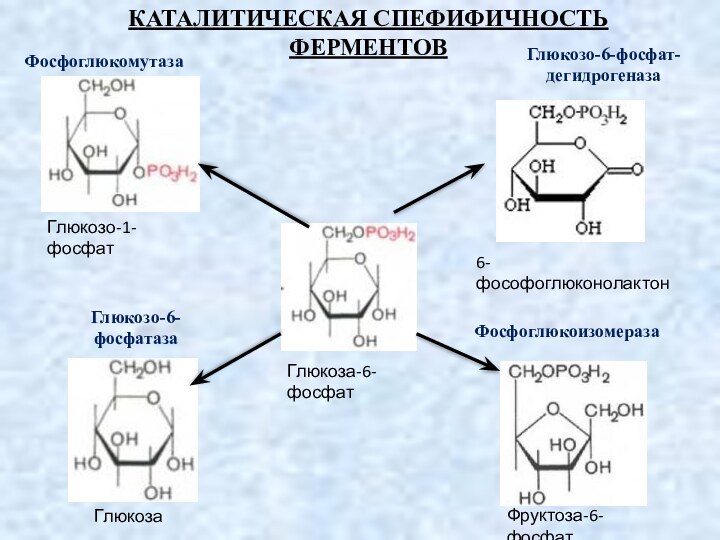
КАТАЛИТИЧЕСКАЯ СПЕФИФИЧНОСТЬ
ФЕРМЕНТОВ
Слайд 14
6. В организме действуют, как правило, полиферментные системы,
в результате чего происходит многоэтапное превращение вещества с допустимыми
для организма перепадами энергии.
Полиферментные системы (комплексы) представляют собой несколько ферментов, катализирующих ряд согласованных реакций, причем конечные продукты одной ферментативной реакции являются субстратами для следующей. Различают три типа полиферментных комплексов:
а) ферменты растворены в цитоплазме и контакт субстратов с ними осуществляется посредством диффузии;
б) ферменты соединены друг с другом за счет белок-белковых взаимодействий;
в) ферменты соединены друг с другом и иммобилизованы на внутриклеточных или цитоплазматических мембранах.
Слайд 15
Классификация и номенклатура ферментов
1. Ферменты называются добавлением суффикса
–аза к названию субстрата, на который данный фермент действует.
Например, уреаза катализирует гидролиз мочевины; ферменты, гидролизующие крахмал (амилон), были названы амилазами; гидролизующие жиры (липос) – липазами; фермент, гидролизующие белки (протеины) – протеиназами.
2. Используются названия для групп ферментов, катализирующих сходные по механизму реакции. Их название строится по принципу – «субстрат-тип реакции». Например, ферменты, которые переносят остаток фосфорной кислоты от АТФ на другую молекулу, называются киназами (глюкокиназа катализирует перенос остатка глюкозы от АТФ на глюкозу).
3. Тривиальные названия не показывают механизма действия, но они широко используются. Например, пепсин, трипсин и др.
4. Международный Совет Биохимиков (IUB) предложил систематическое название и классификацию ферментов по типу и механизму катализируемой реакции
Слайд 16
Характеристика отдельных классов ферментов
Международная классификация ферментов
Слайд 17
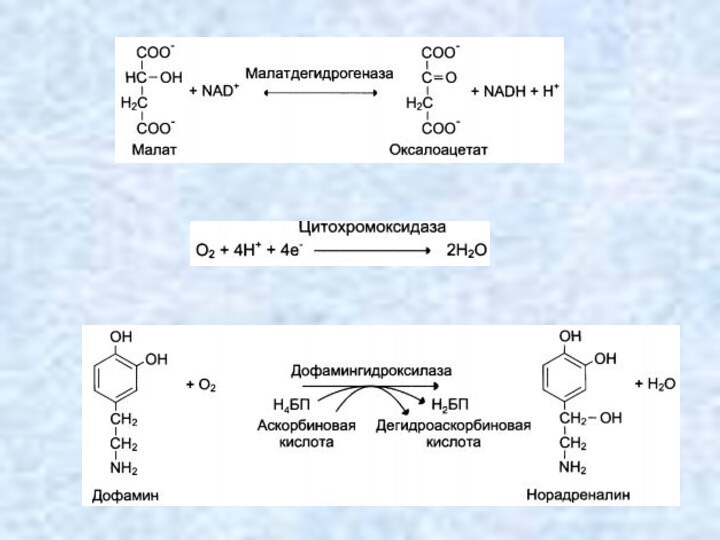
Оксидоредуктазы
(окислительно-восстановительные реакции)
Катализируют различные окислительно-восстановительные реакции с участием 2
субстратов (перенос электронов или атомов водорода с одного субстрата
на другой).
Дегидрогеназы – реакции дегидрирования (перенос атома водорода от одного субстрата на другой, акцепторы - NAD+,NADF+, FAD, FMN) (Пр.: малат-дегидрогеназа):
АН + В → А + ВН.
Оксидазы катализируют перенос водорода с субстрата на кислород (Пр: цитохромоксидаза):
АН2 +1/2 О2 → А + Н2О
Гидроксилазы и оксигеназы ускоряют некоторые реакции биологического окисления, протекающие с присоединением гидроксила или кислорода к окисляемому веществу.
Слайд 19
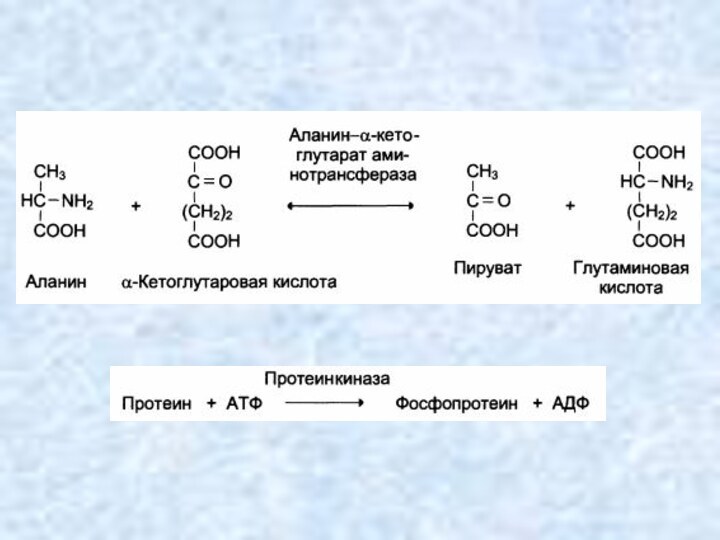
Трансферазы (перенос функциональных групп)
Катализируют перенос функциональных групп от
одного соединения к другому. Подразделяют в зависимости от переносимой
группы.
АВ + С → А + ВС
Метилтрансферазы переносят метильную группу,
Ацилтрансферазы – кислотный остаток (ацил),
Гликозилтрансферазы – моносахаридный остаток (гликозил),
Аминотрансферазы – аминную группу,
Киназы(фосфотрансферазы) – остаток фосфорной кислоты (фосфорил).
Слайд 21
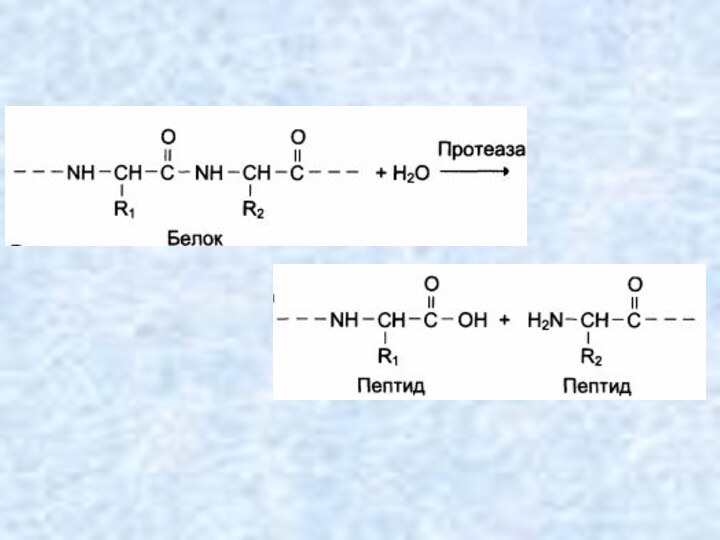
Гидролазы (реакции гидролиза)
Ускоряют реакции гидролиза (расщепления ковалентной связи
с присоединением молекулы воды по месту разрыва), при которых
из субстрата образуются 2 продукта. К гидролазам относятся все пищеварительные ферменты:
АВ + Н2О → АОН + ВН
Эстеразы ускоряют гидролиз сложных эфиров (различных липидов) на спирты и кислоты.
Фосфатазы катализируют гидролитическое отщепление фосфорной кислоты от нуклеотидов и фосфорных эфиров углеводов.
Глюкозидазы ускоряют гидролиз сложных углеводов.
Пептидгидролазы ускоряют гидролиз пептидных связей в белках и пептидах.
Слайд 23
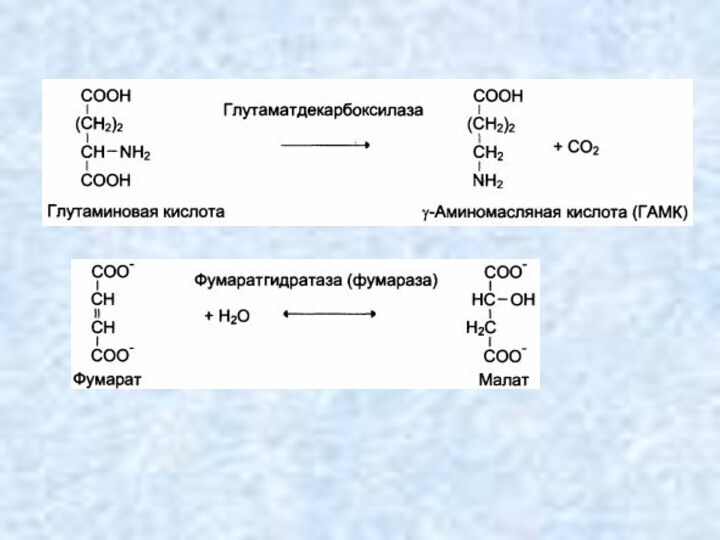
Лиазы
Лиазы ускоряют отщепление от субстратов негидролитическим путем
определенных групп (CO2, H2O, NH2, SH2 и др.), либо
присоединение чаще всего молекул воды по двойной связи. При этом могут разрываться связи:
С–С, С–N, C–O, C–S.
Слайд 25
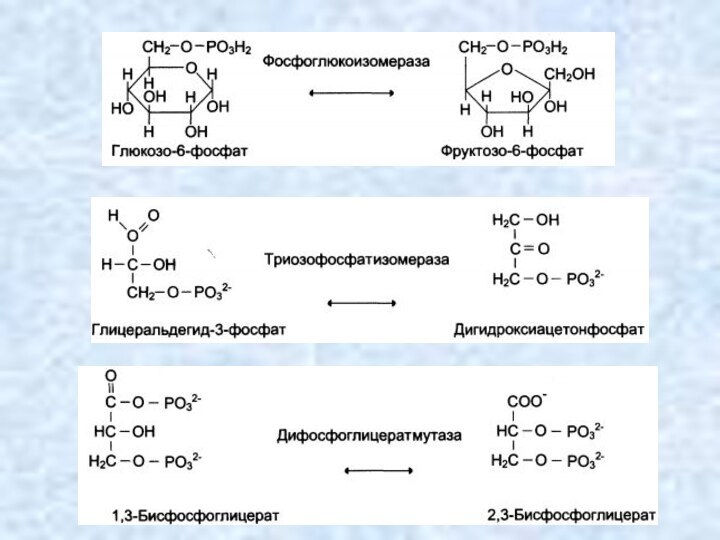
Изомеразы (реакции изомеризации)
Катализируют превращения различных типов
оптических, геометричеких и позиционных изомеров друг в друга. Название
этих ферментов составляется с учетом типа реакции: "Субстрат-цис-транс-изомераза (например транс-ретиналь - 11 цис-транс изомераза катализирует превращения транс-ретиналя в 11-цис-ретиналь при восприятии света); "альдегид-кетон-изомераза" (D-глицеральдегид-3-фосфаткетон-изомераза катализирует превращение D-глицеральдегид-3-фосфата в дигидроксиацетонфосфат); если изомеризация включает внутримолекулярный перенос группы, то фермент получает название мутазы. К классу изомераз относят так же рацемазы и эпимеразы. Внутримолекулярные перестройки:
АВ → ВА
Слайд 27
Лигазы (образование связей за счет АТФ)
Лигазы катализируют
реакции синтеза высокомолекулярных полимеров из мономеров за счет энергии
гидролиза АТФ:
X + Y + АТФ → XY + AДФ + Фн
Слайд 28
Каждый фермент имеет специальный шифр, состоящий из 4-х

кодовых чисел, разделенных точками; первая цифра характеризует класс реакции,
вторая – подкласс, третья – подподкласс, четвертая указывает порядковый номер фермента в его подподклассе. Например, лактатдегидрогеназа имеет шифр 1.1.1.27, т.е. фермент относится к 1-му классу (оксидоредуктазы), к 1-му подклассу (оксидоредуктазы, действующие на СН-ОН-группировки в качестве доноров атомов водорода), к 1-му подподклассу (акцептором атомов водорода служит никотинамидадениндинуклеотид) и занимает 27-ю позицию в перечне ферментов упомянутого подкласса.
Название класса указывает на тип химической реакции, катализируемой ферментами. Классы делятся на подклассы, а те, в свою очередь, на подподклассы. Подкласс уточняет действие фермента, т.к. указывает на природу химической группы субстрата, атакуемой ферментом. Подподкласс уточняет природу атакуемой связи субстрата или природу акцептора, который участвует в реакции. Дополнительная информация, если она необходима для уточнения, заключается в скобки. Например, фермент, катализирующий реакцию L-малат + НАД+ = пируват +СО2 +НАДН + H+ называется L-малат: НАД+ оксидоредуктаза (декарбоксилирующая).
Слайд 30
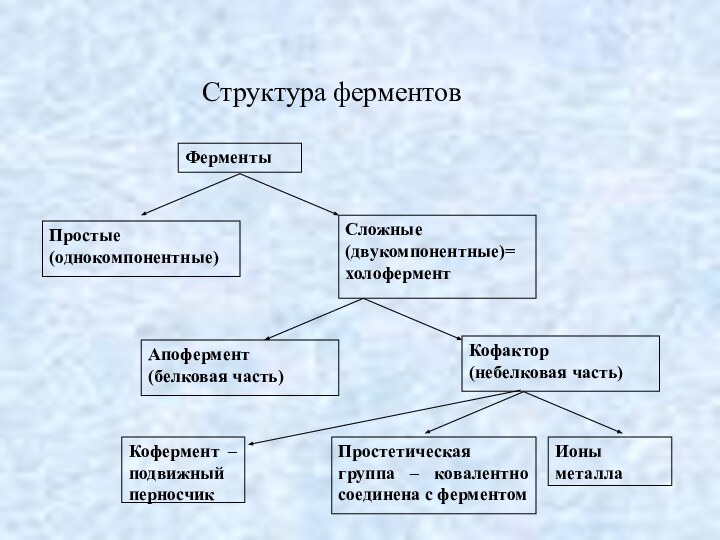
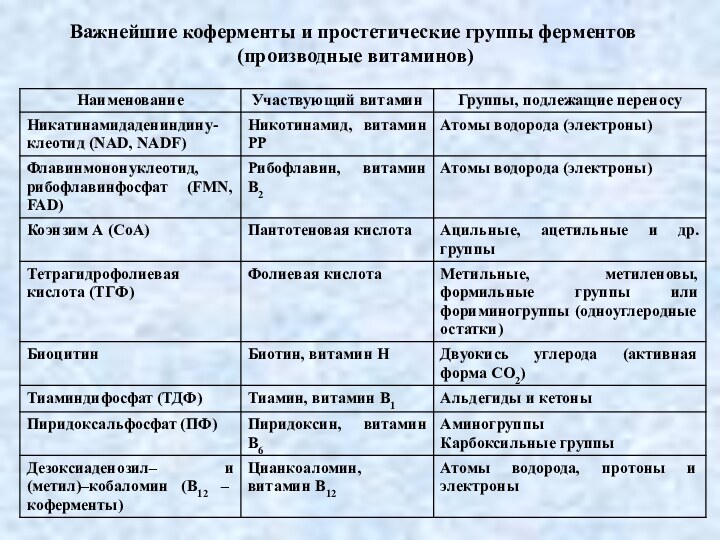
Важнейшие коферменты и простетические группы ферментов
(производные витаминов)
Слайд 31
Невитаминные кофакторы
К невитаминным кофакторам относят следующие соединения:
–
НS-глутатион,
– АТФ,
– липоевая кислота,
– производные нуклеозидов (уридинфосфат, цитидинфосфат, фосфоаденозинфосфосульфат),
–
порфиринсодержащие вещества,
– тРНК, которые в составе ферментов аминоацил-тРНК-синтетаз принимают активное участие в транспорте аминокислот к рибосоме, где осуществляется синтез белка.
Слайд 32
Роль металлов в функционировании ферментов
1. Ионы металла выполняют
функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации
белковой молекулы фермента, а именно третичной и четвертичной структур:
а) ионы металлов – стабилизаторы молекулы субстрата;
б) ионы металлов – стабилизаторы активного центра фермента;
в) роль металлов в стабилизации третичной и четвертичной структуры фермента;
2. Ионы металлов могут принимать непосредственное участие в акте катализа:
а) участие в электрофильном катализе;
б) участие в окислительно-восстановительных реакциях;
3. Роль металлов в регуляции aктивности ферментов.
Слайд 33
Роль металлов в функционировании ферментов
Структура АТФ
Слайд 34
Роль металлов в функционировании ферментов
Участие ионов магния
в присоединении субстрата в активном центре гексокиназы.
В активном центре гексокиназы есть участки связывания для молекулы глюкозы и комплекса Мg2+-АТФ. В результате ферментативной реакции происходит перенос концевого, γ-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата
Слайд 35
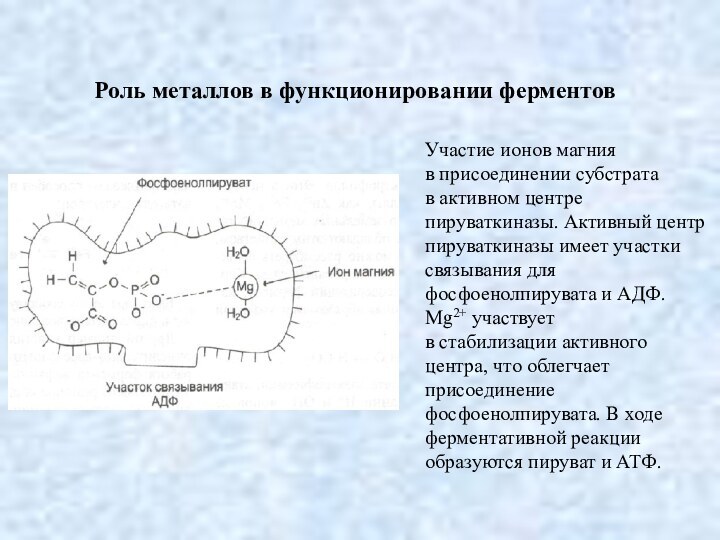
Роль металлов в функционировании ферментов
Участие ионов магния
в присоединении субстрата в активном центре пируваткиназы. Активный центр пируваткиназы имеет участки связывания для фосфоенолпирувата и АДФ. Mg2+ участвует в стабилизации активного центра, что облегчает присоединение фосфоенолпирувата. В ходе ферментативной реакции образуются пируват и АТФ.
Слайд 36
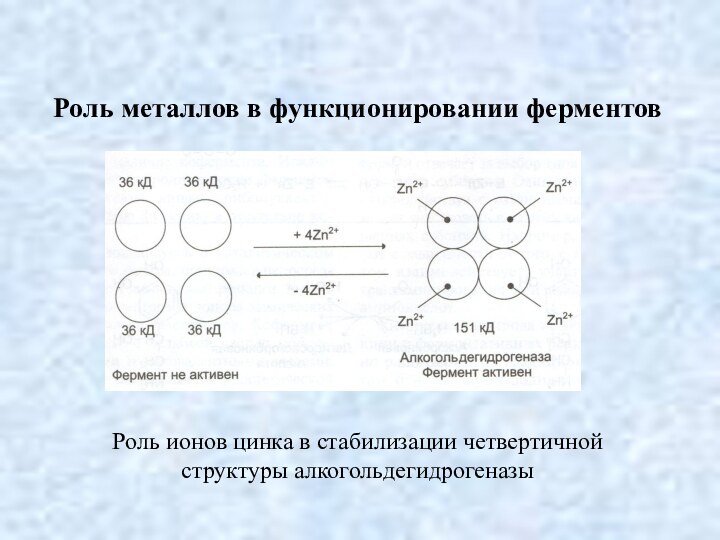
Роль металлов в функционировании ферментов
Роль ионов цинка в
стабилизации четвертичной структуры алкогольдегидрогеназы
Слайд 37
Роль металлов в функционировании ферментов
–e–
Fe2+ ↔ Fe3+
+e+
Слайд 38
Функциональная организация ферментов
В трехмерной структуре фермента выделяют несколько

участков, несущих определенную функцию. В молекуле фермента выделяют активный
центр, т.е. участок с которым связывается субстрат и протекает каталитическая реакция. Характеристика активного центра:
1. Активный центр фермента формируется при образовании третичной структуры белка за счет пространственного сближения радикалов аминокислот (чаще сер, гис, тре, цис, глу, асп, арг). Потеря конформации фермента в результате денатурации приводит к разрушению активного центра.
2. Активный центр образуется боковыми радикалами аминокислот, которые могут располагаться на значительном расстоянии в первичной структуре. Например, в активный центр химотрипсина входят гис-57, асп-102 и сер-195, а всего фермент образуют 246 аминокислотных остатков. Лизоцим осуществляет разрушение клеточных стенок некоторых бактерий благодаря активному центру, образованному 35, 52, 62, 63, 101 и 108 остатками аминокислот полипептидной цепи, которая включает 129 аминокислот.
Слайд 39
3. Активный центр представляет собой полость, щель или
карман, который занимает малую область фермента. Большинство ферментов состоят
из более, чем 100 аминокислотных остатков, имеют молекулярную массу более 10 кДа и диаметр более 2,5 нм. На область активного центра приходится всего лишь незначительная часть от объема фермента.
4. Активный центр не является жесткой структурой. Его конформация изменяется при связывании субстрата. При связывании субстрата со структурами активного центра обычно не участвует вода, за исключением случаев, когда она является реактантом.
5. У сложных ферментов в состав активного центра входят кофакторы.
6. В активном центре выделяют контактный (якорный) участок, связывающий субстрат и каталитический участок, где происходит превращение субстрата.
Слайд 40
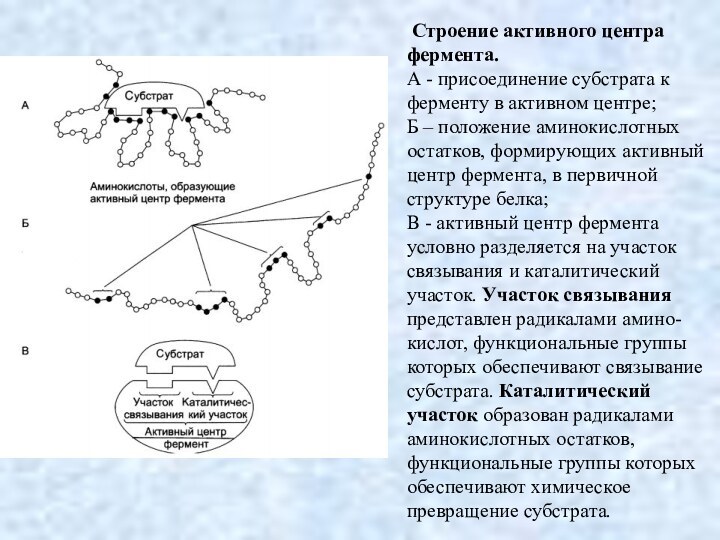
Строение активного центра фермента.
А - присоединение
субстрата к ферменту в активном центре;
Б – положение
аминокислотных остатков, формирующих активный центр фермента, в первичной структуре белка;
В - активный центр фермента условно разделяется на участок связывания и каталитический участок. Участок связывания представлен радикалами амино-кислот, функциональные группы которых обеспечивают связывание субстрата. Каталитический участок образован радикалами
аминокислотных остатков, функциональные группы которых обеспечивают химическое превращение субстрата.
Слайд 41
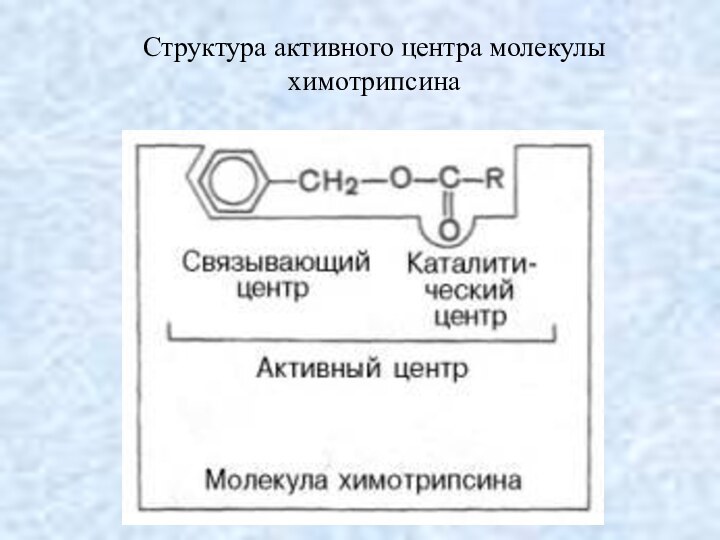
Структура активного центра молекулы химотрипсина
Слайд 42
7. Субстрат связывается с активным центром фермента не

ковалентными связями. Фермент-субстратные комплексы характеризуются константами равновесия от 10-2
до 10-8 молей, что соответствует свободной энергии взаимодействия всего от -3 до -12 ккал/моль (от -13 до 50 кДж/моль). Напомним, что для ковалентных связей свободная энергия связи составляет от -50 до -110 ккал/моль (от -210 до -460 кДж/моль).
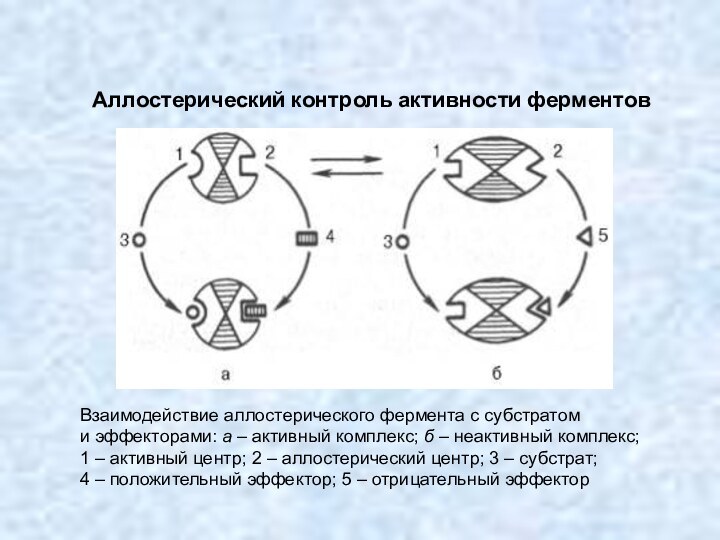
Кроме активного центра у ряда ферментов имеется регуляторный, или аллостерический (от греч. allos – иной, чужой) центр, который в молекуле фермента, как правило, пространственно отделен от активного центра. К аллостерическому центру присоединяются вещества – эффекторы, которые делятся на активаторы и ингибиторы. Присоединение эффектора к аллостерическому центру приводит к изменению третичной и/или четвертичной структуры молекулы фермента и соответственно конфигурации активного центра, вызывая снижение или повышение ферментативной активности. Ферменты, имеющие аллостерический центр, называются аллостерическими.
Слайд 43
Аллостерический центр (или центры) (от греч. allos- другой,
иной и steros– пространственный, структурный) – участок молекулы фермента,
с которым связываются определенные, обычно низкомолекулярные, вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов.
Слайд 45
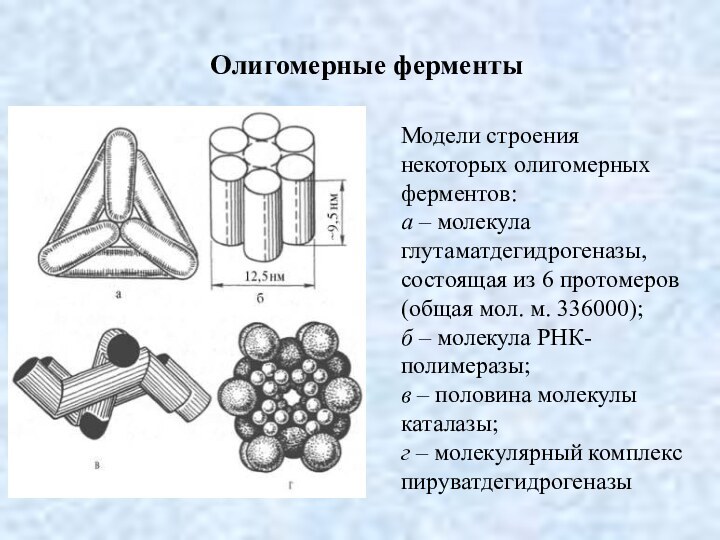
Олигомерные ферменты
Модели строения некоторых олигомерных ферментов:
а – молекула
глутаматдегидрогеназы, состоящая из 6 протомеров (общая мол. м. 336000);
б
– молекула РНК-полимеразы;
в – половина молекулы каталазы;
г – молекулярный комплекс пируватдегидрогеназы
Слайд 46
Изоферменты лактатдегидрогеназы (ЛДГ)
Распределение и относительные количества изоферментов ЛДГ
в
различных органах. Экстракты нанесены на линию, отмеченную надписью «Старт». При заданных условиях опыта (рН) 4 изофермента ЛДГ движутся
к аноду, а один (ЛДГ5) к катоду.
Слайд 47
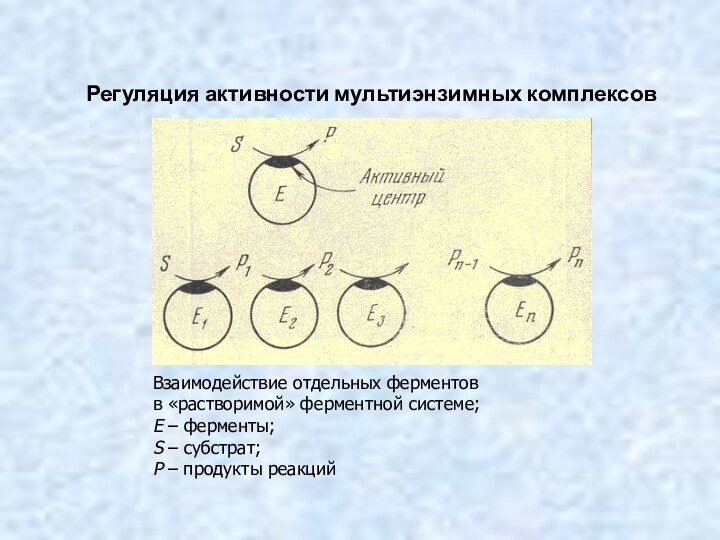
I. Диффузия субстрата к ферменту и стерическое связывание
его
с активным центром фермента, т. е. образование фермент-субстратного комплекса
(ES).
II. Преобразование первичного комплекса в один или несколько активированных фермент-субстратных комплексов (ES*, ES**…).
III. Отделение продуктов (Р) реакции от активного центра
и диффузия его в окружающую среду.
Теории и стадии ферментативного катализа
Слайд 48
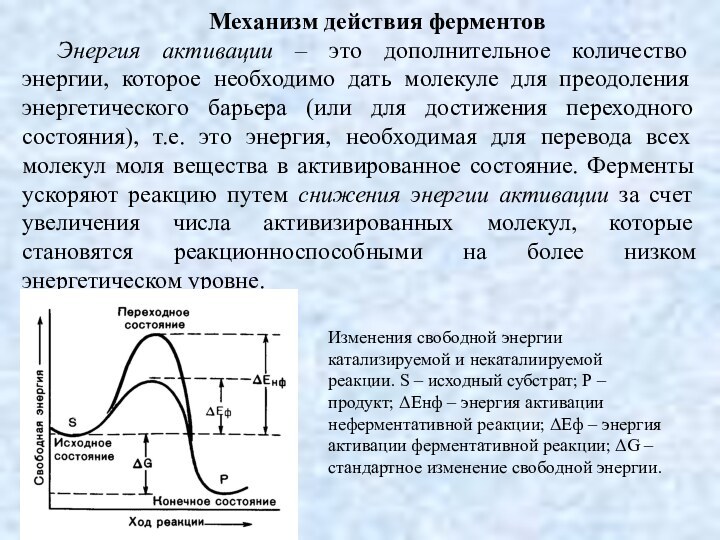
Механизм действия ферментов
Энергия активации – это дополнительное количество
энергии, которое необходимо дать молекуле для преодоления энергетического барьера
(или для достижения переходного состояния), т.е. это энергия, необходимая для перевода всех молекул моля вещества в активированное состояние. Ферменты ускоряют реакцию путем снижения энергии активации за счет увеличения числа активизированных молекул, которые становятся реакционноспособными на более низком энергетическом уровне.
Изменения свободной энергии катализируемой и некаталиируемой реакции. S – исходный субстрат; Р – продукт; ΔЕнф – энергия активации неферментативной реакции; ΔЕф – энергия активации ферментативной реакции; ΔG – стандартное изменение свободной энергии.
Слайд 49
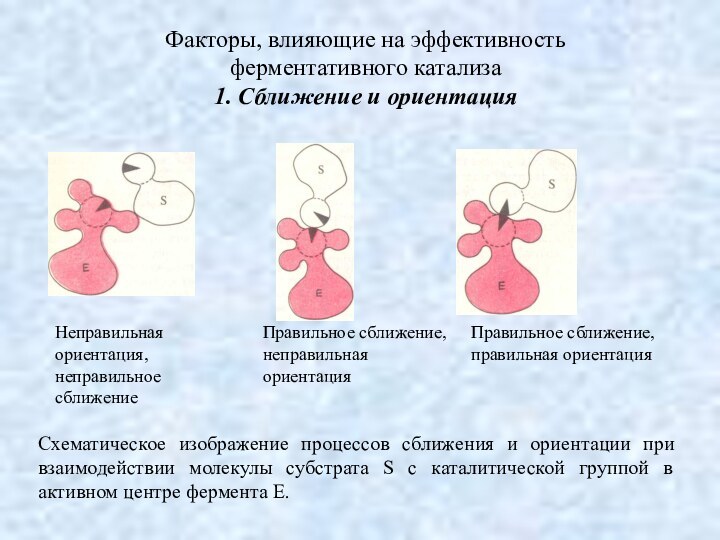
Факторы, влияющие на эффективность
ферментативного катализа
1. Сближение и
ориентация
Схематическое изображение процессов сближения и ориентации при взаимодействии
молекулы субстрата S с каталитической группой в активном центре фермента Е.
Слайд 50
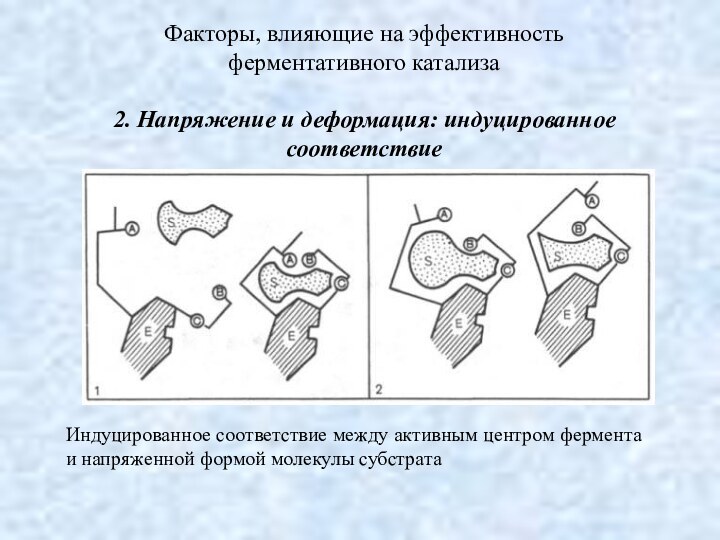
Факторы, влияющие на эффективность
ферментативного катализа
2. Напряжение и
деформация: индуцированное соответствие
Индуцированное соответствие между активным центром фермента
и напряженной формой молекулы субстрата
Слайд 51
Факторы, влияющие на эффективность ферментативного катализа
3. Общий кuслотно-основный
катализ
Слайд 52
Факторы, влияющие на эффективность ферментативного катализа
4. Ковалентный катализ
Одна
из моделей ковалентного катализа. В некоторых ферментативных реакциях фермент
замещает функциональную группу R в субстрате RX, в результате чего образуется ковалентный комплекс ЕХ. Он нестабилен и гидролизуется значительно быстрее, чем RX.
К ферментам, осуществляющим ковалентный катализ, отноcится химотрипсин.
Слайд 53
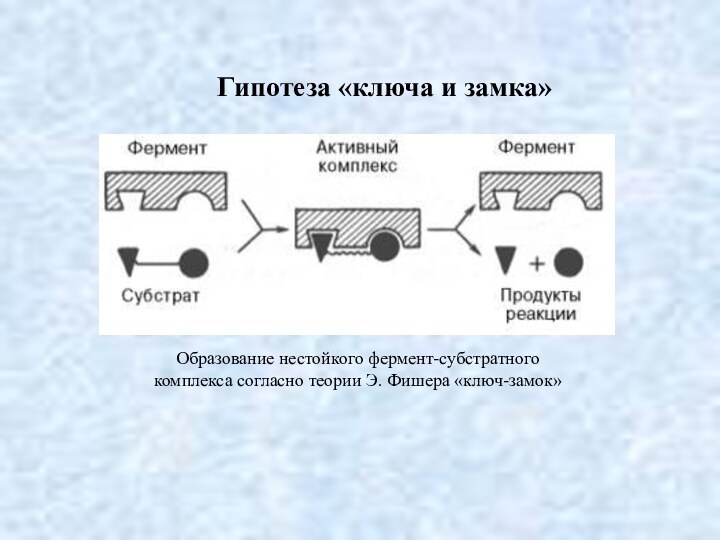
Гипотеза «ключа и замка»
Образование нестойкого фермент-субстратного
комплекса согласно
теории Э. Фишера «ключ-замок»
Слайд 54
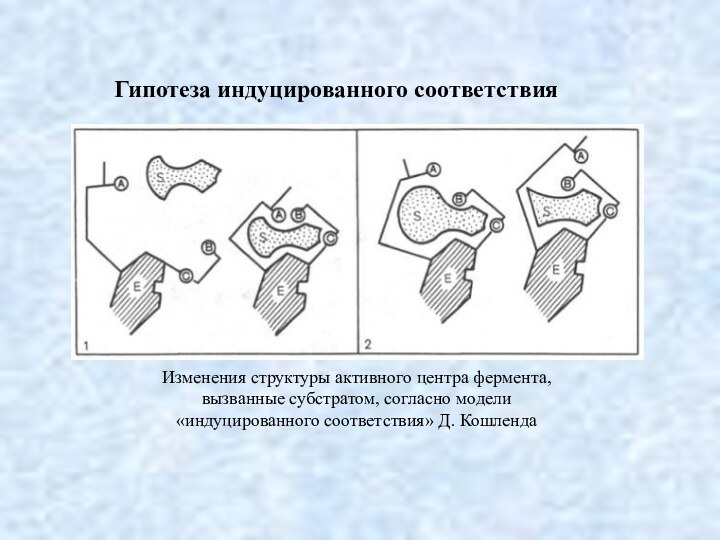
Гипотеза индуцированного соответствия
Изменения структуры активного центра фермента,
вызванные субстратом, согласно модели
«индуцированного соответствия» Д. Кошленда
Слайд 55
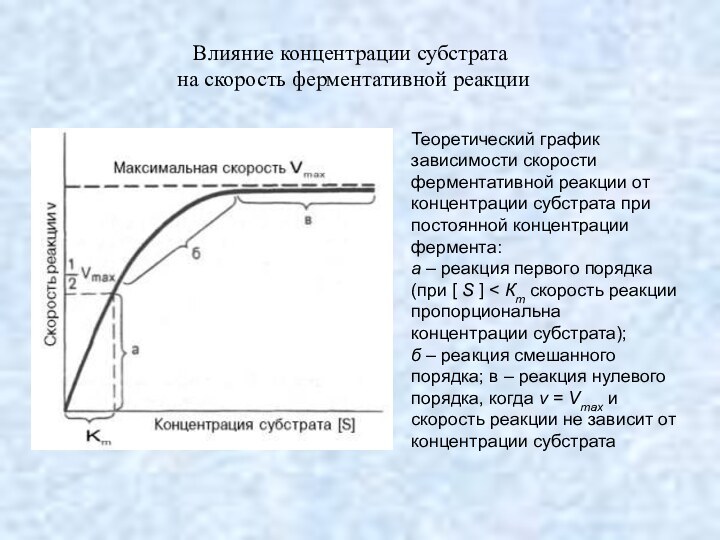
Влияние концентрации субстрата
на скорость ферментативной реакции
Слайд 56
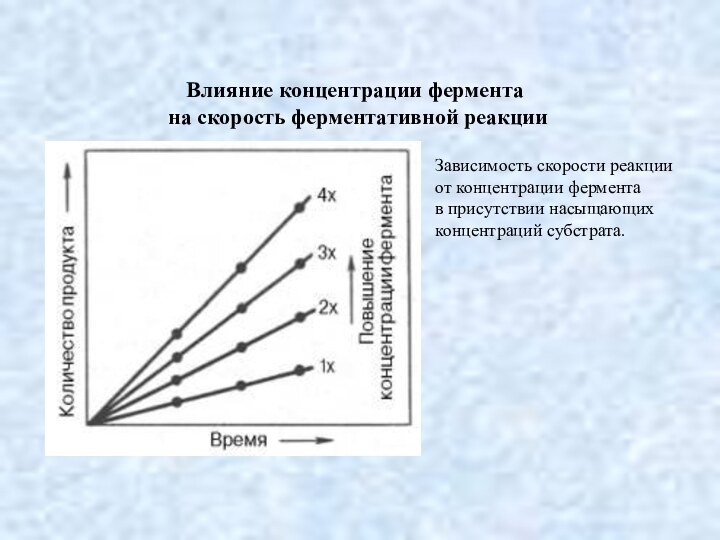
Влияние концентрации фермента
на скорость ферментативной реакции
Зависимость скорости
реакции
от концентрации фермента
в присутствии насыщающих
концентраций субстрата.
Слайд 57
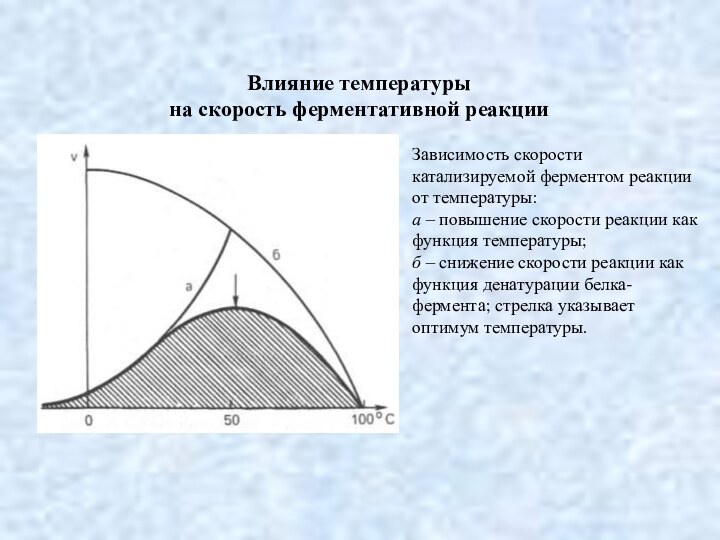
Влияние температуры
на скорость ферментативной реакции
Зависимость скорости катализируемой ферментом
реакции от температуры:
а – повышение скорости реакции как функция
температуры;
б – снижение скорости реакции как функция денатурации белка-фермента; стрелка указывает оптимум температуры.
Слайд 58
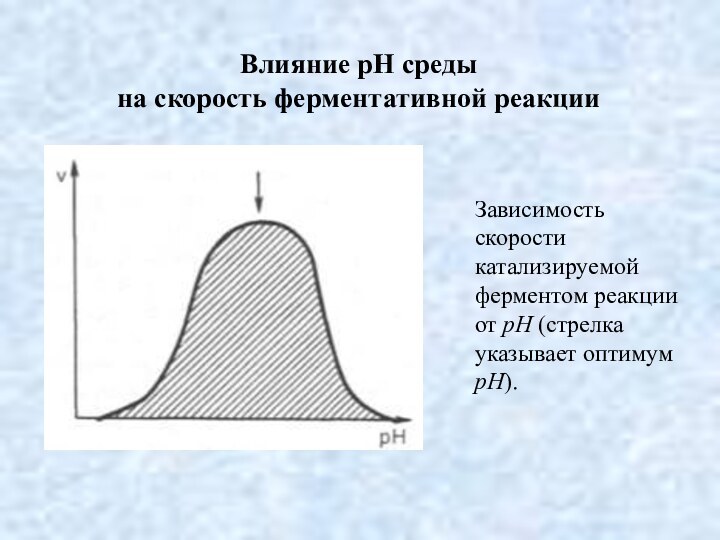
Влияние рН среды
на скорость ферментативной реакции
Зависимость скорости катализируемой
ферментом реакции от рН (стрелка указывает оптимум рН).
Слайд 59
Влияние концентрации субстрата
на скорость ферментативной реакции
Слайд 60
Уравнение Михаэлиса – Ментен
выражает количественное соотношение между
концентрацией субстрата и скоростью ферментативной реакции:
где v – наблюдаемая
скорость реакции при данной концентрации субстрата [S];
KS – константа диссоцации фермент-субстратного комплекса, моль/л;
Vmax – максимальная скорость реакции при полном насыщении фермента субстратом.
Слайд 61
– О количестве ферментов судят по скорости
катализируемой реакции в определенных, согласованных условиях измерения.
– О
скорости ферментативной реакции судят или по скорости убыли субстрата, или по скорости образования продукта реакции.
– За единицу активности любого фермента (Е или U) принимается то количество его, которое в оптимальных условиях катализирует превращение 1 микромоля субстрата или образование 1 микромоля продукта в минуту (мкмоль/мин) .
– 1 катал есть каталитическая активность, способная осуществлять реакцию со скоростью, равной 1 молю в 1 с (1 моль/с).
Определение количественного содержания ферментов
Слайд 62
Регуляция ферментативной активности.
Слайд 63
Примеры активаторов
Активирующее влияние на скорость ферментативной реакции оказывают
разнообразные вещества органической и неорганической природы, например:
– соляная
кислота активирует действие пепсина желудочного сока;
– желчные кислоты повышают активность панкреатической липазы;
– соединения, содержащие свободные SН-группы (глутатион, цистеин), активируют некоторые тканевые ферменты (оксидоредуктазы, катепсины, аргиназу), pacтительную протеиназу и др.
– ионы металлов особенно часто выступают активаторами. Около четверти всех известных ферментов для проявления полной каталитической активности нуждаются в присутствии металлов.
Слайд 64
Необратимое ингибирование
Если ингибитор вызывает стойкие изменения пространственной
третичной структуры молекулы фермента или модификацию функциональных групп фермента,
то такой тип ингибирования называется необратимым.
Необратимое действие ингибитора в самом простом случае может быть описано уравнением:
E + I → EI,
где Е – фермент, I – ингибитор, EI – комплекс.
Слайд 65
При необратимом ингибировании происходит непрерывная модификация молекул фермента,
в результате чего фермент частично или полностью теряет свою
активность. Сюда относят ингибиторы, которые прочно и необратимо связывают функциональные группы активного центра или стойко изменяют валентность металла в активном центре:
1) ингибиторы металлосодержащих ферментов (HCN, KCN, CO, NaN3) – дыхательные яды, т.к. стойко меняют валентность Fe и Cu, препятствуя переносу электронов;
2)вещества, связывающие SH-группы (монойодацетат, соединения ртути и мышьяка);
3) вещества, связывающие ОН-группы серина в активном центре (фосфорорганические соединения, например, диизопропилфторфосфат).
Слайд 66
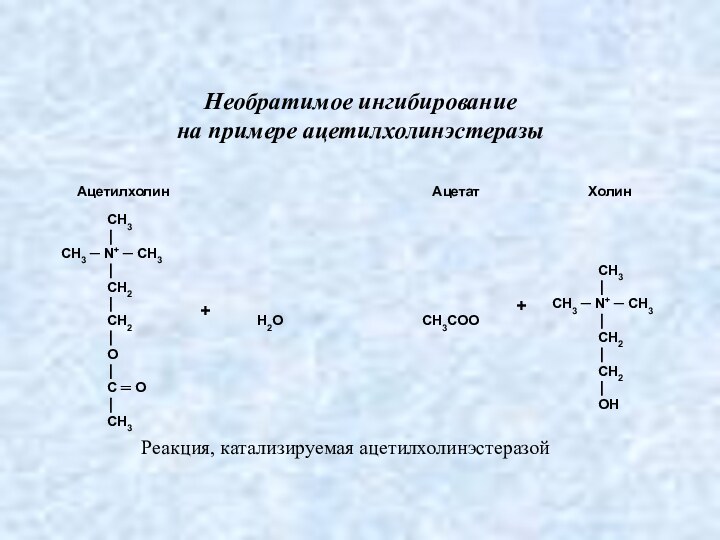
Необратимое ингибирование
на примере ацетилхолинэстеразы
Реакция, катализируемая ацетилхолинэстеразой
Слайд 67
Необратимое ингибирование
на примере ацетилхолинэстеразы
Необратимое ингибирование ацетилхолинэстеразы диизопропилфторфосфатом
Слайд 68
Обратимое ингибирование
В случае обратимого действия ингибитор образует
с
ферментом непрочный комплекс, способный распадаться,
в результате чего снова возникает
активный фермент.
Обратимое действие ингибитора может быть описано уравнением:
E + I ↔ EI,
где Е – фермент, I – ингибитор, EI – комплекс.
Обратимое ингибирование делят на:
– конкурентное,
– неконкурентное.
Слайд 69
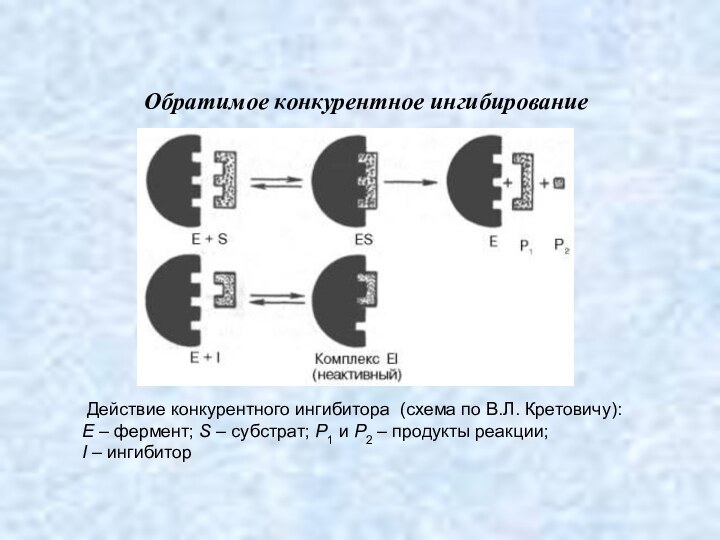
Обратимое конкурентное ингибирование
Слайд 70
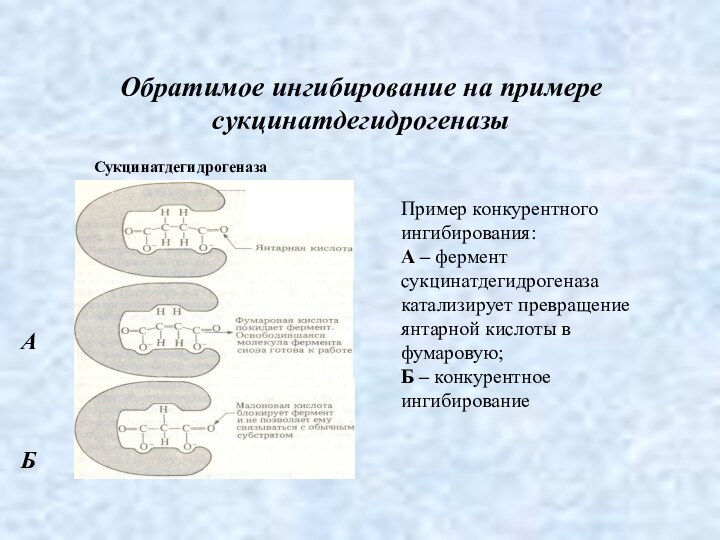
Обратимое ингибирование на примере сукцинатдегидрогеназы
Пример конкурентного ингибирования:
А
– фермент сукцинатдегидрогеназа катализирует превращение янтарной кислоты в фумаровую;
Б
– конкурентное ингибирование
Слайд 71
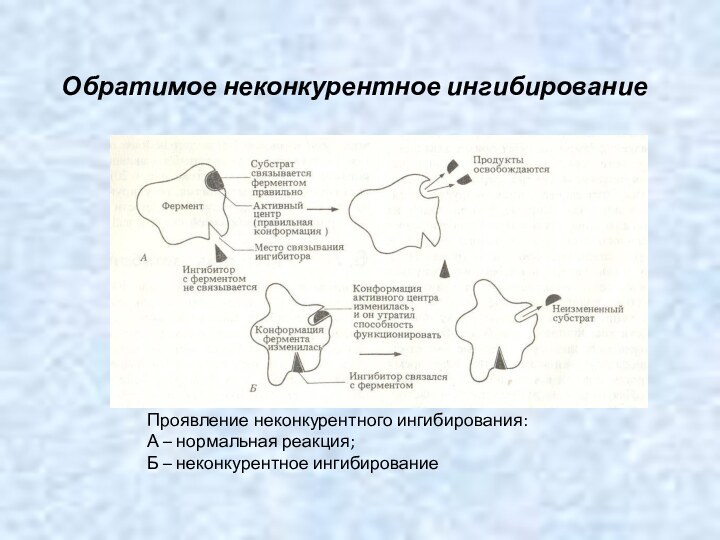
Обратимое неконкурентное ингибирование
Проявление неконкурентного ингибирования:
А –
нормальная реакция;
Б – неконкурентное ингибирование
Слайд 72
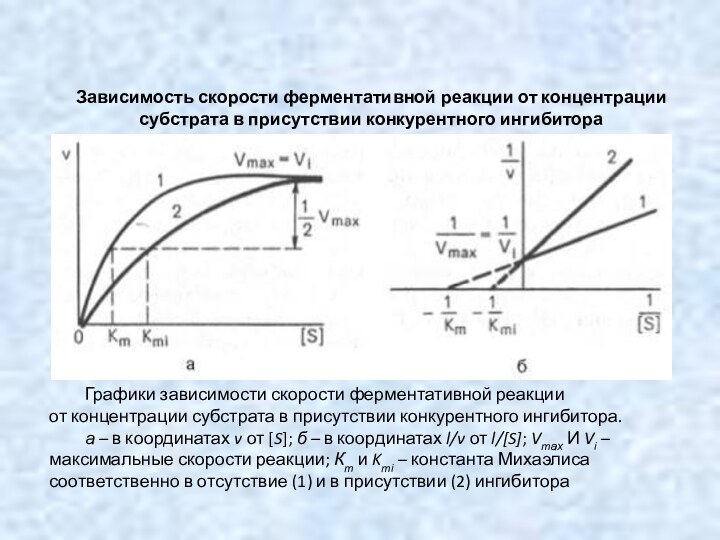
Зависимость скорости ферментативной реакции от концентрации субстрата в
присутствии конкурентного ингибитора
Графики зависимости скорости ферментативной реакции
от концентрации субстрата в присутствии конкурентного ингибитора.
а – в координатах v от [S]; б – в координатах l/v от l/[S]; Vmах И Vi – максимальные скорости реакции; Кm и Kmi – константа Михаэлиса соответственно в отсутствие (1) и в присутствии (2) ингибитора
Слайд 73
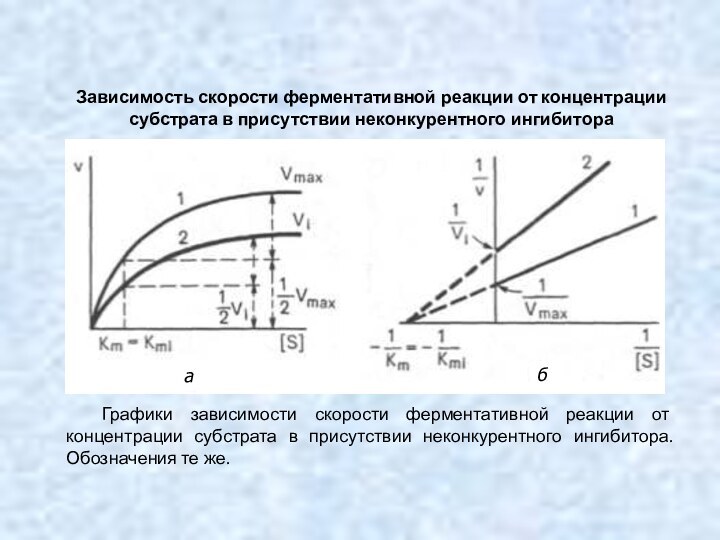
Зависимость скорости ферментативной реакции от концентрации субстрата в
присутствии неконкурентного ингибитора
Графики зависимости скорости ферментативной реакции от концентрации
субстрата в присутствии неконкурентного ингибитора. Обозначения те же.
а
б
Слайд 74
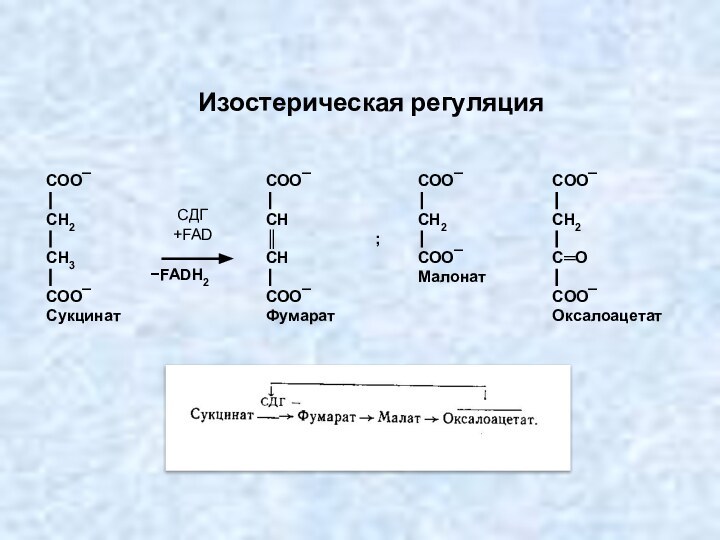
Изостерическая регуляция
СДГ
+FAD
Слайд 75
Аллостерический контроль активности ферментов
Слайд 76
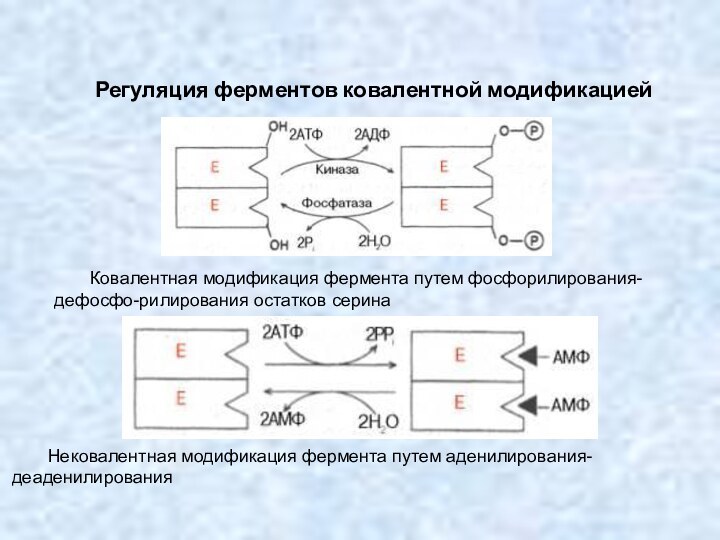
Регуляция ферментов ковалентной модификацией
Ковалентная модификация фермента путем фосфорилирования-дефосфо-рилирования
остатков серина
Нековалентная модификация фермента путем аденилирования-деаденилирования
Слайд 77
Регуляция ферментов ограниченным протеолизом
(активация зимогенов)
Примером подобного активирования
белков является активирование:
– некоторых гормонов (проинсулин → инсулин),
– белка
соединительной ткани (растворимый проколлаген превращается в нерастворимый коллаген),
– белков свертывающей системы крови,
– неактивного пепсиногена в активный пепсин.