Слайд 2
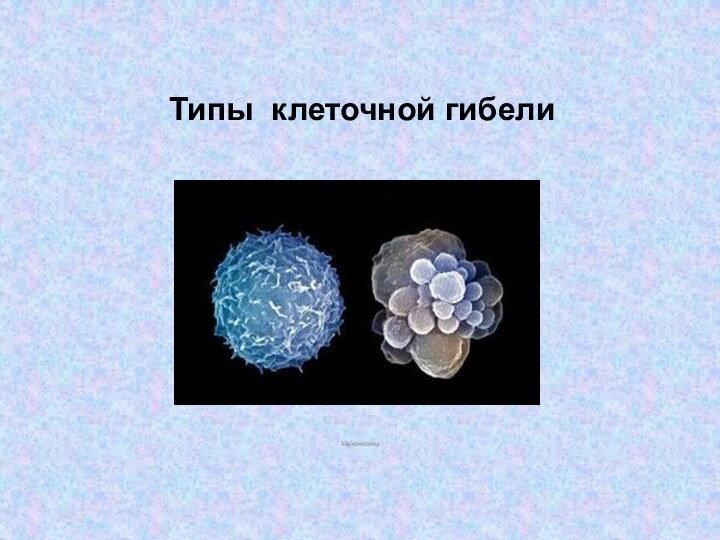
Виды клеточной гибели
Апоптоз
Некроз/некроптоз
Нетоз
Аутофагия
Клеточный каннибализм или энтоз
Митотическая катастрофа
Пироптоз
Корнификация
Партанотоз
Слайд 3
3. Нетоз
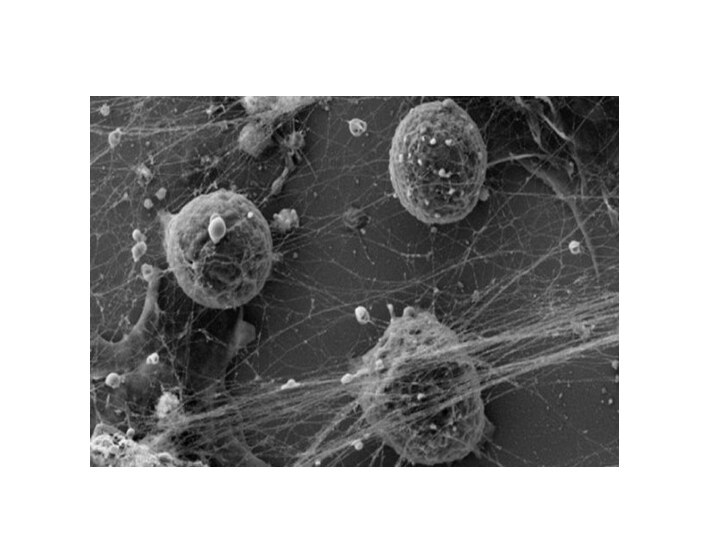
Нетоз – основной тип клеточной смерти нейтрофилов
наравне с апоптозом и некрозом.
В 2004 г. Volker Brinkmann et
al. был открыт механизм, посредством которого нейтрофилы осуществляют защитные функции, названный нетозом (от англ. NETosis (от NET — Neutrophil Extracellular Trap)
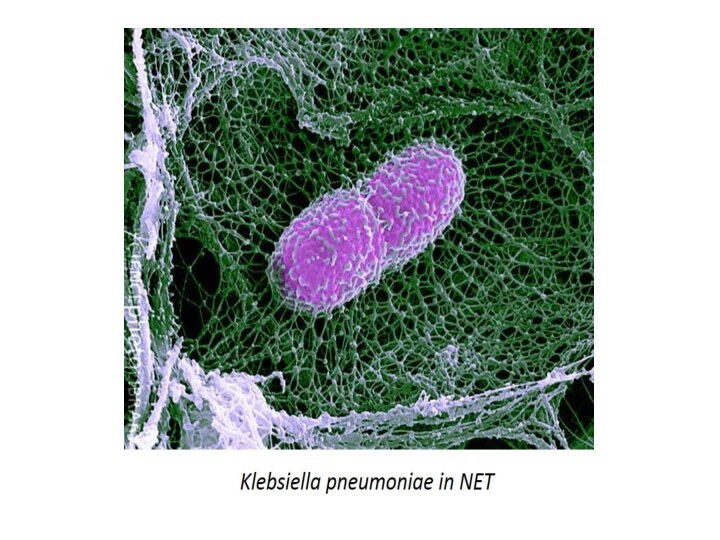
При нетозе нейтрофил проходит стадии 1)деконденсации хроматина, 2)наработки АФК, 3)дегрануляции; затем следует 4)выброс ДНК-сети (ДНК-ловушки), связанной с АФК, гистонами, миелопероксидазой и другими молекулами, повреждающими патоген. Патогены - бактерии, грибы, паразиты и вирусы «запутываются» в сетях и гибнут.
Нейтрофильные ДНК-ловушки связаны с патогенезом различных заболеваний, таких как сепсис, ревматоидный артрит, тромбоз, волчанка и др. аутоиммунные заболевания.
Другие клетки крови, такие как моноциты, эозинофилы, базофилы также имеют подобный механизм, называемый этозом (от англ. ETosis (от ET — Extracellular Trap)
Слайд 6
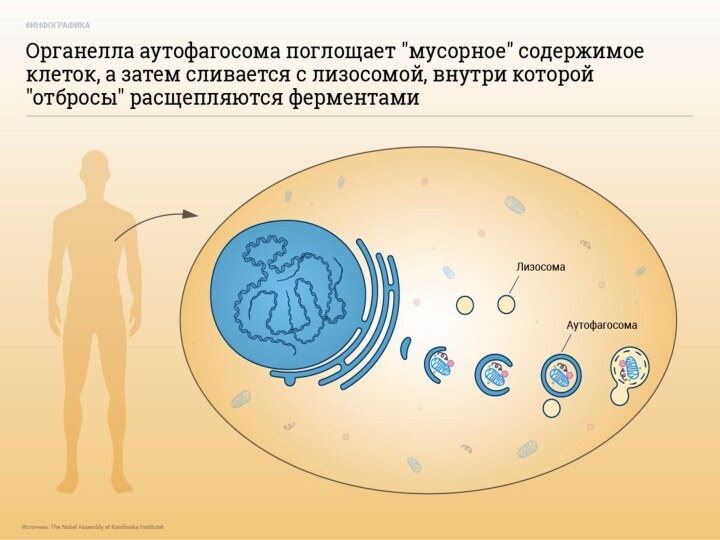
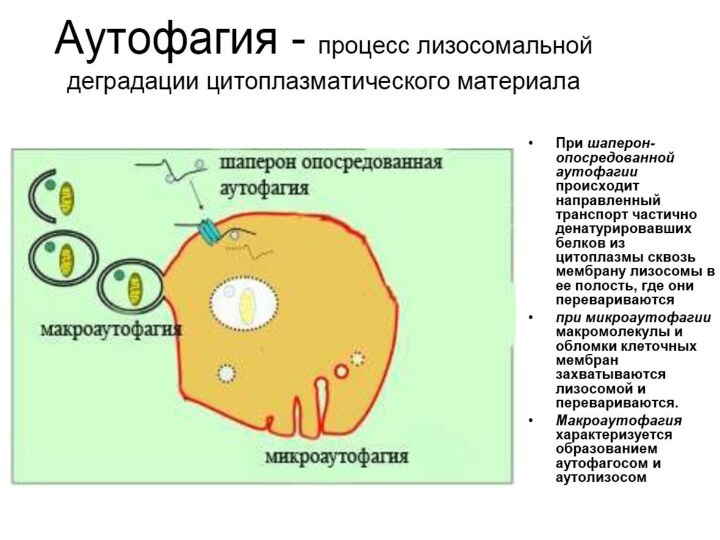
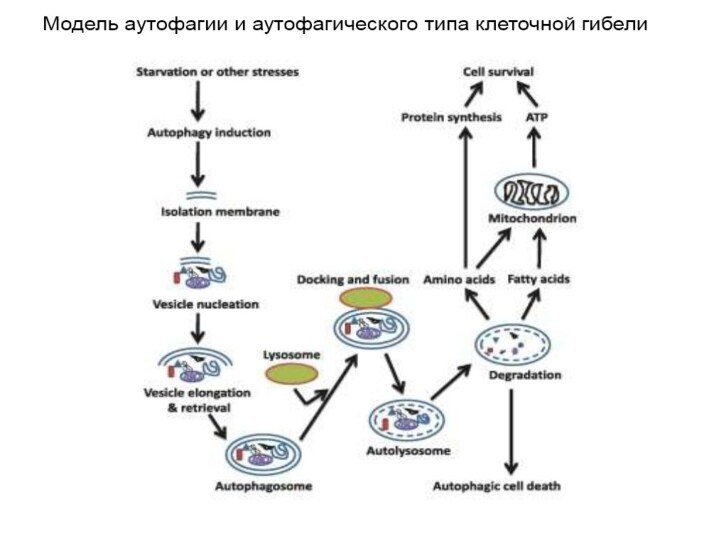
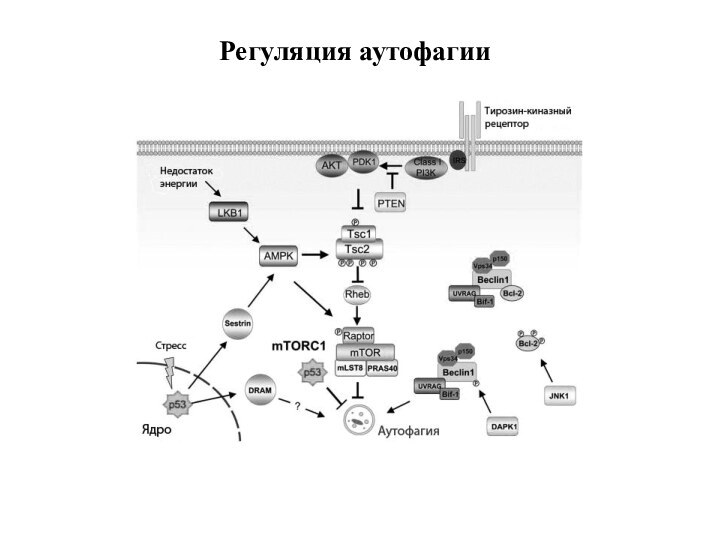
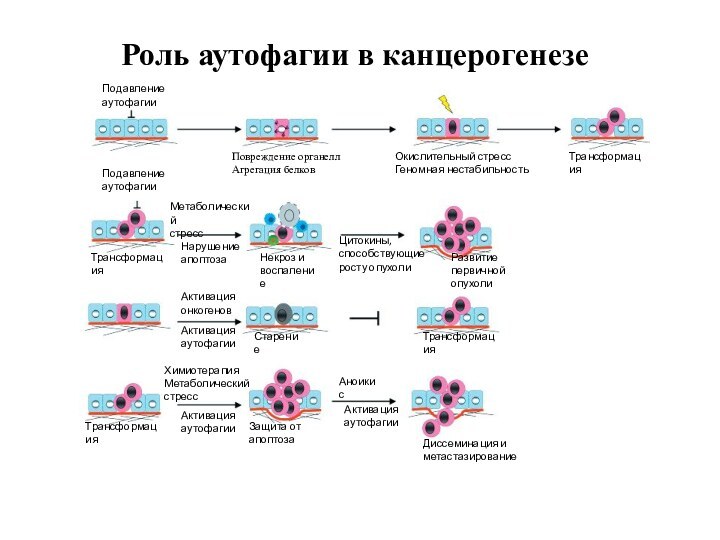
4. Аутофагия
Аутофагия (от греч. αυτος — «само» и φαγειν — «есть»: самопоедание) - клеточный механизм утилизации
избыточных или поврежденных белков, белковых комплексов и клеточных органелл, осуществляемый
лизосомами той же клетки.
Аутофагия выполняет несколько важных функций:
1)получение питательных веществ при голодании,
2)поддержка клеточного гомеостаза и клеточного иммунитета,
3)осуществление апоптоза и др.
Стимулы к запуску аутофагии:
1) отсутствие факторов роста или недостаточность нутриентов
2) наличие поврежденных органелл (митохондрий, пероксисом)
Слайд 7
Лауреатом Нобелевской премии по физиологии и медицине в
2016 году стал Ёсинори Осуми (Yoshinori Ohsumi) "За открытие
механизмов аутофагии".
Слайд 10
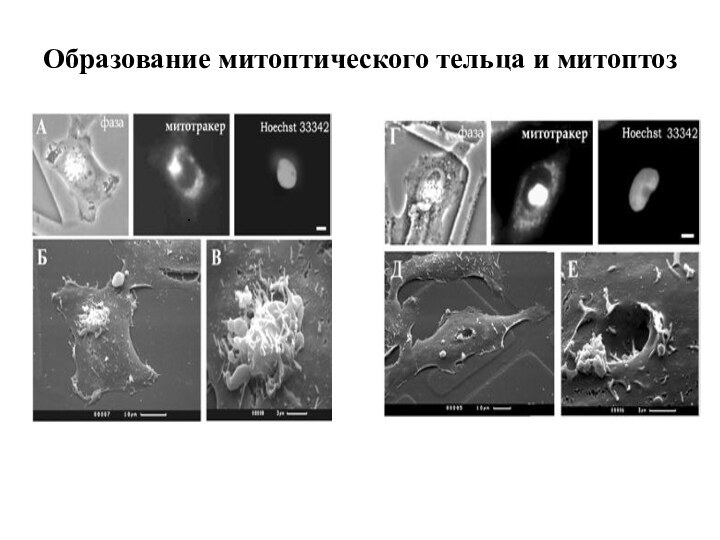
Образование митоптического тельца и митоптоз
.
Слайд 11
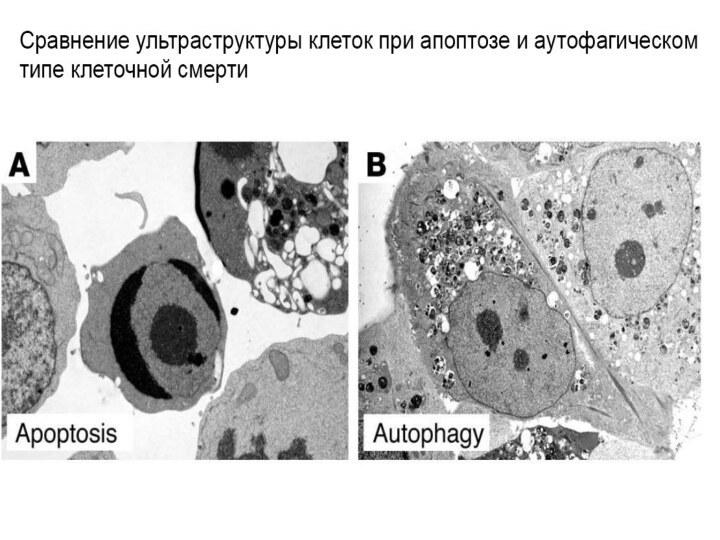
Признаки аутофагии
Частичная конденсация хроматина
Пикноз ядра
Отсутствие фрагментации ядра и
клетки на поздних стадиях гибели
Отсутствие деградации ДНК до нуклеосомного
уровня
Увеличение числа аутофагосом и аутофаголизосом
Увеличение лизосомной активности
Увеличение аппарата Гольджи
Иногда возрастание проницаемости митохондрий
Отсутствие активации каспаз
Слайд 12
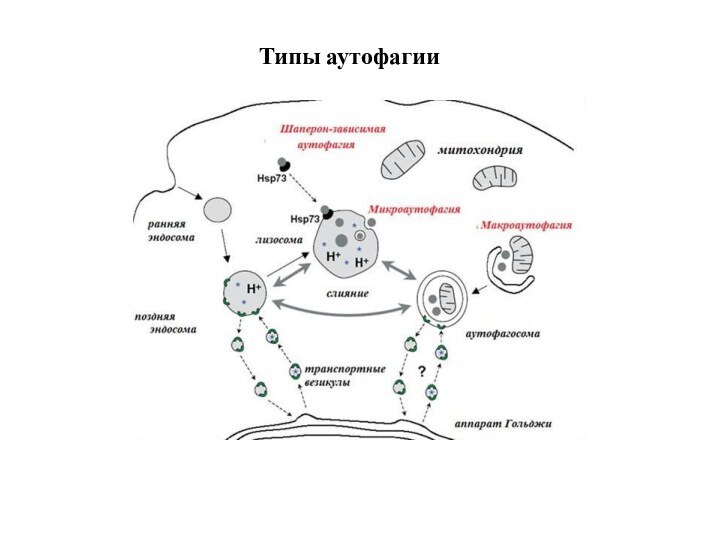
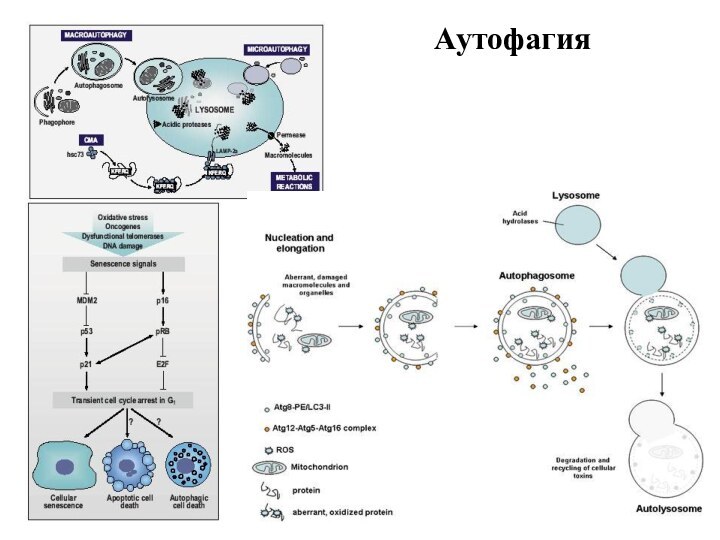
Типы аутофагии
Микроаутофагия – макромолекулы и фрагменты мембраны попадают
в лизосому путем инвагинации ее мембраны.
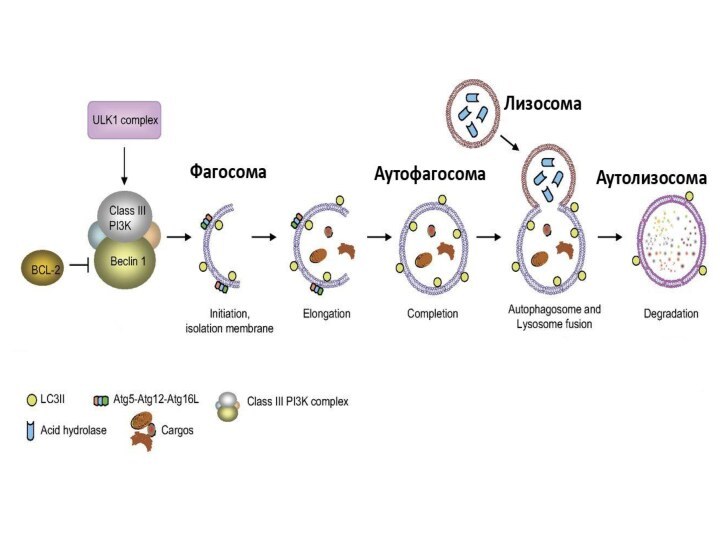
Макроаутофагия - образование аутофагосом,
которые соединяются с лизосомами с образованием аутофаголизосом. Макроаутофагия контролируется специфическими генами Atg (autophagy-related gene) и вовлечена в процесс деградации митохондрий, эндоплазматического ретикулума, пероксисом, рибосом, а также различных белков, липидов и РНК.
Шаперон-зависимая аутофагия – направленный транспорт денатурировавших белков в лизосомы для деградации, происходит с помощью белков-шаперонов Hsp70 и белков LAMP-2 (lysosome-associated membrane protein type 2A).
Слайд 15
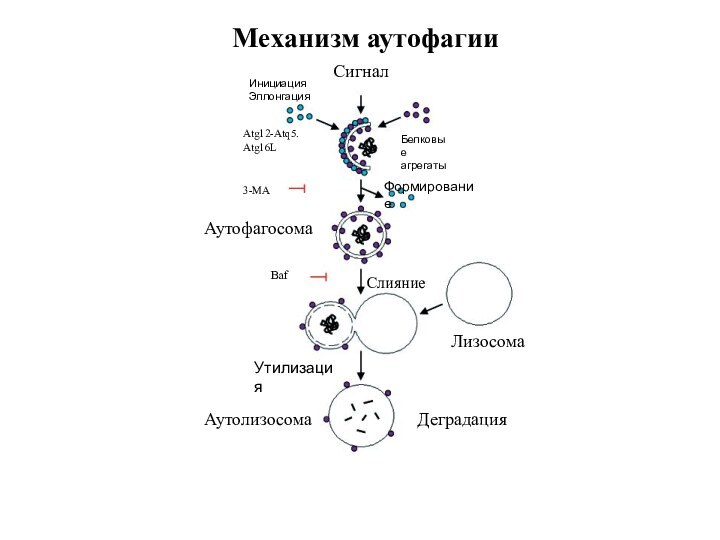
Стадии аутофагии
1.Инициация
2. Элонгация
3. Формирование аутофагосомы
4. Формирование аутолизосомы
Слайд 16
3-MA
Формирование
Сигнал
Инициация
Эллонгация
Белковые
агрегаты
Atg12-Atq5.
Atg16L
Аутофагосома
Слияние
Baf
Лизосома
Утилизация
Аутолизосома
Деградация
Механизм аутофагии
Слайд 21
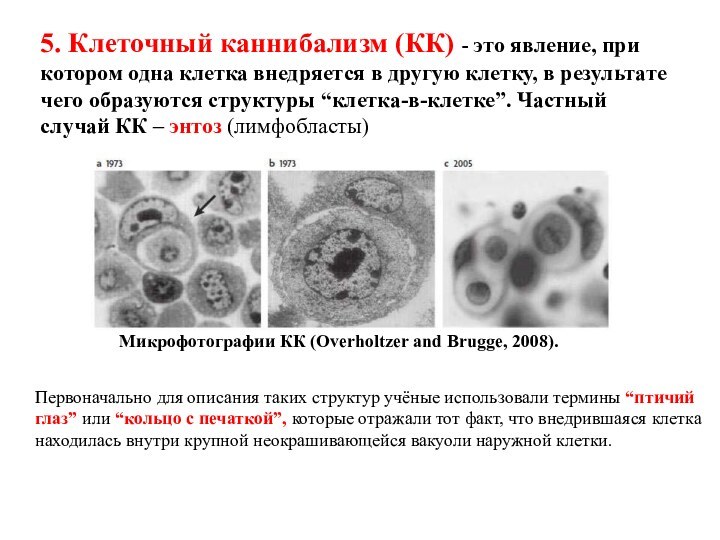
5. Клеточный каннибализм (КК) - это явление, при
котором одна клетка внедряется в другую клетку, в результате
чего образуются структуры “клетка-в-клетке”. Частный случай КК – энтоз (лимфобласты)
Микрофотографии КК (Overholtzer and Brugge, 2008).
Первоначально для описания таких структур учёные использовали термины “птичий
глаз” или “кольцо с печаткой”, которые отражали тот факт, что внедрившаяся клетка находилась внутри крупной неокрашивающейся вакуоли наружной клетки.
Слайд 22
Характеристика клеточного каннибализма
Участниками КК могут быть и нормальные
клетки, такие как нейтрофилы, эритроциты, гепатоциты, мегакариоциты, эпителиальные клетки,
астроциты и др.
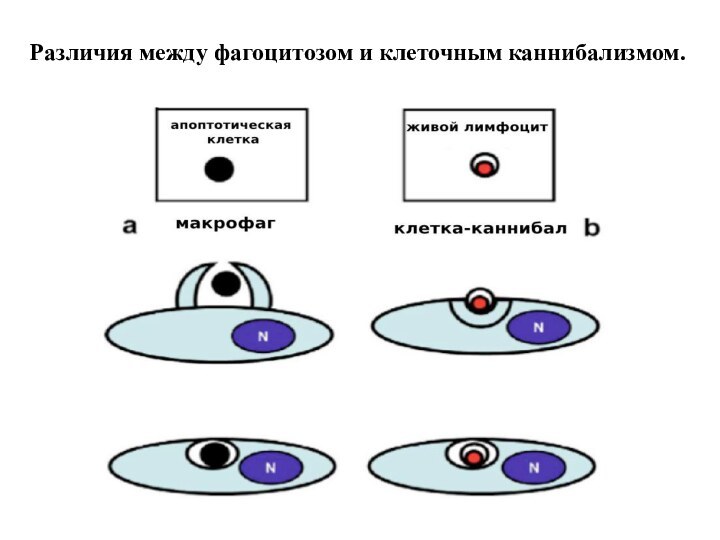
Отличие КК от фагоцитоза: 1)Внедряющиеся клетки живые и могут быть жизнеспособными до 48 час., на них не нет маркёров фагоцитоза. 2) Инициатор внедрения - сама внедряющаяся клетка, в ней происходит активация акто-миозинового комплекса, продавливание плазматической мембраны наружной клетки, локализация внутри крупной вакуоли. 4)Судьба внедрившихся клеток различна: возможны
лизосомальная деградация,
митоз,
выход из каннибалической вакуоли.
КК может использоваться в клинике для диагностики заболеваний и прогноза опухолевой прогрессии. КК может быть маркёром метастатического потенциал опухоли.
Слайд 23
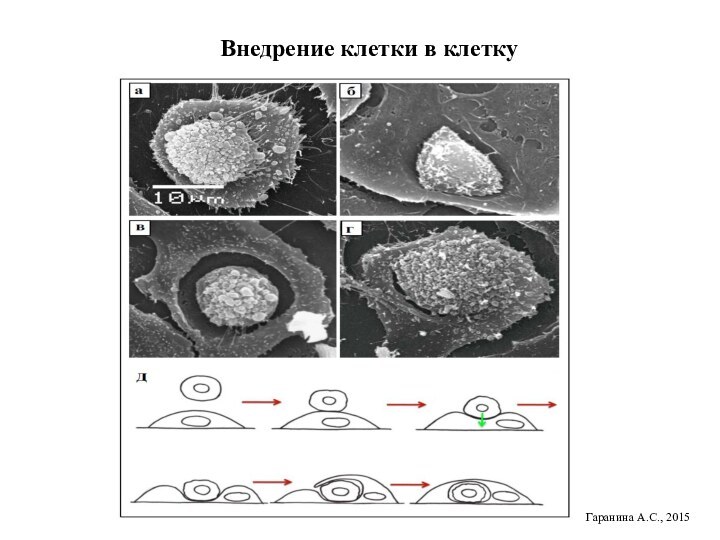
Внедрение клетки в клетку
Гаранина А.С., 2015
Слайд 24
Различия между фагоцитозом и клеточным каннибализмом.
Слайд 25
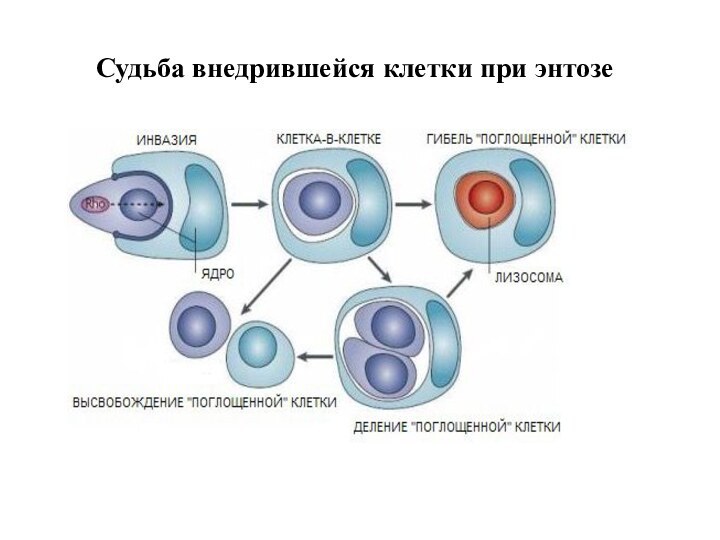
Судьба внедрившейся клетки при энтозе
Слайд 26
Биологическая роль клеточного каннибализма
КК - способ выживания злокачественной
опухоли при неблагоприятных условиях микросреды.
Предотвращение запуска иммунного ответа. КК
позволяет опухолевым клеткам уходить от иммунного ответа (поглощение и деградация НК).
Увеличение плоидности клеток. КК может приводить к анеуплоидии путем нарушения цитокинеза энтозной клетки (признак злокачественного перерождения клетки).
Отбор более агрессивных опухолевых клеток.
Контроль роста опухоли. В опухолевой культуре КК способен регулировать численность и размер клеточных колоний, подавлять рост опухоли, а также элиминировать клетки с какими-либо повреждениями.
Слайд 27
6. Митотическая катастрофа – это гибель клетки в
результате грубых нарушений митоза, таких как отставание хромосом в
мета- и анафазе, К-митозы и др.
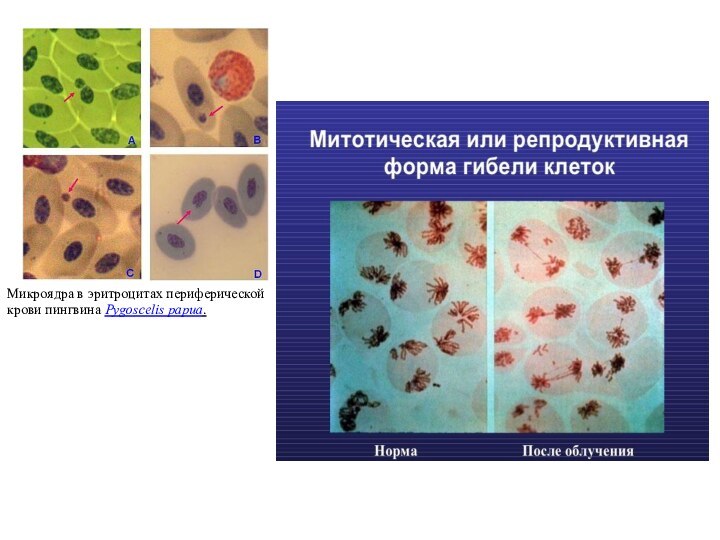
Главный морфологический признак – образование микроядер, в которых нет конденсации хроматина (отличие от апоптоза). Микроядра образуются путем выброса хроматина из интерфазного ядра.
Играет большую роль при действии радиации, применении противоопухолевых препаратов.
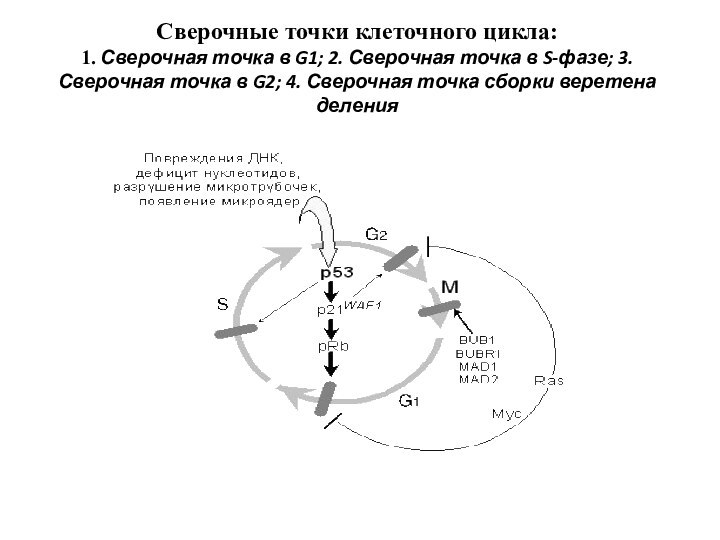
Ингибирование прохождения 2-ой сверочной точки клеточного цикла. Нарушается организация веретена деления и выстраивание хромосом в виде митотической пластинки.
Слайд 28
Сверочные точки клеточного цикла:
1. Сверочная точка в G1;
2. Сверочная точка в S-фазе; 3. Сверочная точка в
G2; 4. Сверочная точка сборки веретена деления
Слайд 29
Микроядра в эритроцитах периферической крови пингвина Pygoscelis papua.
Слайд 30
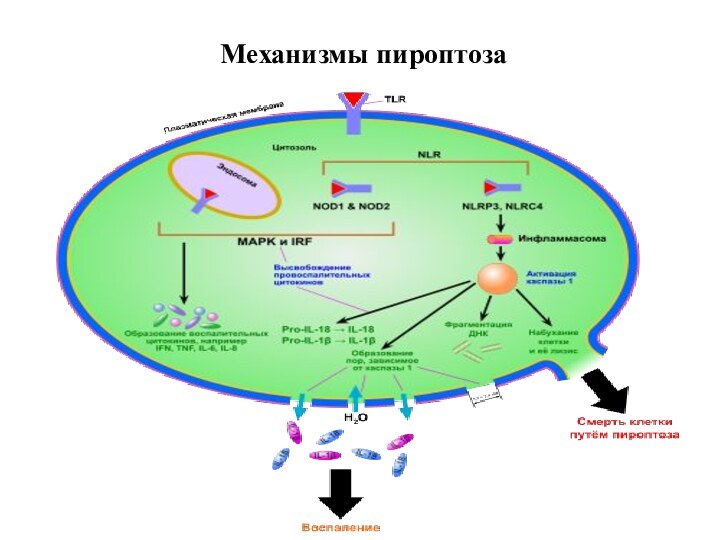
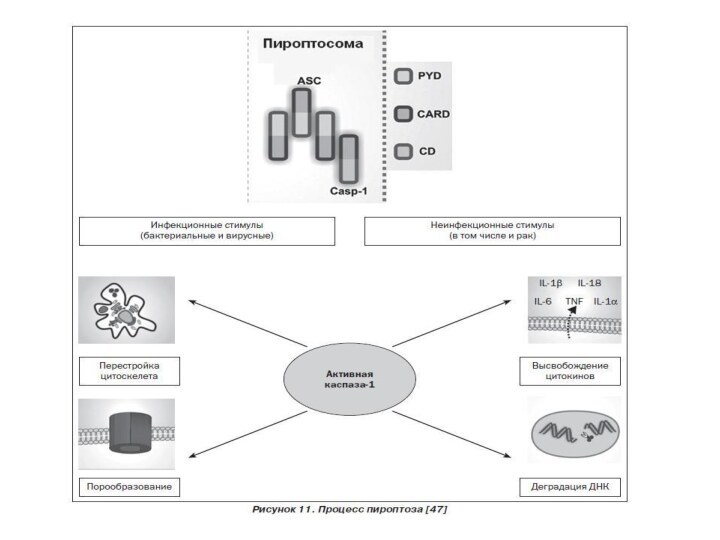
7. Пироптоз – открыт в 2001 году Cookson
и Brennan
Пироптоз — это
запрограммированная гибель клетки, в основе которой лежит образование инфламмасомы и избыточная продукция провоспалительного цитокина IL-1. Пироптоз сопровождает инфекционные процессы, вызванные бактериальными возбудителями. Характерен для моноцитов и макрофагов.
Отличительные признаки пироптоза:
1. Индуцируется каспазой -1
2. Протекает с участием лизосом
3. Наблюдается воспаление
Слайд 31
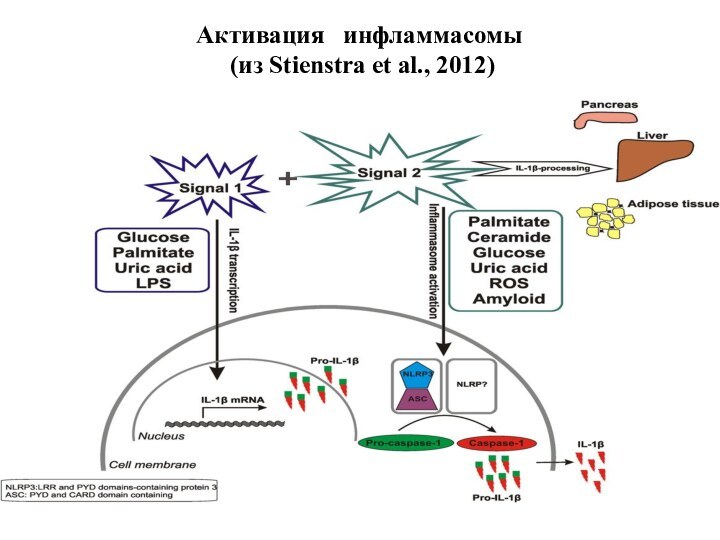
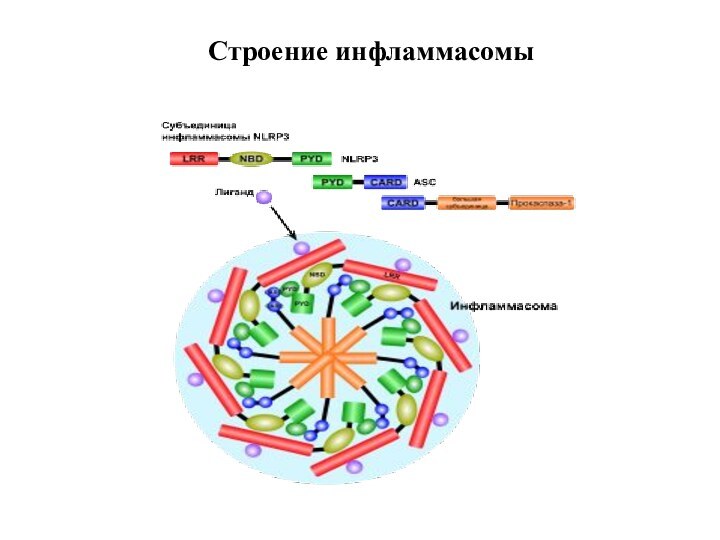
Инфламмасома - сложный белковый комплексй или "платформа", на
которой происходит процессинг (созревание) про-IL-1β с помощью каспазы-1 и
последующая его секреция, что способствует развитию воспаления
Индукторы образования инфламмасомы:
липополисахариды бактериальной стенки
мочевая кислота
АФК
церамид
амилоид
Слайд 32
Инфламмасома
1) Инфламмасома – цитоплазматические белковые комплексы, распознающие РАМР
и DAMP, способствующие активации каспазы-1 и процессингу ИЛ-1β
2) В
состав инфламмасомы входит 22 цитоплазматических NOD-подобных белка, в том числе 14 NLRP белков и др. Различают несколько типов инфламмасом: NLRP1, NLRP3, NLRP4 и др.
3) Мембранные (TLR) и цитоплазматические (NLR) патоген-распознающие рецепторы взаимодействуют c РАМР и DAMP и активируют 2 типа сигнальных путей:
а) 1-ый путь - активация фактора транскрипции NF-kB, транслокация в ядро и экспрессия генов ЦК сем. ИЛ-1 и др.
б) 2-ой путь – сборка инфламмасомы путем активация внутриклеточных белков, входящих в ее состав, активация каспазы-1 процессинг ИЛ-1β
РАМР – патоген ассоциированные молекулярные паттерны
DAMP – ассоциированные с повреждением молекулярные паттерны
Слайд 33
Активация инфламмасомы
(из Stienstra et al., 2012)
Слайд 34
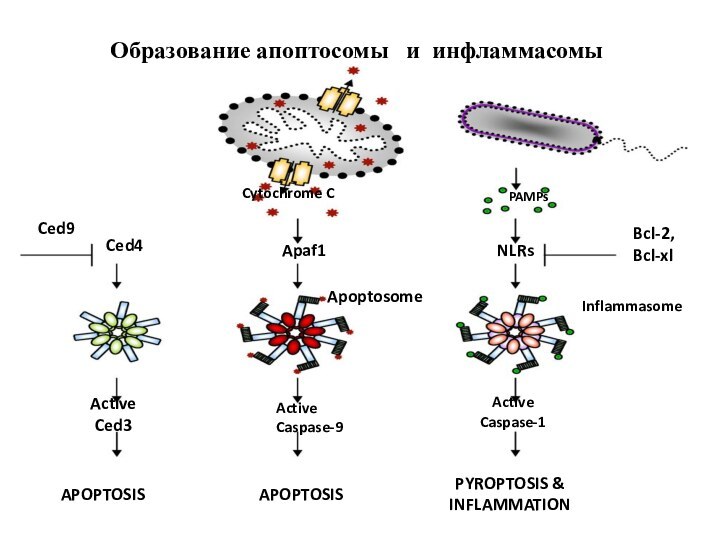
APOPTOSIS
APOPTOSIS
PYROPTOSIS &
INFLAMMATION
Cytochrome C
Apaf1
Apoptosome
Active
Caspase-9
PAMPs
NLRs
Bcl-2,
Bcl-xl
Inflammasome
Active
Caspase-1
Active
Ced3
Ced4
Ced9
Образование апоптосомы и инфламмасомы
Слайд 36
Бета-пропеллер: вид сверху и сбоку
Слайд 39
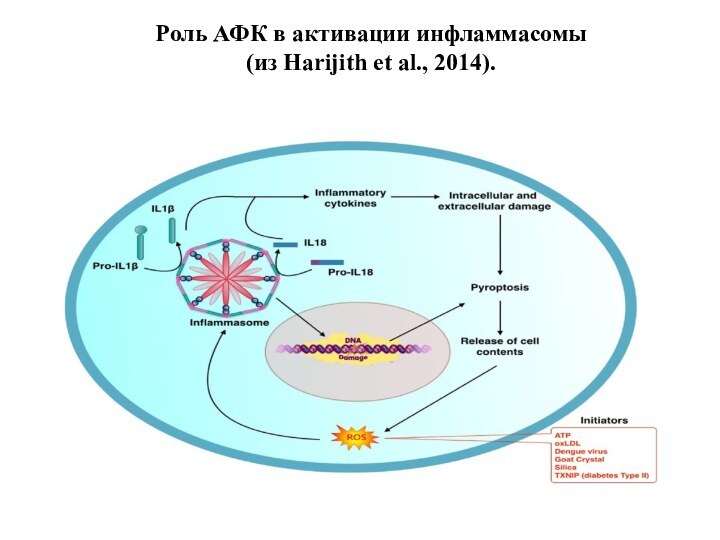
Роль АФК в активации инфламмасомы
(из Harijith et
al., 2014).
Слайд 40
8. Корнификация
Корнификация – физиологическая гибель клеток
внешнего слоя эпидермиса
Корнификация - вариант клеточной смерти.
Признаки:
1) ограничена кератиноцитами;
2) функционально связана с образованием рогового эпителия;
3) необходима для построения эпидермального барьера, позволяющего изолировать организм от окружающей среды;
4) включает активацию трансглутаминаз, которые образуют перекрестные сшивки между специфическими белками.
Слайд 41
9. Партанотоз
Партанотоз – вариант клеточной смерти, зависящей от
активации poly(ADP-ribose)полимеразы (PARPs).
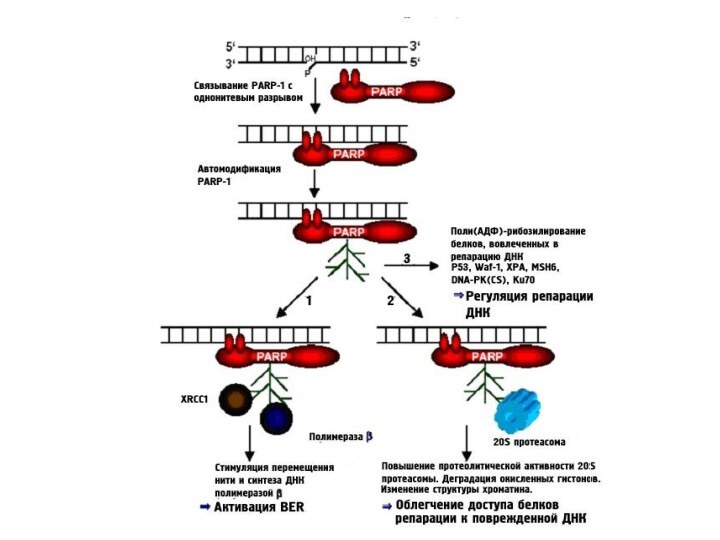
При повреждении ДНК происходит сверхактивация PARP, дефицит
NAD+ и АТР, аккумуляция поли-АДФ-рибозы (PAR), токсичной для митохондрий, → исчезновение митохондриального потенциала и освобождения AIF.
AIF – апоптоз-индуцирующий фактор, который приводит к гибели клетки путем транслокации в ядро и участии в деградации ДНК.
Слайд 44
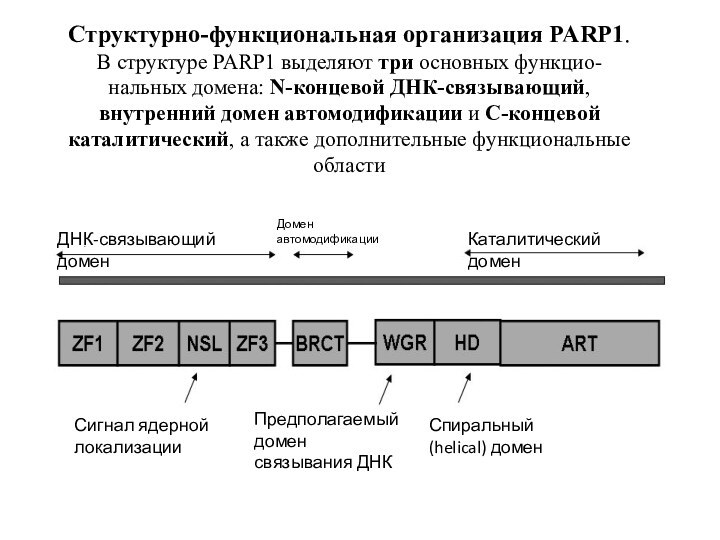
Структурно-функциональная организация PARP1.
В структуре PARP1 выделяют три
основных функцио-
нальных домена: N-концевой ДНК-связывающий, внутренний домен автомодификации и
С-концевой каталитический, а также дополнительные функциональные области
ДНК-связывающий домен
Домен
автомодификации
Каталитический домен
Сигнал ядерной
локализации
Предполагаемый домен
связывания ДНК
Спиральный
(helical) домен
Слайд 45
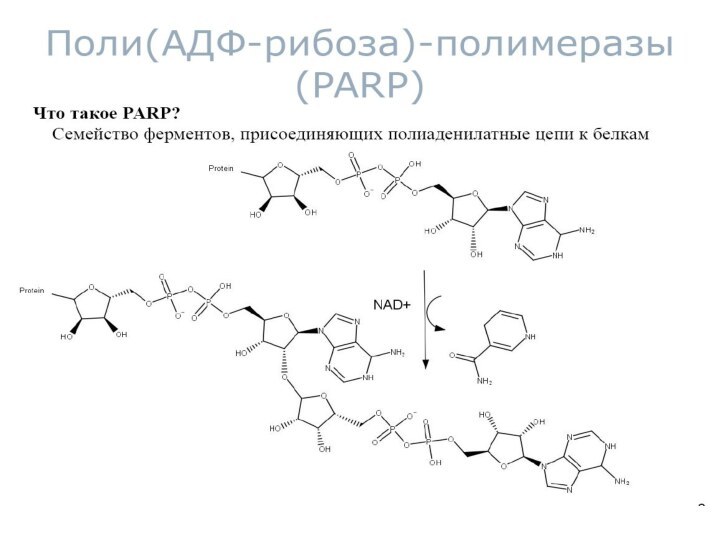
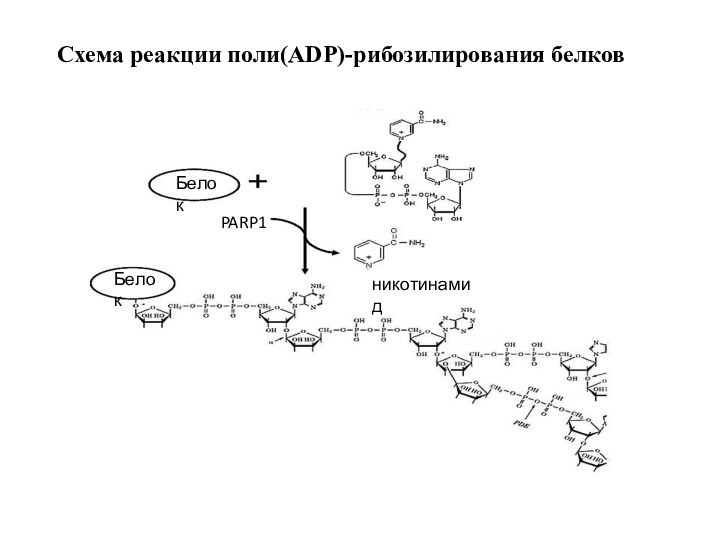
Схема реакции поли(АDP)-рибозилирования белков
Белок
Белок
PARP1
никотинамид
Слайд 46
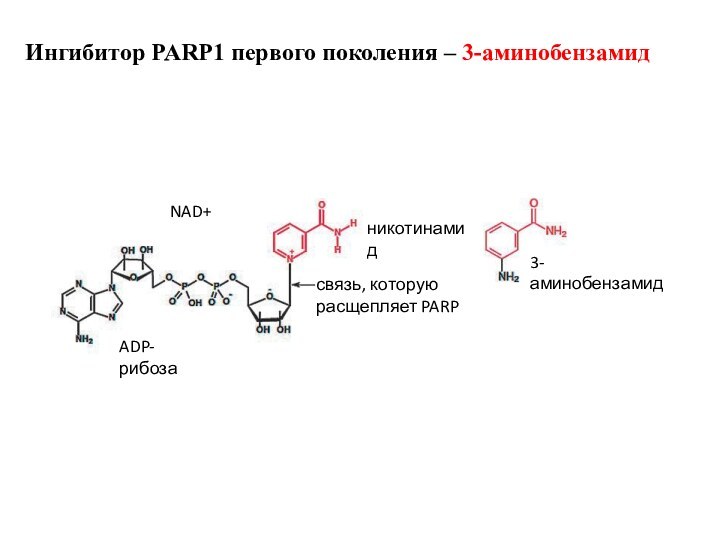
NAD+
ADP-рибоза
никотинамид
связь, которую
расщепляет PARP
3-аминобензамид
Ингибитор PARP1 первого поколения – 3-аминобензамид
Слайд 47
1.Поли(АDP-рибозо)полимераза 1 (PARP1), распространенный ядерный белок (1–2 млн
молекул на клетку), выполняющий функцию «сенсора» разрывов ДНК, -
одна из перспективных молекулярных мишеней для поиска противоопухолевых средств.
2.Экспрессия PARP1 повышена при меланомах, раке легкого, молочной железы и других опухолевых заболеваниях. При этом повышенный уровень экспрессии считается прогностическим признаком, связанным с худшим прогнозом выживаемости.
3.Высокая экспрессия PARP1 и устойчивость опухолей к терапии взаимосвязаны.
4.Ингибиторы PARP1 рассматриваются в качестве перспективных противоопухолевых агентов, действующих как химио- и радиосенсибилизаторы при традиционной терапии злокачественных образований.
5. Ингибиторы PARP1 могут использоваться как самостоятельные лекарственные средства, эффективные при опухолях, в которых нарушены определенные пути репарации ДНК.
Слайд 48
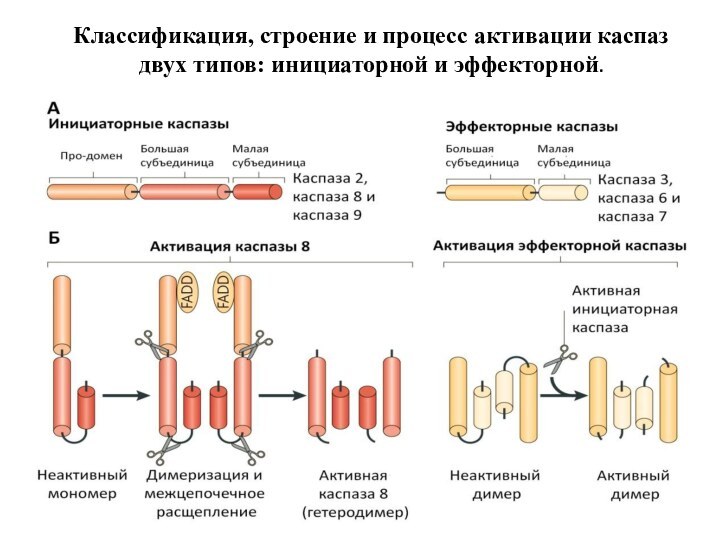
Классификация, строение и процесс активации каспаз двух типов:
инициаторной и эффекторной.