Слайд 2
Состав атмосферы вблизи земной поверхности
Слайд 3
Способы выражения концентрации примесей в воздухе
Объемная
доля – a
a = v / V,
где v – объем примеси, V – объем газа, в котором она находится.
% об. = a * 100
ppm = млн -1 = a * 106
ppb = млрд-1 = a * 109
Слайд 4
Задача.
Превышается ли и, если да, то во
сколько раз, предельно допустимая максимально разовая концентрация для аммиака,
равная- 0,2 мг/м3, при обнаружении его запаха. Если порог запаха для аммиака, по данным зарубежных специалистов, составляет 46,6 ppm. Давление воздуха равно 101,3 кПа, температура 250 С.
Слайд 5
Количество молекул в каждом кубическом сантиметре воздуха
No (Молекул
/см3 ) = N см-3
При нормальных условиях
(Тo =
273оК, Рo = 1 атм. = 101,3 кПа = 760 мм.рт. ст.)
No = 6,02*1023/22,4*103 = 2,69*1019 см-3
При других условиях
Ni = No *Тo*Pi /Ti* Рo
nji = Ni * aj
Слайд 8
Озон в стратосфере образуется в результате взаимодействия отомарного
и молекулярного кислорода в присутствии третьего тела
O + O2
+ M → O3 + M*
где M - любая молекула (обычно азота или кислорода), уносящая из реакции избыток энергии.
И разрушается фотохимически
О3 + hλ → O + O2
Слайд 9
Эти реакции были открыты в 1930 г. Сиднеем
Чепманом
И получили название
ЦИКЛ ЧЕПМАНА
Слайд 10
Разложение озона
О + O3 = 2 O2
Циклические процессы
разрушения озона
Азотный цикл
NO + O3 → NO 2+ O2
O
+ NO2→NO + O2
О + O3 = 2 O2
Слайд 11
Опасность представляют только образующиеся непосредственно в стратосфере оксид
и диоксид азота.
Из тропосферы они не доходят из-за малого
срока жизни.
Исключение гемиоксид азота N2O
Слайд 12
Хлорный цикл
Cl + O3 → ClO + O2
ClO
+ O → Cl + O2
О + O3
= 2 O2
Один атом хлора может разрушить 107 молекул озона.
Слайд 13
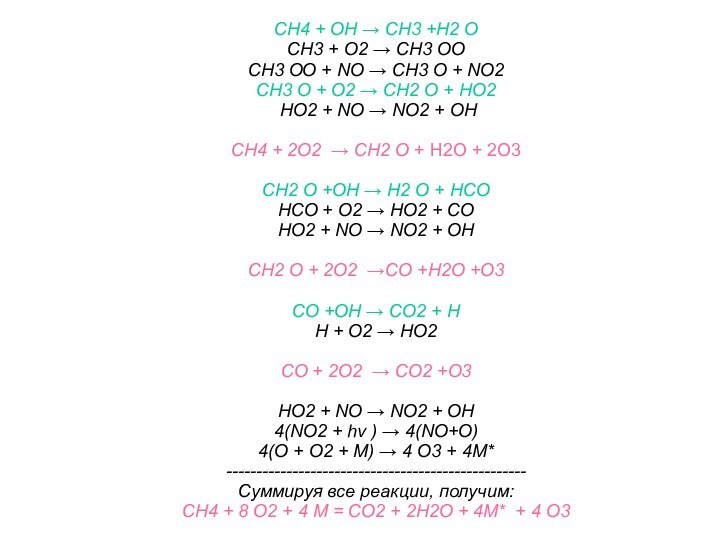
На высоте около 25 км вследствие высокой интенсивности
солнечной радиации происходит разрушение ХФУ (фреонов) с выделением атомов
хлора (Cl) и молекул монооксида хлора (ClO), которые являются более сильными катализаторами процесса разрушения молекул озона, чем оксиды азота
Слайд 14
Нобелевская премия по химии вручается с 1901 года
Крутцен, Роуленд и Молина , Нобелевская премия по химии,
1995
Слайд 15
Нобелевская премия по химии, 1995
«за работу по
химии атмосферы, особенно в связи с образованием и разрушением
озона».
Пауль Крутцен
Марио Молина
Шервуд Роуленд
Слайд 19
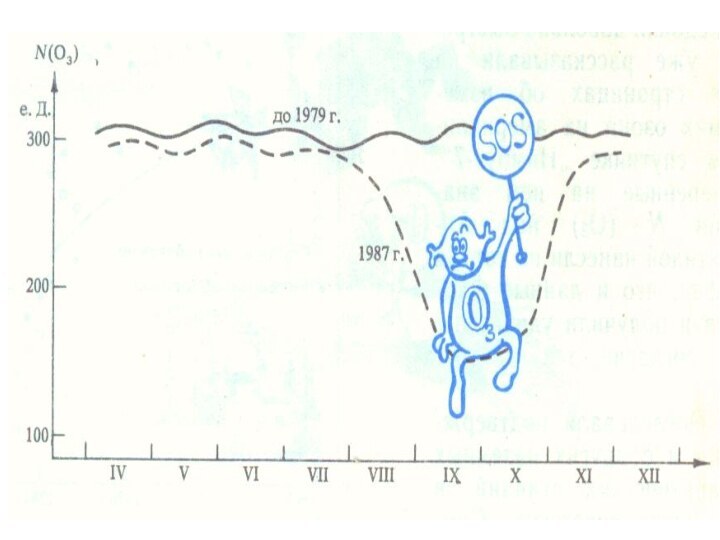
Озоновая дыра диаметром свыше 1000 км впервые была обнаружена
в 1985 годуОзоновая дыра диаметром свыше 1000 км впервые была обнаружена
в 1985 году, на Южном полушарииОзоновая дыра диаметром свыше 1000 км впервые была обнаружена в 1985 году, на Южном полушарии, над Антарктидой, группой британских учёных: Дж. Шанклин (англ.), Дж. Фармен (англ.), Б. Гардинер (англ.), опубликовавших соответствующую статью в журнале Nature), опубликовавших соответствующую статью в журнале Nature. Каждый август она появлялась, а в декабре — январе прекращала своё существование. Над Северным полушарием в Арктике образовывалась другая дыра, но меньших размеров. На данном этапе развития человечества, мировые учёные доказали, что на Земле существует громадное количество озоновых дыр. Но наиболее опасная и крупная расположена над Антарктидой.
Слайд 20
Механизм образования «озоновых дыр»
Антарктида со всех сторон окружена
океаном и ветры могут беспрепятственно циркулировать вокруг континента. Во
время зимы вокруг Антарктиды возникает околополюсной вихрь - своеобразная воронка из ветров, которая собирает воздух над Антарктидой и не дает ему смешиваться с остальной атмосферой.
Слайд 21
Механизм образования «озоновых дыр»
В стратосфере при температуре ниже
-100°С происходит конденсация азотной кислоты, появляющейся в результате взаимодействия
окислов азота и воды. Образуются, так называемые, полярные стратосферные облака. Поверхность мельчайших кристаллов этих облаков катализирует реакции высвобождения хлора из фреонов, соляной кислоты и других галогенсодержащих веществ.
Слайд 22
Механизм образования «озоновых дыр»
В темноте антарктической зимы атомы
хлора не сразу вступают в цепную реакцию по разрушению
озона, а образуют димер оксида хлора.
Cl + O3 >> ClO + O2;
ClO + ClO >> ClO-ClO.
Слайд 23
Механизм образования «озоновых дыр»
Когда наступает весна, солнечная радиация
разрушает накопившийся димер, хлор высвобождается и начинается цепная реакция
разрушения озона. Постепенно околополярный вихрь рассеивается и обедненный озоном воздух перемешивается с нормальным - концентрация озона опять повышается.
Слайд 24
Использование ХФУ( хлорфторуглеродов)
охладители в холодильных установках и
кондиционерах.
для производства поролонов и пенопластов - материалов, широко
используемых во многих потребительских товарах, начиная от одноразовой пенопластовой посуды и заканчивая изоляционными материалами.
в баллонах для распыления аэрозолей
для промывания электрооборудования.
Слайд 25
Озоноразрушающий потенциал некоторых веществ
(CFC обозначает «хлорфтороуглерод»):
Слайд 26
В 1987 года представители 24 стран в Монреале
подписали соглашение, по которому обязались сократить вдвое использование озоноразрушающих
ХФУ к 1999-му году.
Однако в связи с ухудшающейся ситуацией в 1990-м году в Лондоне были приняты поправки к Монреальскому протоколу.
Согласно Лондонским поправкам в список регулируемых ХФУ вошли еще 10 веществ и было принято решение прекратить использование ХФУ, галогенов и четыреххлористого углерода к 2000-х тысячному, а метилхлороформа - к 2005-му году
Слайд 27
В Монреале была принята система, по которой озоноразрушающие
вещества подразделялись по следующим критериям:
способность разрушать озон
продолжительность их жизни
Слайд 28
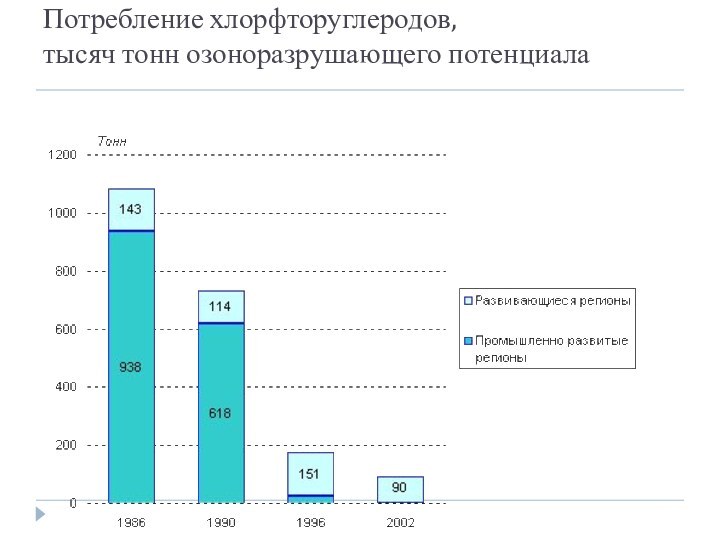
Потребление хлорфторуглеродов,
тысяч тонн озоноразрушающего потенциала
Слайд 29
Весной над Антарктидой одновременно с сильным понижением стратосферного
озона наблюдается рост концентрации монооксида хлора ClO. По максимальным
значениям концентрации ClO в стратосфере над станцией McMurdo в сентябре 1992 г. с учетом площади озоновой дыры рассчитана масса хлороводорода HCl, необходимого для ее образования. Масса HCl составила 9,3 кт. Наиболее вероятным источником такого количества HCl в Антарктиде является вулкан Эребус.
Слайд 30
Аномальное усиление активности вулкана Эребус в начале 80-х
гг. XX в. стало ключевым фактором значительного увеличения антарктической
озоновой аномалииПри стабилизации активности вулкана, хотя по-прежнему достаточно высокой, начиная с 1990 г. и по настоящее время, межгодовые изменения площади озоновой дыры над Антарктидой характеризуются практически нулевым трендом.
Таким образом, чрезмерно высокая активность Эребуса в начале 1980-х гг. фактически перевела антарктическую озоновую аномалию из одного стационарного состояния, при отсутствии или слабом воздействии вулканогенного фактора, в другое, при сохраняющемся значительном уровне вулканогенных выбросов..
Слайд 31
Существенное сокращение антарктической стратосферной озоновой дыры в 2010
году и в течение ряда предыдущих лет — результат
чрезвычайного метеорологического явления, иногда свойственного полярной зиме.
Учёные называют это внезапным стратосферным потеплением (sudden stratospheric warming, SSW).
Слайд 32
В ООН 16 сентября отмечается Международный день охраны
озонового слоя. Он был установлен в 1994 году в
память о подписании Монреальского протокола по веществам, разрушающим озоновый слой.
Подробнее: http://www.rosbalt.ru/style/2014/09/16/1316020.html
Слайд 33
Тропосфера
Тропосфера – нижний, непосредственно соприкасающийся с земной поверхностью,
слой атмосферы. Именно воздухом тропосферы дышат живые организмы, влага,
конденсирующаяся в тропосфере и выпадающая с атмосферными осадками, обеспечивает человека питьевой водой, а проникающее через тропосферу солнечное излучение используется автотрофными организмами в процессе фотосинтеза.
Слайд 34
Концентрация примесей в тропосфере
Слайд 35
Схема трансформации соединений серы в тропосфере
Слайд 37
Схема трансформации соединений азота в тропосфере
Слайд 38
Доля метана, выделяющегося из различных источников, %