Слайд 2
Два подхода к изучению свойств вещества
Молекула
(М)– мельчайшая, самостоятельно существующая частичка вещества, сохраняющая его химические
свойства. М - состоит из атомов. Ar, He – одноатомные молекулы; О2 и N2 – 2-x атомные. А бывают и макромолекулы из тысяч атомов (витамины, белки, гормоны) и точная граница не известна. Размер молекулы воды ~3 Å~3 10-10м.
Молекулярная физика изучает строение и свойства вещества исходя из молекулярно−кинетической теории, базирующейся на трех положениях:
Все вещества состоят из молекул и атомов;
Все молекулы непрерывно и хаотически движутся;
Молекулы взаимодействуют друг с другом.
Слайд 3
Микроскопический и макроскопический подходы
Микроскопический подход – изучает молекулы
и их малые совокупности. Использует законы механики для отдельных
М. Законы механики необходимы, но недостаточны. Но для большого количества молекул возникают принципиально новые закономерности , которые не работают для малого числа молекул. Для их описания и разработаны статистические методы которые развиваются в макроскопическом подходе.
Макроскопический подход – описывает большие совокупности М (термодинамика и статистическая физика) . Статистическая физика описывает свойства макросистем (температуру и давление ) как усредненный (суммарный) результат действия всех молекул. Она интересуется не движением отдельных молекул, а лишь средними величинами, которые характеризуют движение огромной совокупности частиц.
Слайд 4
Термодинамика
Другой подход к изучению свойств вещества
− термодинамический. Термодинамика не интересуется тем, что происходит на
микроуровне. Основой являются фундаментальные законы, называемые началами термодинамики.
Начала термодинамики установлены из опыта, и при этом нет ни одного факта, вступающего с ними в противоречие.
Подходя к рассмотрению изменений состояния вещества с разных сторон, термодинамика и статистическая физика взаимно дополняют друг друга, образуя, по существу, одно целое. Данные подходы дополняют друг друга. Совпадение - критерий правильности.
Слайд 5
Броуновское движение
Броуновским движением называют хаотическое движение
малых частиц, взвешенных в жидкости или газе. Оно было
открыто в 1827 году английским ботаником Броуном. Но количественно объяснить это явление в X1X веке не удалось никому!
Но и качественное объяснение броуновского движения для молекулярной физики исключительно важно, так как является одним из экспериментальных доказательств основного положения молекулярно-кинетической теории – что все молекулы непрерывно и хаотически движутся. Это обусловлено тепловым движением М. Есть силы притяжения и отталкивания.
Слайд 6
Броуновское движение
Изучение движения взвешенных частиц показало, что скорость
движения частиц возрастает с повышением температуры и с уменьшением
размеров частиц. Оказалось, что характер движения не зависит от свойств материала самих частиц, но зависит от свойств жидкости или газа, где они взвешены. Все наблюдаемые особенности движения броуновских частиц качественно легко объясняются именно непрерывным и хаотическим движением молекул среды, в которой движутся эти частицы: различие в количестве и силе ударов молекул с разных направлений дает равнодействующую силу, действующую на частицу и способную ее перемещать ввиду малости частицы.
Слайд 7
Количественная теория броуновского движения
Количественную теорию броуновского движения
удалось создать только Эйнштейну и, независимо, Смолуховскому в 1905
году. Они получили выражение для среднего значения квадрата смещения броуновской частицы за время Δt в зависимости от размеров частицы, вязкости среды и ее температуры. В 1909 году Перрен провел экспериментальную проверку этой формулы и она была полностью подтверждена.
Слайд 8
Броуновское движение
Ланжевен предложил уравнение, описывающее движение броуновской частицы
с учетом соударений частиц
γ- вязкость. Уравнение
используется для изучения флуктуаций молекул в системах, включая неравновесную термодинамику
Слайд 9
Факультативно: Исследователи научились «слушать» броуновское движение
Как «услышать» микромир?
Используем уже упоминавшийся ранее лазерный пинцет! Лазерный пинцет может
удерживать объекты микромира и манипулировать ими. Объекты притягиваются к лазерному лучу, взаимодействуя с создаваемым им электрическим полем. Авторы использовали несколько лучей которые окружали кольцом молекулу.
Звуковые волны, исходящие от объекта, воздействовали на проходящие сквозь толщу воды лучи. Камеры фиксировали изменения лучей. Анализируя информации помог восстановить издаваемые объектами звуки.
Авторам удалось записать звуки, производимые при броуновском движении объектов. В будущем исследователи не исключают, что с помощью новой технологии они смогут услышать, какие звуки издают бактериальные клетки при воздействии лекарственных препаратов.
Слайд 10
Факультативно: Броуновский холодильник
Физики-теоретики утверждают, что возможно построить
крошечный холодильник, которым будет управлять броуновское движение – беспорядочное
движение маленьких частиц, которое происходит при столкновении с окружающими молекулами. Идею предложили Крис Ван ден Брок (Chris Van den Broeck, Hasselt University, Belgium) и Риочи Кавай (Ryoichi Kawai, the University of Alabama, US). Если ее удастся реализовать, то прибор размером с молекулу будет самым маленьким в мире холодильником, который можно будет использован для охлаждения будущих устройств наноразмера.
Сначала был изготовлен микроскопический мотор, который преобразует броуновское движение в механическую работу.
Слайд 11
Броуновский холодильник
резервуаре – это простые лопатки, а в
другом имеют клиновидную форму. Молекулы газа хаотично ударяют по
плоским лопастям и могут поворачивать клиновидные лопасти в сторону острого конца клина. Стержень будет автоматически двигаться в одном направлении, одновременно выравнивая температуру в емкостях или перемещая тепло от сосуда с высокой температурой к сосуду с низкой температурой.
Это стержень, помещенный между двумя емкостями с различной температурой. Лопасти на стержне в одном
Слайд 12
Идеальный газ
Идеальный газ отличается от реального двумя
свойствами: силы взаимодействия между молекулами в идеальном газе равны
нулю (т.е. нет сил Ван-дер-Ваальса и собственный объем молекул идеального газа также равен нулю. Взаимодействие между молекулами такого газа сводится к коротким соударениям твердых упругих шариков. Закон сохранения кинетической энергии выполняется при соударении. А потенциальная мала так как мало время соударения. Плотность газа 10-3 жидкости.
Коротко: идеальный газ – это невзаимодействующие материальные точки. Возможно ли описание реального газа как идеального? Да, если среднее расстояние между молекулами велико, что позволяет пренебречь взаимодействием молекул и их собственным объемом.
Слайд 13
Закон Амедео Авогадро 1811 г.
По соглашению 1960 г.
все сравнивается с 1/12 массы атома изотопа углерода 12С
(mC=1.995 10-26 кг, mC/12=1.66 10-27 кг – а.е.м.- атомная единица массы).
С 1971г. седьмая основная величина моль –единица количества вещества (чуть позже введем еще Кельвин, а Канделлу и Ампер оставим на следующий семестр). Моль - количество вещества, которое содержит столько же структурных элементов (атомов, ионов или молекул), сколько атомов в mмоля С =0,012 кг 12С (1 моль 12С). Оно равно числу Авогадро NA=mмоль С/mC=6,022·1023 моль-1
Закон Авогадро: при одинаковых р и Т в равных V любого идеального газа содержится одинаковое число молей (строго работает только для идеального газа).
Моль придумали химики (у нас СИ ввели в 1982 г. !)
Слайд 14
Атомная и молярная масса
В нормальных условиях t=0o C
и p=1атм=10,1·104 Па объем моля идеального газа Vмоля=RT/p=22,4 л/моль
= (2 ведра/моль)=2,24·10-2 м3/моль, Число молекул в 1 м3–число Лошмидта NL=NA/Vмоля=2.69 1025 м-3
Относительная атомная масса А: отношение массы атома m к 1/12 массе атома 12С: А=Мотн=m/(mC/12).
Молярная масса (масса одного моля)- масса вещества в количестве один моль μ=NAm=NAA mC/12=A mмоля С /12=А 0,012/12=А 10-3 кг/моль=А г/моль. Т.е. когда мы видим в таблице Менделеева А оно численно равно массе одного моля данного вещества в граммах . Чему равна молярная масса? Относительная масса всех химических элементов складывается из относительных масс атомов. 2H+1O => A=2x1.0079 +15.999≈18 => μH2O≈18 г/моль. Моль железа весит 55,847 г и занимает Vмоль Fe=7.09 см3(≈ одна столовая железная ложка!)
Слайд 15
Закон Дальтона 1801
Давление смеси различных газов
равно сумме парциальных давлений отдельных компонент смеси:
p = p1
+ p2 + p3 + …
Парциальным давлением газа, входящего в состав газовой смеси (например, кислорода в воздухе), называется давление, которое оказывал бы газ, если бы он один занимал весь объем, занимаемый смесью.
Закон Дальтона является естественным следствием идеальности рассматриваемого нами простейшего модельного газа: его молекулы «не видят» и «не чувствуют» молекулы других компонент смеси и, следовательно, не мешают друг другу оказывать свое давление.
Слайд 16
Температура
Температура – степень нагретости. Как измерить? Ведь эталона

нет и => используем принцип теплового равновесия. Т.е. предоставляем
две системы , находящиеся в тепловом контакте сами себе. Со временем они придут в состояние теплового равновесия и => их температуры равны. Чтобы измерить давайте одно из тел используем в качестве термометра. Температура связана с изменением средней скорости молекул , а сама температура прямо пропорциональна средней кинетической энергии
Шкалы: Цельсия (при атмосферном давлении интервал между точками таяния льда и кипения воды разделен на 100 частей . Точка таяния льда взята за 00С а кипения 1000С.
Фаренгейта (интервал между точками таяния льда и кипения воды разделен на 180 частей . Точка таяния льда взята за 320F а кипения 2120F , t0С= 5(t0F-320F)/9
Кельвина: t0С=(T-273,15)0K. C большой точностью совпадает со шкалой Цельсия 1С=1К. Названа в честь английского физика У. Томсона – лорда Кельвина, предложившего принцип организации температурной шкалы на основе второго начала термодинамики.
Слайд 17
Закон Бойля-Мариотта
Английский физик Р.Бойль в 1662 и
французский Э.Мариотт в 1676 г. экспериментально установили, что при
Т=const и m=const произведение давления газа p на его объем V есть const:
pV = const
Процесс (при T=const) называется изотермическим. На графике в координатах p-V изотерма представляет собой гиперболу.
Слайд 18
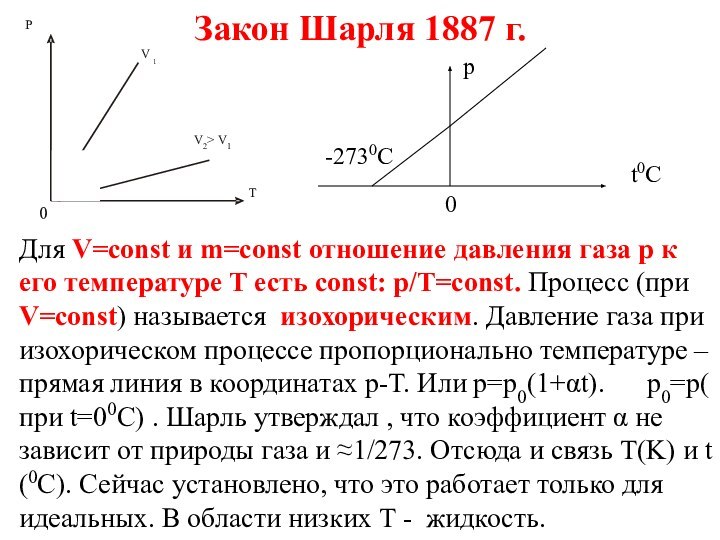
Закон Шарля 1887 г.
Для V=const и m=const отношение
давления газа p к его температуре T есть const:
p/T=const. Процесс (при V=const) называется изохорическим. Давление газа при изохорическом процессе пропорционально температуре – прямая линия в координатах p-T. Или p=p0(1+αt). p0=p( при t=00C) . Шарль утверждал , что коэффициент α не зависит от природы газа и ≈1/273. Отсюда и связь T(K) и t (0С). Сейчас установлено, что это работает только для идеальных. В области низких Т - жидкость.
0
p
-2730C
t0C
Слайд 19
Закон Гей-Люссака 1892г.
Для p=const и m=const отношение объема
газа к его температуре есть const:
β- коэффициент объемного расширения.
V0=V( при t=00C). Процесс изменения состояния системы при постоянном давлении называется изобарическим. По Гей-Люссаку β как и у Шарля одинаков для всех газов и ≈1/273 (в реальности только для идеальных). Французы потрудились , но начал все англичанин Бойль 1662 г. (т.е. 230 лет исследовали!). Как определить на практике идеальный газ ли нет? Если отклонения от этих законов невелики то =>идеальный газ.
Слайд 20
Уравнение состояния идеального газа
p, V и Т
связаны. Изменился один и => изменение двух других. Экспериментальные
уравнения законов Бойля-Мариотта, Шарля и Гей-Люссака можно объединить в одно уравнение:
Из этого уравнения каждый из трех законов получается как частный случай при постоянстве одного из параметров. Это выражение называют уравнением состояния идеального газа. Т.е. математическое выражение, связывающее p, V и T
Слайд 21
Уравнение состояния идеального газа
Найдем значение константы в
уравнении для одного моля газа, обозначив ее буквой R.
Так как объем одного моля Vм при нормальных условиях известен, то значение R находится прямой подстановкой в уравнение
Константа R называется молярной газовой постоянной или универсальной газовой постоянной R. Итак, уравнение состояния для одного моля можно записать:
pVм = RT
Слайд 22
Уравнением Клапейрона-Менделеева
Для произвольной массы M газа умножим
обе части выражения на количество молей M/μ, где μ-молярная
масса данного газа. Учитывая, что Vмоля , умноженное на количество молей есть просто объем газа V, получаем уравнение состояния для произвольнлй массы газа:
Это выражение называют уравнением Клапейрона-Менделеева. Умножим и разделим правую часть уравнения на число Авогадро NA:
Слайд 23
Давление идеального газа
Пусть все М летят в
направлении x (┴ стенки площадью S) одинаковой скоростью vx
и давление на стенку сосуда обусловлено только ударами М. При ударе одной М массы m со скоростью vx изменение импульса стенки Δp=(-mvx)-(mvx)=-2mvx. За единицу времени Δt к единице поверхности долетит nSvxΔt /2 М (делим на 2 так как вторая половина летит назад), находящихся в параллелепипеде длиной vxΔt (n-концентрация М, то есть число М в единице объема). В соответствии со 2-м законом Ньютона изменение импульса стенки Δp за единицу времени Δt равно действующей на нее силе F. Суммарный Δp, переданный стенке, получаем равным:
Δp =FΔt= nmSvx2Δt F= Δp/Δt= nmSvx2
Слайд 24
Давление идеального газа
В системе хаос и все направления
равноправны. Молекулы отклоняются в обе стороны с одинаковой вероятностью.
Просто среднее отклонение =0 и надо работать со среднеквадратичными величинами. Скорость и импульс надо усреднять по 3 направлениям и брать среднеквадратичную скорость . Но так как средние значения квадратов скоростей вдоль трех осей равны то
Но давление p=F/S * и => получим:
Это основное уравнение МКТ- обеспечивает связь макропараметра давления р c микропараметрами и со средним значением квадрата скорости
*- на предыдущей стр. р обозначало импульс не путать!.
Слайд 25
Основным уравнением МКТ
столкновения учитываются не явно
через хаос. Скорости М идеального газа имеют 6 равновероятных
направлений.
давление ≡ импульсу, передаваемому стенке в 1 м2 за 1 с ≡ силе 1 Н действующей на стенку 1 м2. Прибор фиксирует среднюю силу, действующую на ед. площадь.
При р= 1 атм. за одну секунду М испытывает несколько миллиардов столкновений . Т.е. решение даже на современном компьютере сложно => средними значениями. Давление газа можно выразить и через среднюю кинетическую энергию поступательного движения молекул газа :
Обозначили как Е иначе путаница с температурой Т
Слайд 26
Постоянная Больцмана
N=nV – общее число молекул в
массе m газа, а k - постоянной Больцмана:
Поделив обе
части уравнения К-М на объем газа V и учитывая, что отношение N/V=n есть концентрацией молекул газа в единице объема запишем:
Сравнив с выражением для давления газа получим, что средняя кинетическая энергия:
Среднеквадратичная скорость М:
Слайд 27
Степени свободы молекул
Числом степеней свободы системы
называется количество независимых величин, которые задают положение системы в
пространстве.
Положение материальной точки задается тремя координатами, поэтому у нее три степени свободы. Эти три степени свободы соответствуют поступательному движению молекулы по каждому из трех направлений, поэтому и называются поступательными.
Слайд 28
Степени свободы молекул
Чтобы задать положение в пространстве двухатомной
«жесткой» молекулы (у которой расстояние между атомами не меняется)
необходимо 5 независимых величин: три координаты центра масс и два угла, определяющие направление оси молекулы в пространстве. С течением времени углы могут меняться, то есть молекула может и вращаться. Получается, что у двухатомной «жесткой» молекулы 5 степеней свободы, из них три поступательные и две вращательные.
Слайд 29
Степени свободы молекул
Если же атомы в двухатомной
молекуле связаны квазиупруго (расстояние между атомами может меняться), то
для задания ее положения требуется шестая величина – расстояние между атомами. Так как вдоль этой оси молекулы возможны колебания атомов, то данная степень свободы называется колебательной.
У трехатомной не жесткой молекулы 6 степеней свободы – три поступательные и три вращательные.
Слайд 30
Теорема о равнораспределении энергии по степеням свободы
В
статистической физике доказывается теорема о равнораспределении энергии по степеням
свободы молекулы: в состоянии теплового равновесия на любую степень свободы – поступательную, вращательную и колебательную – в среднем приходится одинаковая кинетическая энергия, равная ½kT. Иногда теорему о равнораспределении называют и законом равнораспределения.
Слайд 31
Средняя кинетическая энергия
Но при наличии колебательной степени
свободы возникает важная особенность. Как нам известно из теории
колебаний гармонического осциллятора, его средняя кинетическая энергия колебаний равна средней потенциальной энергии колебаний. Следовательно, при накачке энергии в колебательную степень свободы нам надо будет увеличивать и потенциальную и кинетическую энергию одновременно. Т.е. данная степень свободы обладает удвоенной энергоемкостью: на ее возбуждение требуется энергия, равная kT. Теперь мы можем обобщить выражение для средней кинетической энергии одноатомных молекул на случай и многоатомных молекул:
где число
Слайд 32
Скорость броуновского движения
Физикам удалось экспериментально подтвердить для
броуновских частиц известную теорему о равнораспределении кинетической энергии по
степеням свободы (вернемся к ней позже). Теорема о равнораспределении кинетической энергии по степеням свободы связывает температуру системы и ее среднюю энергию. Для определения энергии частицы достаточно знать ее массу и скорость. Однако броуновские частицы слишком часто меняют направление и скорость своего движения. Ученые опять применили лазерный луч для исследования маленьких стеклянных шариков, плавающих в воздухе (столкновения частиц происходят реже чем в воде). Если определить параметры отражения частицами лазерного луча до того, как происходили столкновения и смогли оценить скорость движения частиц и определить их энергию.
Слайд 33
Из современных исследований
Физики из Франции предложили новый
метод для измерения постоянной Больцмана - с помощью лазерной
спектроскопии. Современные методы позволяют определить ее с точностью до 2x10-6, например, измеряя скорость звука в аргоне. Среди других методов определения k можно назвать измерение шума резистора, определение диэлектрической постоянной газа, а также исследование излучения черного тела. Однако ни один из этих методов не достигает такой точности. Провести новые независимые измерения постоянной Больцмана собираются в МКМВ - Международном комитета мер и весов