- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Электролит ерітінділеріндегі электр тогы. Электролиздің қолданылуы. Электорлиз заңы
Содержание
- 2. Үй тапсырмасына шолу: 1. Металдардың электр бейтарап екенін қалай түсіндіруге болады?
- 3. 2. Металдарда электр тогын нелер тасиды?
- 4. 3. Металдардағы электр тогы дегеніміз не?
- 5. 4. Металдардағы электр тогы электрондардың қозғалысынан туатынын дәлелдейтін тәжірибені сипаттаңдар?
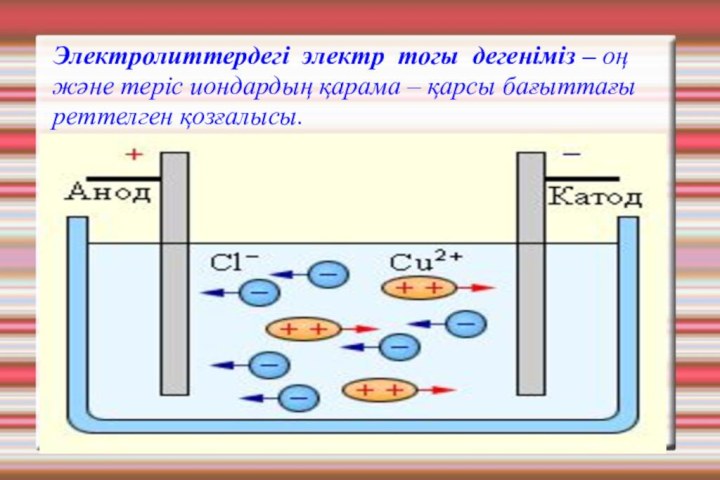
- 6. Электролиттердегі электр тогы дегеніміз – оң және теріс иондардың қарама – қарсы бағыттағы реттелген қозғалысы.
- 7. Электролит арқылы электр тогы өткенде электродтарда зат
- 8. Фарадей заңынан
- 9. Заттың электрохимиялық эквивалентінің сан мәні электролит арқылы
- 10. №616(Кем). Электролиз процесінің нәтижесінде күміс тұзының судағы
- 11. №617(Кем). Мыс тотияйынының ерітіндісі арқылы 20 кКл заряд өтті. Осы кезде катодқа қанша мыс бөлінді?
- 12. №619(Кем). Электорлит арқылы 5 минут ішінде 1,5А
- 13. №620(Кем). Мыс ваннадан 20 минут ішінде 1,98 г мыс бөлінген. Ваннадағы ток күшін табыңдар.
- 14. №1069(Демкович). HCl ерітіндісінің электролизі кезінде катодта белгілі
- 15. №1070(Демкович). Азотты күміс тұзының ерітіндісі арқылы 100 Кл заряд өтсе, катодта қанша күміс бөлініп шығады?
- 16. Қорытындылау:1. Электролиттерге қандай заттарды жатқызады?2. Электролиттік диссоциация
- 17. Скачать презентацию
- 18. Похожие презентации
Үй тапсырмасына шолу: 1. Металдардың электр бейтарап екенін қалай түсіндіруге болады?
















Слайд 5 4. Металдардағы электр тогы электрондардың қозғалысынан туатынын дәлелдейтін
тәжірибені сипаттаңдар?
Слайд 6 Электролиттердегі электр тогы дегеніміз – оң және теріс
иондардың қарама – қарсы бағыттағы реттелген қозғалысы.
Слайд 7 Электролит арқылы электр тогы өткенде электродтарда зат бөліну
процесі электролиз деп аталады.
Ағылшын физигі М. Фарадей 1832 жылы
эксперимент жүзінде мынадай заңдылықты ашты:Электролиз кезінде электродта бөлінген заттың массасы электролит арқылы өткен электр (заряд) мөлшеріне пропорционал.
Бұл заң Фарадей заңы деп аталады.
Слайд 9 Заттың электрохимиялық эквивалентінің сан мәні электролит арқылы 1
Кл заряд өткенде электродтардың біреуінде бөлінетін заттың массасына тең.
Слайд 10 №616(Кем). Электролиз процесінің нәтижесінде күміс тұзының судағы ерітіндісінен
катодта 300 мг күміс бөлінді. Электролиттен өткен зарядшамасын табыңдар.
Слайд 11 №617(Кем). Мыс тотияйынының ерітіндісі арқылы 20 кКл заряд
өтті. Осы кезде катодқа қанша мыс бөлінді?
Слайд 12 №619(Кем). Электорлит арқылы 5 минут ішінде 1,5А ток
өткенде катодтан 137 мг зат бөлінген. Ол қандай зат?
Слайд 14 №1069(Демкович). HCl ерітіндісінің электролизі кезінде катодта белгілі бір
уақыт ішінде 1 г сутегі бөлініп шығады. Осы уақыт
ішінде анодта қанша хлор бөлініп шығады?Слайд 15 №1070(Демкович). Азотты күміс тұзының ерітіндісі арқылы 100 Кл
заряд өтсе, катодта қанша күміс бөлініп шығады?
Слайд 16
Қорытындылау:
1. Электролиттерге қандай заттарды жатқызады?
2. Электролиттік диссоциация дегеніміз
не?
3. Рекомбинация дегеніміз не?
4. Қандай процесті электролиз дейді?
5. Техникада
электролизді қолдпнуға мысалдар келтіріңдер?6. Фарадей заңын тұжырымда?
7. Заттың электрохимиялық эквиваленті дегеніміз не?





























