Беккерель изучал термоэлектричество и флуоресценцию. Его отец, Александр Эдмон
Беккерель - автор основополагающих трудов по фосфоресценции.Сам Антуан Анри также изучал флуоресценцию солей урана.
1 марта 1896 г.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть


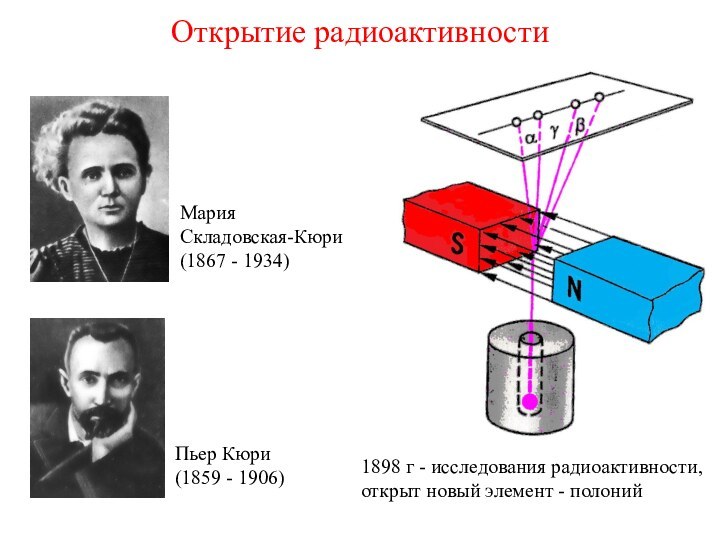
































1 марта 1896 г.
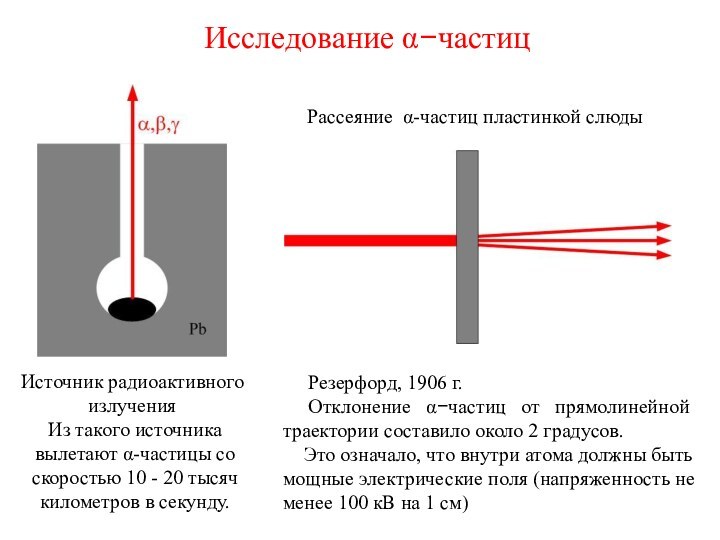
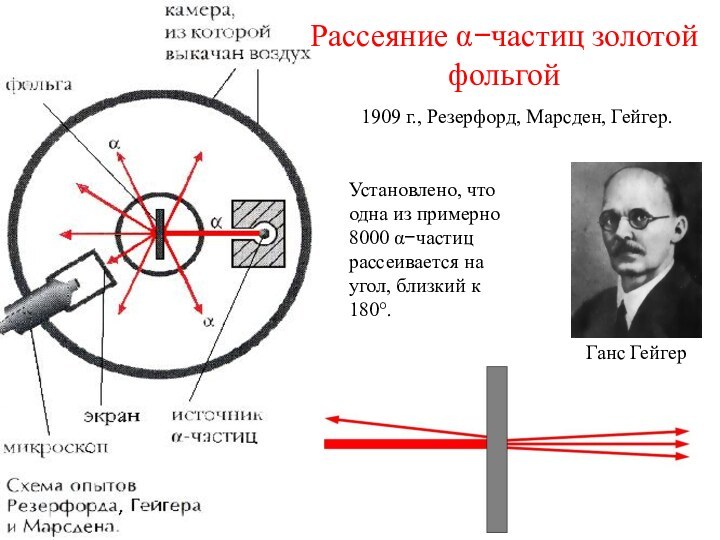
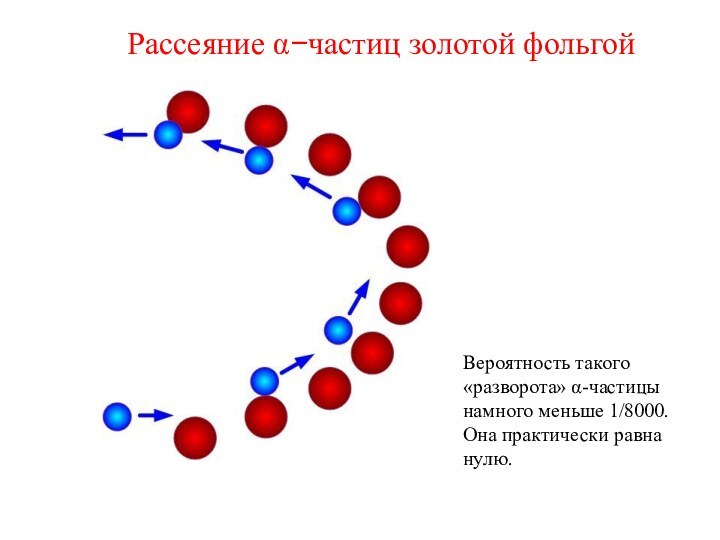
Рассеяние a-частиц пластинкой слюды
Резерфорд, 1906 г.
Отклонение a-частиц от прямолинейной траектории составило около 2 градусов.
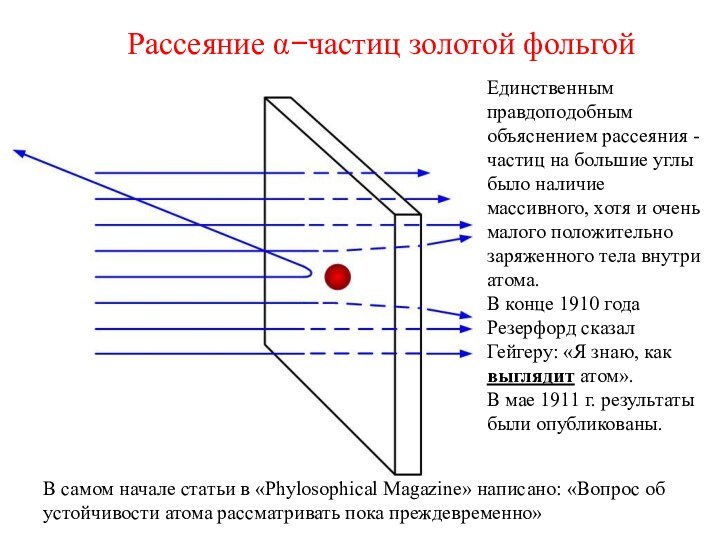
Это означало, что внутри атома должны быть мощные электрические поля (напряженность не менее 100 кВ на 1 см)
В самом начале статьи в «Phylosophical Magazine» написано: «Вопрос об устойчивости атома рассматривать пока преждевременно»
- заряженные частицы, движущиеся с ускорением, должны излучать ЭМВ и поэтому терять энергию, а значит, и скорость;
- в результате электрон должен упасть на ядро.
2. Он обратил внимание на то, что постоянная Планка h имеет размерность (в системе СИ, которой тогда не было, Дж·с), совпадающую с размерностью физической величины, называемой действием.
3. Бор предположил, что все физические величины должны изменяться так, что в ходе любых процессов действие должно быть равно целому числу постоянных Планка h.
4. Основываясь на предположении о квантовании (скачкообразном изменении) действия, Бор предположил, что при движении электрона по орбите вокруг положительного заряженного ядра выполняется условие
2p RmV=nh,
то есть квантуется действие электрона.
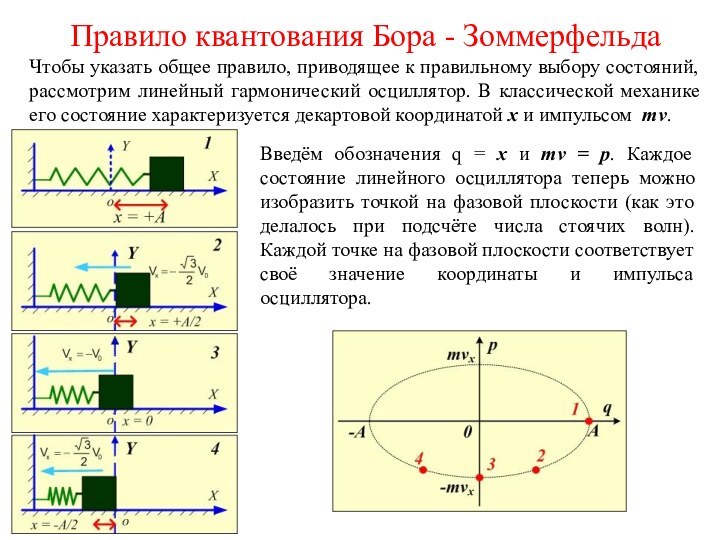
Стоячие волны можно рассматривать, как линейные гармонические осцилляторы. Согласно Планку, из всех возможных состояний линейного гармонического осциллятора осуществляются только такие, энергия которых
где n – целое число.
Перепишем последнее условие в виде
Это означает, что некоторая величина, имеющая размерность [энергия/частота] или [энергия∙время] должна быть кратной постоянной Планка. Эта величина называется действием.
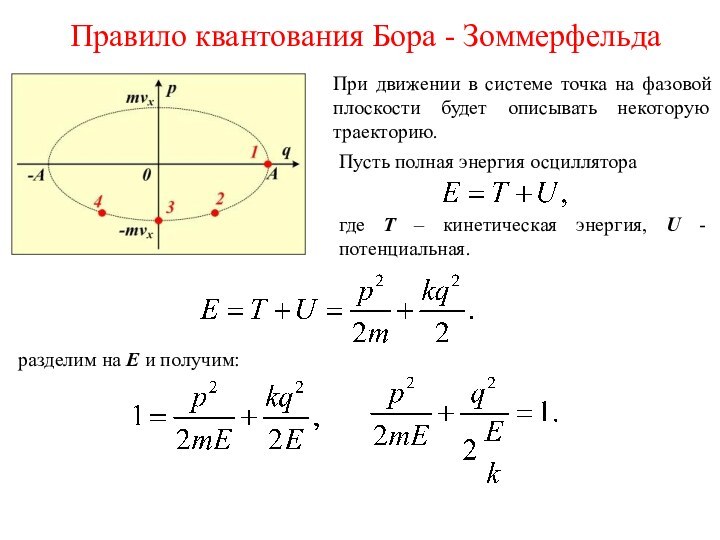
Введём обозначения q = x и mv = p. Каждое состояние линейного осциллятора теперь можно изобразить точкой на фазовой плоскости (как это делалось при подсчёте числа стоячих волн). Каждой точке на фазовой плоскости соответствует своё значение координаты и импульса осциллятора.
где T – кинетическая энергия, U - потенциальная.
разделим на E и получим:
Площадь эллипса равна
По определению, величина
и есть действие для осциллятора.
Правило квантования Бора - Зоммерфельда
получаем, что
Бор стал рассматривать это условие, как общее для всех видов движений с одной степенью свободы (к таким движениям относится и движение электрона в атоме). Возможны только такие фазовые траектории, для которых действие равно nh. Под координатами q и p следует понимать так называемые обобщённые координаты и обобщённые импульсы.
При рассмотрении движения электрона в атоме в качестве координаты удобно выбрать полярный угол φ. В этом случае обобщённым импульсом будет величина pφ = mVr = mr2ω, ω – угловая скорость электрона при движении по орбите. (Легко убедиться, что размерность произведения pφ∙q будет [Дж·с].)
В процессе движения электрона по круговой орбите угловая скорость ω постоянна.
следовательно,
Угол φ меняется в процессе движения от 0 до 2π поэтому,
- орбитальный момент импульса электрона.
Применение правила квантования Бора – Зоммерфельда состоит в следующем:
1. Движение системы описывается при помощи классической механики.
2. Определяются обобщённые координаты и импульс, вычисляется действие системы.
3. Применяется условие, что действие должно быть кратно постоянной Планка.
4. С использованием последнего условия отбираются возможные состояния системы.
Необходимо найти полную энергию электрона, учитывая, то значение его момента импульса может изменяться дискретно, то есть
Полная механическая энергия электрона есть сумма его кинетической и потенциальной энергии
Потенциальная энергия электрона в кулоновском поле ядра
Боровская теория водородоподобного атома
Боровская теория водородоподобного атома
Отсюда
Как было показано ранее
Подставим сюда выражение для скорости V:
откуда
Подставим выражение для радиуса орбиты R в формулу для энергии электрона:
Здесь n – целое число.
Состояние атома с наименьшей энергией (что соответствует n = 1) называется основным состоянием. Энергия основного состояния
Энергию произвольного состояния с любым номером n удобно выражать через энергию основного состояния:
Для атома водорода (Z = 1)
Формула Бальмера - странная, но красивая
м-1.
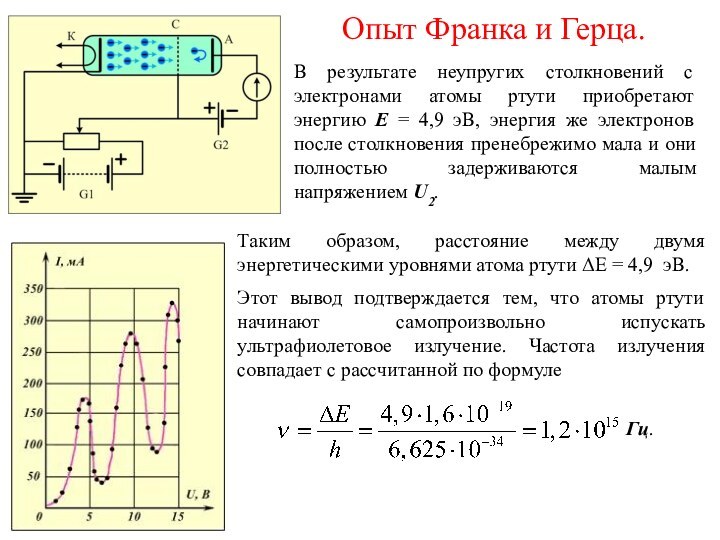
На рисунке показана вольт-амперная характеристика данного устройства.
Возрастание ускоряющего напряжения U от 0 до 4,9 В сопровождается ростом силы тока. С ростом напряжения всё большее число электронов преодолевают область пространственного заряда у катода.
При достижении значения ускоряющего напряжения U = 4,9 В сила тока резко падает.
Электроны с кинетической энергией E = 4,9 эВ полностью теряют её в результате столкновений с атомами ртути.