- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему ЧТО ТАКОЕ ЭЛЕКТРОН?
Содержание
- 2. • é – это частица! m0=0,9109534*10 -27 гZ=1,6021892*10 -19 Кл
- 3. é – волна!Электрон обладает большой СКОРОСТЬЮ
- 4. Местоположение электронов в пространстве в данный момент
- 5. Виды электронных облаков:s-,p- d- f-
- 6. Все электроны атома образуют егоЭЛЕКТРОННУЮ ОБОЛОЧКУ
- 7. ЭЛЕКТРОННАЯ ОБОЛОЧКА ДЕЛИТСЯ НАУРОВНИСЛОИИЗВЕСТНО 7 ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ, РАСПОЛОЖЕННЫХ НА РАЗНЫХ РАССТОЯНИЯХ ОТ ЯДРА
- 9. УРОВНИ состоят из ПОДУРОВНЕЙ, на которых располагаются атомные орбитали s-, p-, d- и f-типа
- 10. 1 уровень – s- подуровень,2 уровень –
- 11. s-подуровень 1 АО р-подуровень
- 12. ПРАВИЛА ЗАПОЛНЕНИЯ ЭЛЕКТРОНАМИ АО, ПОДУРОВНЕЙ, УРОВНЕЙ1) На
- 13. 2) В пределах подуровня атомные орбитали заполняются
- 14. 3) Электроны стремятся занять энергетически выгодное положение
- 15. Σ 1 2
- 16. ЭНЕРГИТИЧЕСКАЯ ДИАГРАММА РАСПОЛОЖЕНИЯ АО В ЭЛЕКТРОННОЙ ОБОЛОЧКЕ
- 17. СХЕМА СТРОЕНИЯ АТОМА Н +1 Показывает распределение электронов по уровням 1
- 18. ЭЛЕКТРОННАЯ ФОРМУЛА (КОНФИГУРАЦИЯ) АТОМА1s1Показывает распределение электронов по подуровням
- 19. Скачать презентацию
- 20. Похожие презентации
• é – это частица! m0=0,9109534*10 -27 гZ=1,6021892*10 -19 Кл


















Слайд 3
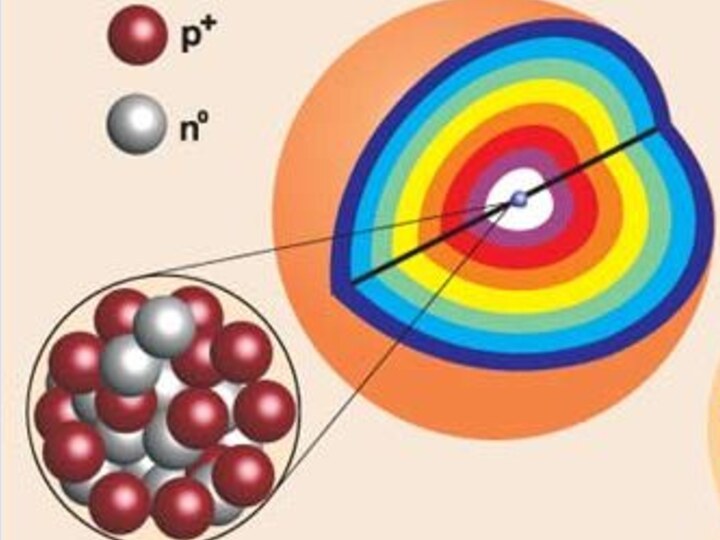
é – волна!
Электрон обладает большой СКОРОСТЬЮ и
ЭНЕРГИЕЙ!
За долю секунды электрон способен «обежать» целую область пространства,
называемуюЭЛЕКТРОННОЕ ОБЛАКО
или АТОМНАЯ ОРБИТАЛЬ
Слайд 4 Местоположение электронов в пространстве в данный момент времени
определить невозможно.
Они ведут себя примерно так, как описал Льюис
Кэрролл Чеширского Кота в сказке «Алиса в стране чудес»:Вроде бы он здесь, но в тоже время его нет, осталась лишь улыбка… (пример с фотографией)
Слайд 7
ЭЛЕКТРОННАЯ ОБОЛОЧКА
ДЕЛИТСЯ НА
УРОВНИ
СЛОИ
ИЗВЕСТНО 7 ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ,
РАСПОЛОЖЕННЫХ НА РАЗНЫХ
РАССТОЯНИЯХ ОТ ЯДРА
Слайд 10
1 уровень – s- подуровень,
2 уровень – s-
и p- подуровни,
3 уровень – s-, p- и d-
подуровни,4 уровень – s-, p-, d- и f- подуровни,
5 уровень
6 уровень
7 уровень
s-, p-, d-, f- … подуровни.
Слайд 11
s-подуровень 1 АО
р-подуровень
3 АО
d-подуровень 5 АО
f-подуровень
7 АОИТАК, имеем
1s2s2p3s3p3d4s4p4d4f5s5p5d5f…
6s6p6d6f…7s7p7d7f…
Слайд 12
ПРАВИЛА ЗАПОЛНЕНИЯ ЭЛЕКТРОНАМИ АО, ПОДУРОВНЕЙ, УРОВНЕЙ
1) На одной
АО могут находиться только ДВА электрона, которые вращаются вокруг
своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами: ↑↓
Слайд 13 2) В пределах подуровня атомные орбитали заполняются одиночными
электронами с параллельными спинами, и когда все орбитали данного
подуровня будут заняты, происходит спаривание последних:↑
↑
↑
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↓
Слайд 14 3) Электроны стремятся занять энергетически выгодное положение в
электронной оболочке, руководствуясь правилом наименьшей энергии расположим АО в
порядке возрастания значений их энергии, которая определяется суммой: ( № УРОВНЯ + число,которое соответствует подуровню)s (0), p (2), d (3), f (4)
Слайд 15 Σ 1 2 3
3 4 5
4 5 6 7 5 6 7 81s2s2p3s3p3d4s4p4d4f5s5p5d5f…
Σ 6 7 8 9 7 8 9 10
6s6p6d6f… 7s7p7d7f…
РЯД НАИМЕНЬШЕЙ ЭНЕРГИИ:
1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p
7s5f6d7p…