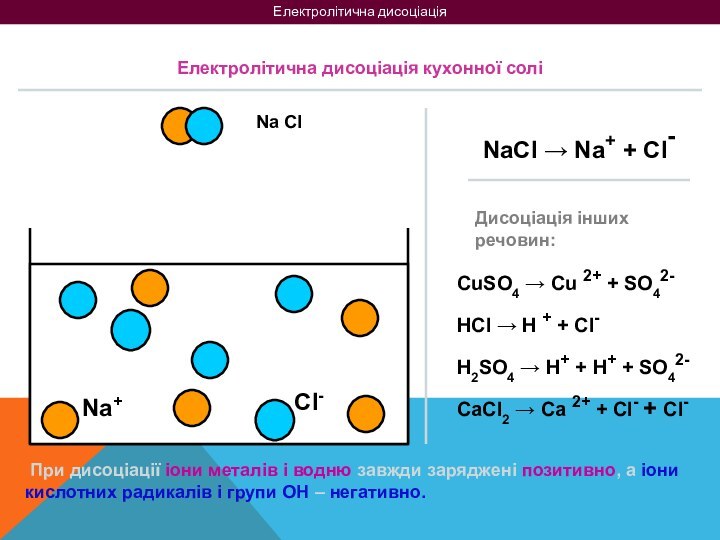
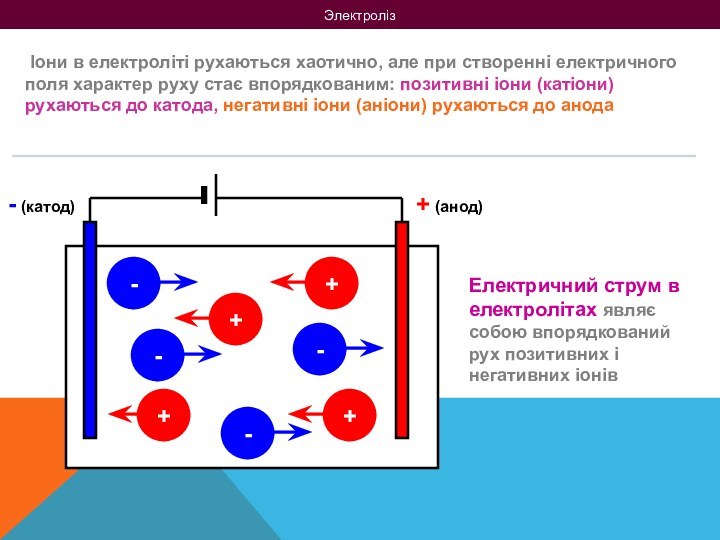
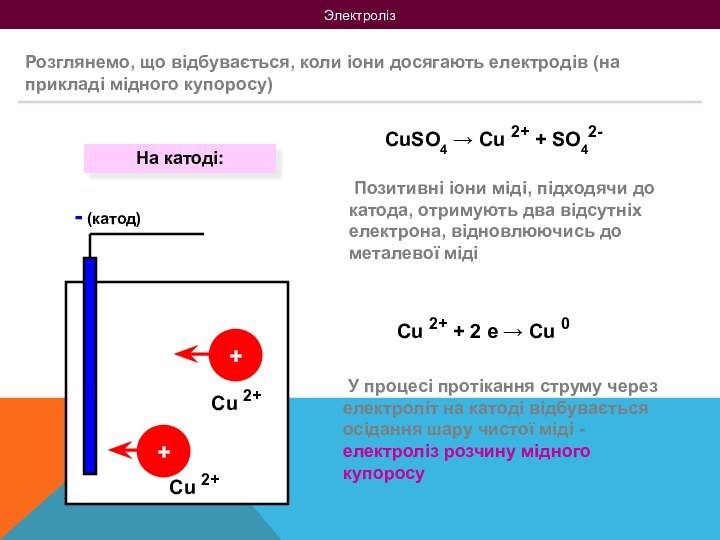
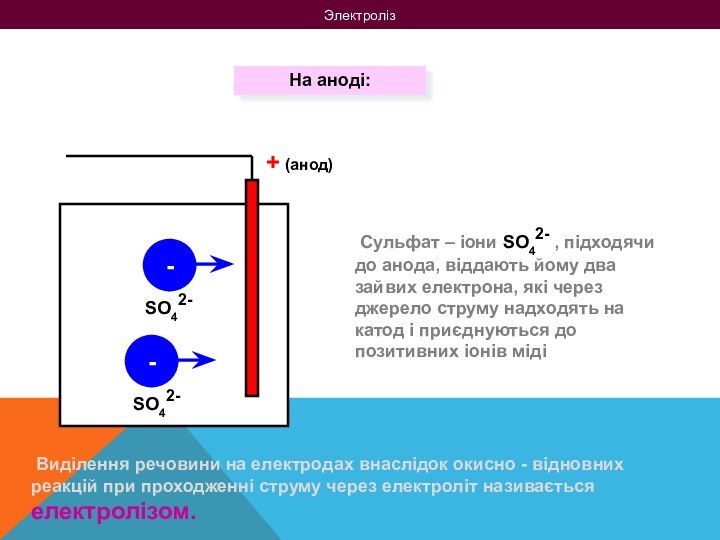
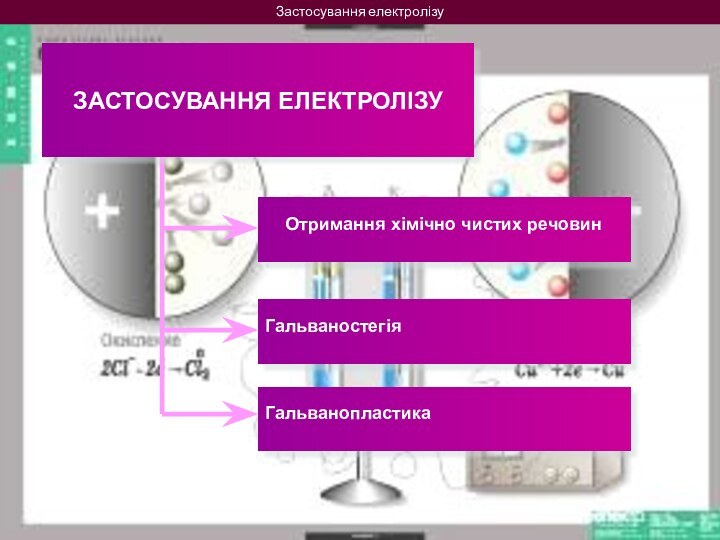
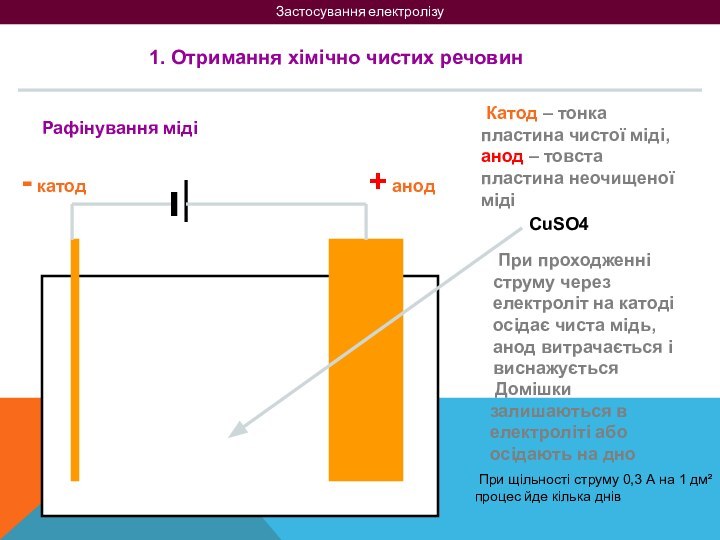
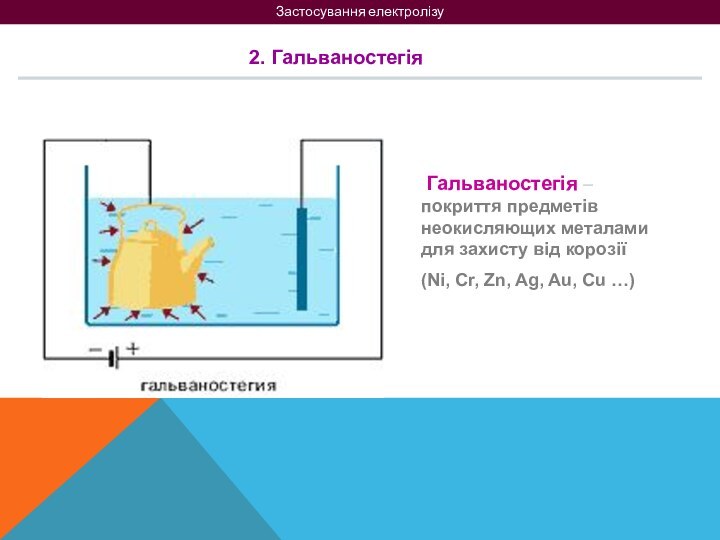
на 2 групи:
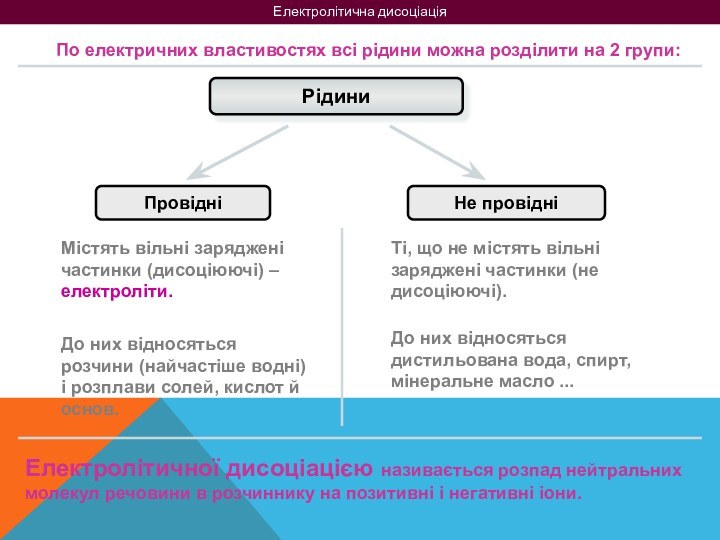
Рідини
Провідні
Не провідні
Містять вільні заряджені частинки (дисоціюючі) –
електроліти.Ті, що не містять вільні заряджені частинки (не дисоціюючі).
До них відносяться розчини (найчастіше водні) і розплави солей, кислот й основ.
До них відносяться дистильована вода, спирт, мінеральне масло ...
Електролітичної дисоціацією називається розпад нейтральних молекул речовини в розчиннику на позитивні і негативні іони.