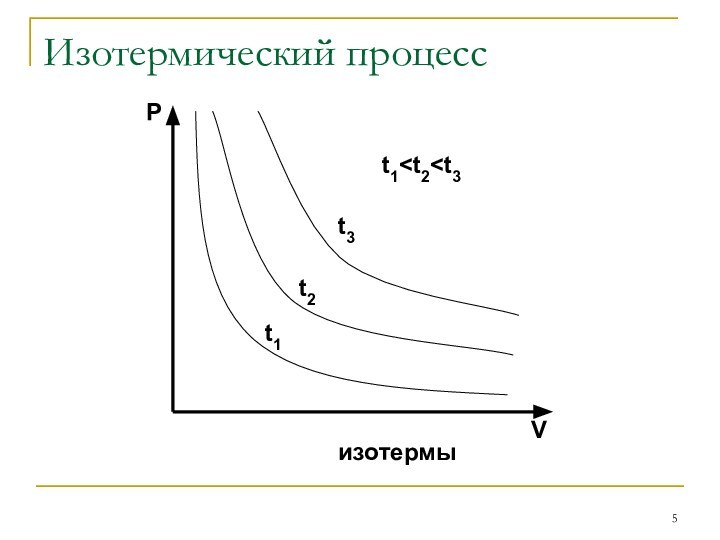
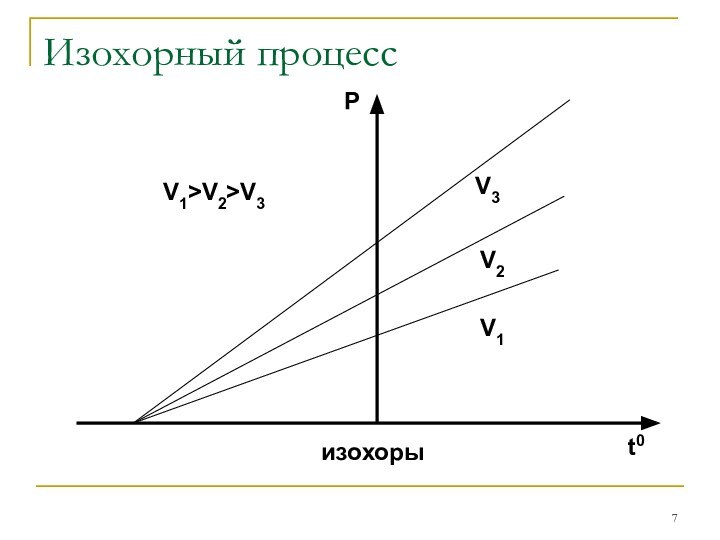
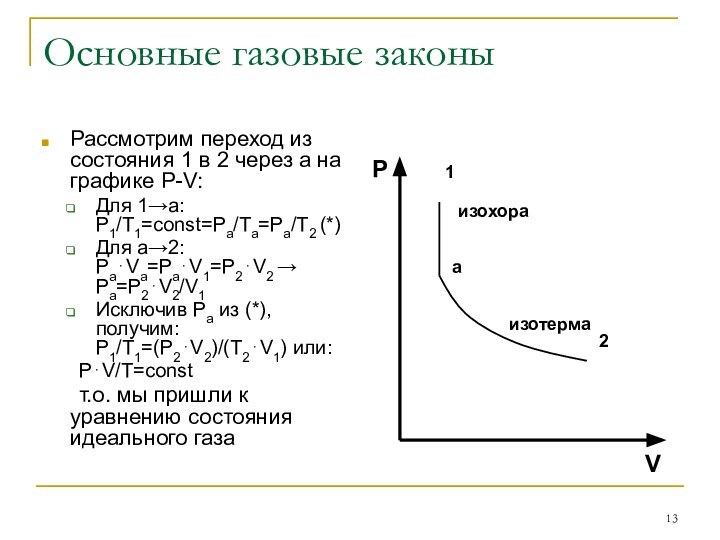
Шарля: P/T=const при V=const
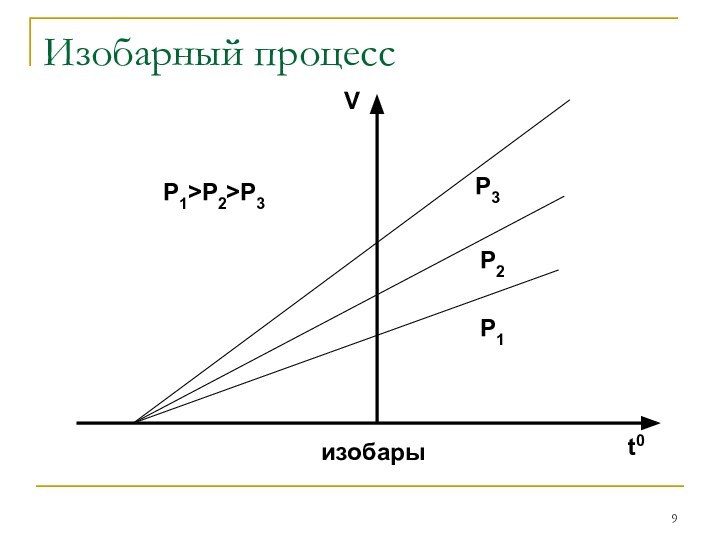
Закон Гей-Люссака: V/T=const
при P=constЗакон Авогадро: одинаковые количества газов при одинаковых температуре и давлении занимают одинаковый объём
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть