Слайд 2
Основные газовые законы
Закон Дальтона:
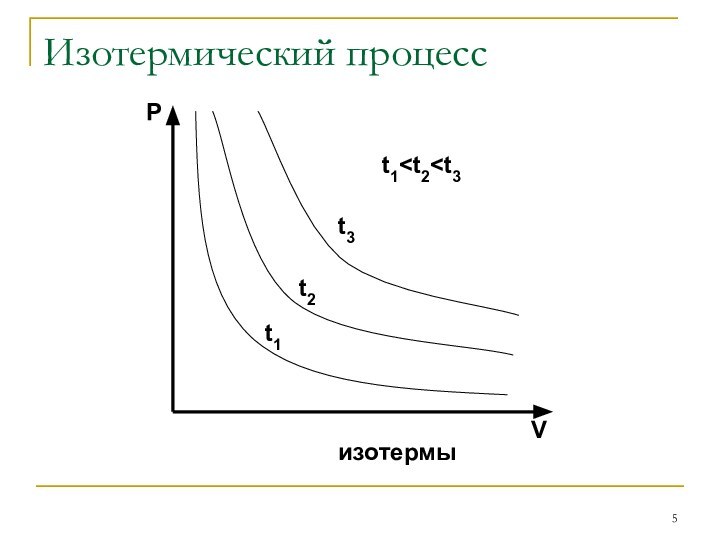
Закон Бойля-Мариотта: P⋅V=const при
t0=const
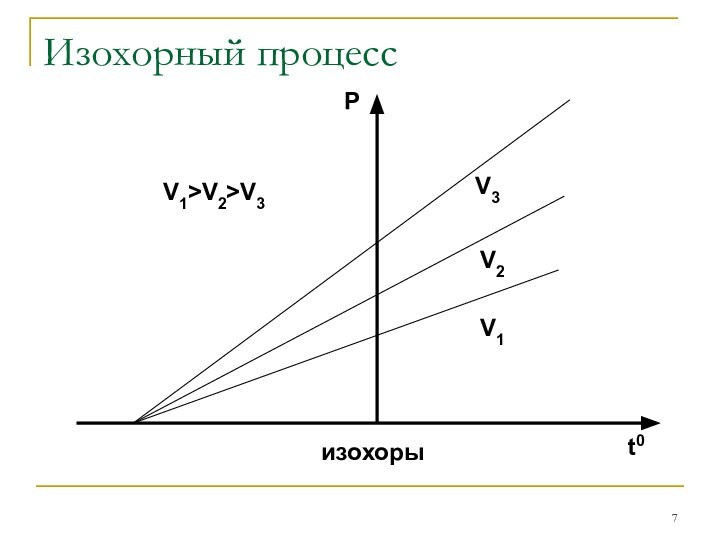
Закон Шарля: P/T=const при V=const
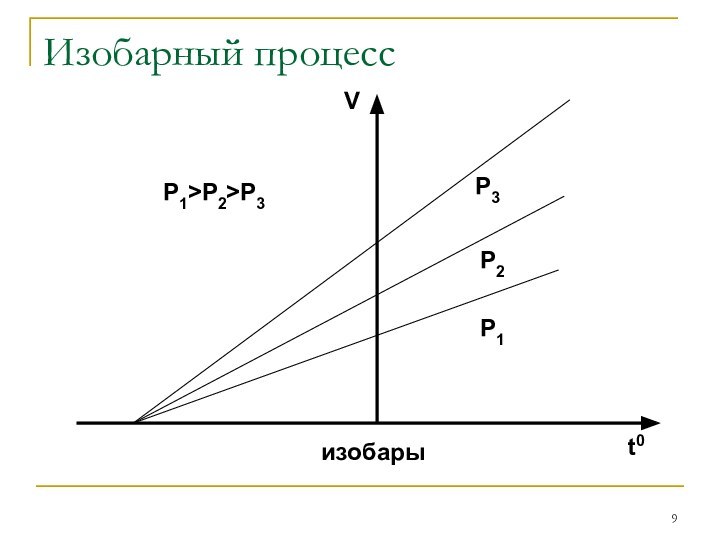
Закон Гей-Люссака: V/T=const
при P=const
Закон Авогадро: одинаковые количества газов при одинаковых температуре и давлении занимают одинаковый объём
Слайд 3
Основные газовые законы
Законы Шарля и Гей-Люссака имеют такой
простой вид если температура измеряется по абсолютной шкале
Первоначально эти
законы были сформулированы для температуры, измеренной в некоторой практической шкале. В этом случае они имеют более сложный вид:
P=P0[1+α⋅(t-t0)]
V=V0[1+β⋅(t-t0)]
при чём коэффициенты α и β оказались равными и не зависящими от рода газа
Слайд 4
Основные газовые законы
Процессы, описываемые уравнениями
2-4 называются изопроцессами:
Изотермическим
Изохорным
Изобарным
Слайд 11
Основные газовые законы
Если измерять температуру по шкале Цельсия,
то оказывается, что точка пересечения изохорного и изобарного процессов
с осью температур имеет координату t=-373,15 0С. Это значит, что α=β=1/273,15 1/0С
Слайд 12
Основные газовые законы
Если ввести новую шкалу температур, такую,
что Т=t+273,15, то уравнения примут более простой вид:
P/T=const
V/T=const
Определённая таким
образом температура называется абсолютной температурой
Слайд 13
Основные газовые законы
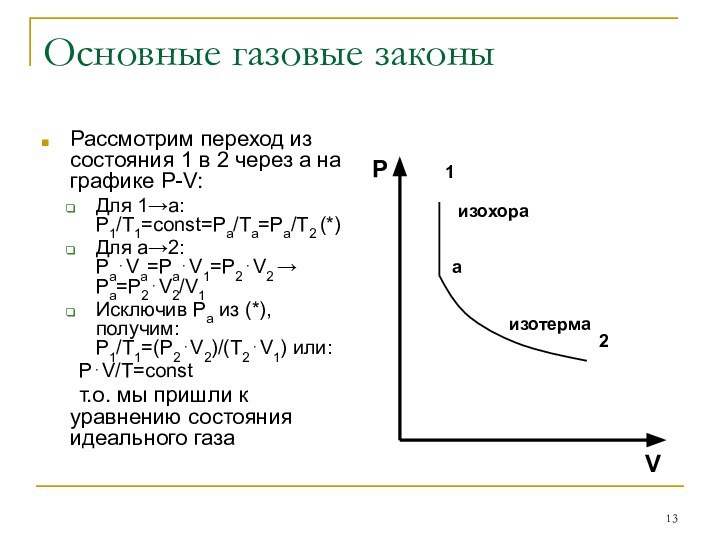
Рассмотрим переход из состояния 1 в
2 через а на графике P-V:
Для 1→а: P1/T1=const=Pa/Ta=Pa/T2 (*)
Для
а→2: Pa⋅Va=Pa⋅V1=P2⋅V2 → Pa=P2⋅V2/V1
Исключив Ра из (*), получим: P1/T1=(P2⋅V2)/(T2⋅V1) или:
P⋅V/T=const
т.о. мы пришли к уравнению состояния идеального газа
Слайд 14
Основные газовые законы
Из закона Авогадро следует, что величина
соотношения (P⋅V)/T не зависит от вида газа, значит мы
можем записать, что для одного моля любого газа (P⋅V)/T=R, где R – универсальная газовая постоянная, называемая постоянной Авогадро
R=8,31 Дж/(град⋅моль)
Из закона Дальтона следует, что при постоянных V и Т, Р является линейной функцией количества вещества ν
Слайд 15
Основные газовые законы
Т.о., мы пришли к уравнению Клапейрона-Менделеева:
P⋅V=ν⋅R⋅T
или
P⋅V=(m/μ)⋅R⋅T
Слайд 16
Основные газовые законы
Идеальный газ
Идеальным называется такой газ, который
подчиняется закону Клапейрона-Менделеева
Поведение реальных газов приближается к поведению идеального
газа в пределе низких давлений и высоких температур
Размеры молекул идеального газа малы по сравнению с межмолекулярным расстоянием, а энергией взаимодействия молекул можно пренебречь
Слайд 17
Кинетическая теория газов
Оценка размеров молекул
Средний размер молекул =(V/N)1/3,
где V – объём, а N – количество молекул
Для
воды: ρ=1г/см3, μ=18 г/моль → Vμ=18 см3. =(Vμ/NA)1/3=(18/6⋅1023)1/3≈3⋅10-8 см=
=3⋅10-10 м
Слайд 18
Кинетическая теория газов
Оценка расстояния между молекулами в газе
=(V/NA)1/3,
при комнатной температуре и атмосферном давлении 1 моль
газа занимает объём 22 400 см3 →
<>=(22400/6⋅1023)1/3≈3,3⋅10-7 см
Т.о. <> на порядок больше, чем , соответственно, объём на три порядка больше
Слайд 19
Кинетическая теория газов
Оценка средней длины свободного пробега молекул
в газах
λ~⋅(/)2
При нормальном давлении λ~10-5 см, то есть на
два порядка больше <>
Слайд 20
Кинетическая теория газов
Задача МКТ заключается в установлении взаимосвязи
между макроскопическими параметрами ТД системы (P, T и др.)
и её микроскопическими характеристиками (λ, μ, , , <>)
Слайд 21
Вывод основного уравнения МКТ
Рассмотрим цилиндр с площадью основания
S=1, опирающийся на стенку сосуда
Примем следующую модель
Частицы разделены на
три равные группы, каждая из которых движется вдоль одной из координатных осей
Частицы не взаимодействуют между собой
При ударе частицы о стенку, на неё действует сила i такая, что:
i⋅τ=Δpix≈2⋅ pix (*)
Слайд 22
Вывод основного уравнения МКТ
Число ударов о стенку:
zi=S⋅ni⋅vix⋅Δt
Заменим
в (*) i на так, что i⋅τ= ⋅Δt
Тогда,
полная сила, действующая на стенку со стороны молекул, имеющих скорость vix:
Fix=zi⋅2⋅ pix/Δt=S⋅ni⋅vix⋅ pix
Слайд 23
Вывод основного уравнения МКТ
→ P=ΣFi/S=Σni⋅vix⋅ pix=n⋅=1/3⋅n⋅
⋅=(2/3)⋅n⋅
Таким образом
мы получили основное уравнение молекулярно-кинетической теории газов:
Р=(2/3)⋅n⋅
Слайд 24
Оценка скорости молекул
Р=(2/3)⋅n⋅=(2/3)⋅n⋅m⋅/2=
=N⋅m⋅/(3⋅V)=M⋅/(3⋅V) →
→ =3⋅P⋅V/M=3⋅P/ρ →
Слайд 25
Оценка скорости молекул
Для молекул водорода Н2 μ=2⋅10-3 кг/моль,
при
комнатной температуре:
≈1800 м/с
для молекул О2 μ=2⋅10-3 кг/моль, при
комнатной температуре:
≈500 м/с
Слайд 26
Кинетическая теория газов
Сравнивая уравнение Клапейрона-Менделеева:
P=ν⋅R⋅T/V, где ν/V=n/Na
с основным уравнением молекулярно-кинетической теории газов:
Р=(2/3)⋅n⋅
мы можем
заключить что:
R⋅T/NA=(2/3)⋅
Слайд 27
Кинетическая теория газов
Окончательно получаем:
=(3/2)⋅k⋅T
где k – постоянная
Больцмана
k=1,38⋅10-23 Дж/град
k=R/NA
Т.о. мы выяснили молекулярно-кинетический смысл температуры – она
пропорциональна средней кинетической энергии молекулы
Слайд 28
Кинетическая теория газов
Из Р=(2/3)⋅n⋅
и =(3/2)⋅k⋅T
следует что:
P=n⋅k⋅T