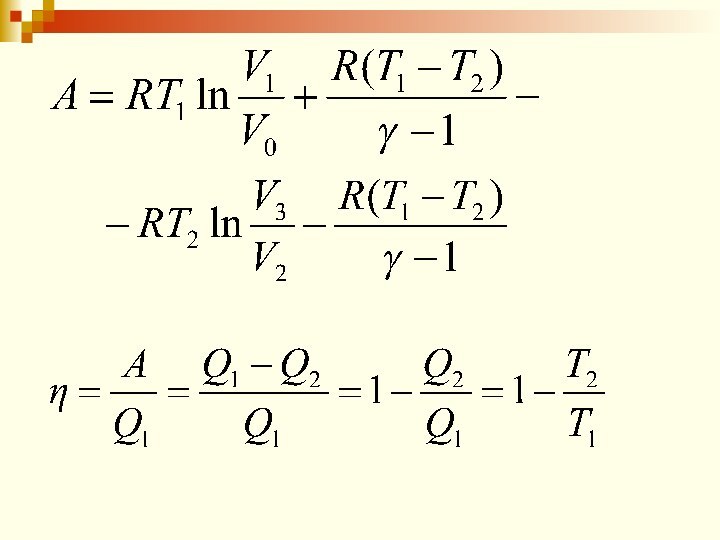Слайд 2
Первое начало термодинамики
Закон сохранения энергии для макроскопических явлений,
в которых одним из существенных параметров, определяющих состояние тел,
является температура.
Возможны два способа передачи энергии от термодинамической системы к внешним телам:
• с изменением внешних макропараметров системы;
• без изменения внешних макропараметров системы.
Слайд 3
Способ передачи энергии, связанный с изменением внешних макропараметров
системы, называется работой;
без изменения внешних макропараметров, но связанный с
изменением нового термодинамического параметра (энтропии), называется теплообменом.
Затрачиваемая работа (A) может пойти на увеличение любого вида энергии; количество теплоты (Q) может пойти непосредственно только на увеличение внутренней энергии системы.
A и Q – имеют размерность энергии – Джоуль; не являются видами энергии, а представляют собой два различных способа передачи энергии и характеризуют процесс энергообмена между системами.
Слайд 4
Принято считать, что A > 0, если она
совершается системой над внешними телами;
Q > 0, если
энергия передается системе.
Работа, совершаемая системой при бесконечно малом изменении объема dV:
S – площадь поршня;
P – давление газа в сосуде;
dV=Sdx – изменение объема сосуда при перемещении поршня dx.
Слайд 5
Величины δA и δQ бесконечно малы, но не
являются полными дифференциалами, т.к. Q и А задаются не
начальным и конечным состояниями системы, а определяются процессом, происходящим с системой.
Слайд 6
Энергия, связанная с внутренними движениями частиц системы и
их взаимодействиями между собой, называется внутренней.
Внутренняя энергия
Величина внутренней энергии
складывается из кинетической энергии хаотического движения молекул и потенциальной энергии их взаимного расположения:
U = Eкин + Евз
Для идеального газа, состоящего из N молекул:
Слайд 7
Внутренняя энергия (U) – однозначная функция состояния термодинамической
системы: изменение внутренней энергии ΔU при переходе системы из
состояния 1 в состояние 2 не зависит от вида процесса перехода и равно: ΔU = U2 – U1.
Бесконечно малое изменение внутренней энергии dU для идеального газа:
dU > 0, если внутренняя энергия системы увеличивается.
Слайд 8
Закон сохранения энергии для систем, в которых существенную
роль играют тепловые процессы, называется первым началом термодинамики:
Слайд 9
Теплоемкость
Теплоёмкость тела характеризуется количеством теплоты, необходимой для
нагревания этого тела на один градус:
Размерность теплоемкости: [C]
= Дж/К.
Удельная теплоёмкость (с) – количество теплоты, необходимое для нагревания единицы массы вещества на один градус.
[с] = Дж/кг·К.
Слайд 10
Для газов удобно пользоваться молярной теплоемкостью сμ
количество теплоты, необходимое для нагревания 1 моля газа на
1 градус:
сμ = с· μ
Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при нагревании.
Если газ нагревать при постоянном объёме, то всё подводимое тепло идёт на нагревание газа, то есть изменение его внутренней энергии. Теплоёмкость в этом случае обозначается СV.
Слайд 11
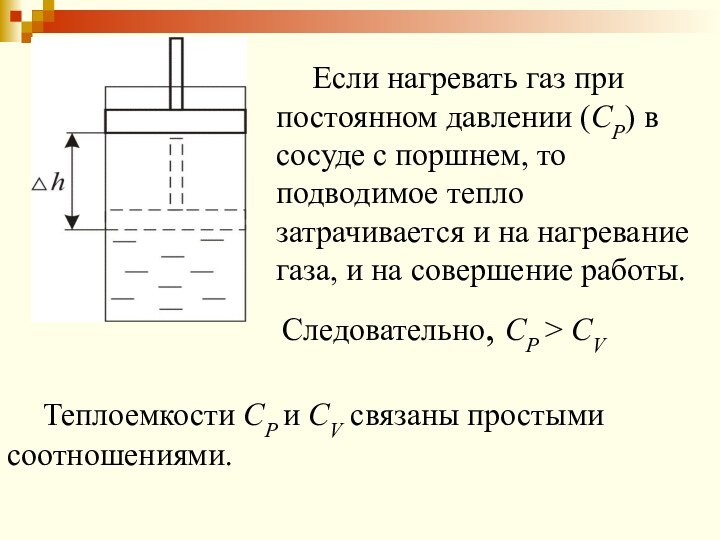
Если нагревать газ при постоянном давлении (СР) в
сосуде с поршнем, то подводимое тепло затрачивается и на
нагревание газа, и на совершение работы.
Следовательно, СР > СV
Теплоемкости СР и СV связаны простыми соотношениями.
Слайд 12
dQ – бесконечно малое приращение коли-чества теплоты, равное
приращению внутренней энергии dU.
При нагревании одного моля идеального газа
при постоянном объёме:
d'Q = dU (d'А = 0)
dUμ = CVdT
Слайд 13
Формула справедлива для любого процесса, т.к. внутренняя энергия
идеального газа является только функцией Т (и не зависит
от V, Р и тому подобных).
U = CVT.
Для произвольной массы идеального газа:
Слайд 14
При изобарическом процессе кроме увеличения внутренней энергии происходит
совершение работы газом:
dQP = dUμ + РdVμ
Из основного уравнения МКТ имеем:
РVμ = RT
Слайд 15
СР = СV + R.
- уравнение Майера для
одного моля газа
Используя это соотношение, Роберт Майер в 1842
г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж.
Слайд 16
Применение первого начала термодинамики к изопроцессам
Изопроцесс – процесс,
проходящий при постоянном значении одного из основных термодинамических параметров
– P, V или Т.
► Изотермический процесс – процесс, происходящий в физической системе при постоянной температуре (T = const).
В идеальном газе при изотермическом процессе произведение давления на объем постоянно – закон Бойля Мариотта:
Слайд 17
При изотермическом процессе внутренняя энергия газа не изменяется,
поэтому все подводимое тепло идет на совершение газом работы:
Слайд 18
► Изохорический процесс – процесс, происходящий в физической
системе при постоянном объеме (V = const).
- закон Шарля
При
изохорическом процессе механическая работа газом не совершается.
Слайд 19
► Изобарический процесс – процесс, происходящий в физической
системе при постоянном давлении (P = const).
- закон Гей-Люссака
Слайд 20
► Адиабатный процесс – процесс, происходящий в физической
системе без теплообмена с окружающей средой (Q = 0).
γ
– показатель адиабаты.
уравнение Пуассона.
Слайд 21
Политропический процесс
Политропический процесс – процесс, протекающий при постоянной
теплоёмкости, c = const.
где n - показатель политропы.
Слайд 22
Все изопроцессы являются частным случаем политропического процесса:
Слайд 23
Второе начало термодинамики.
Цикл Карно с идеальным газом.
I начало
термодинамики – закон сохранения и превращения энергии в тепловых
процессах.
I начало термодинамики не указывает направление протекания процесса, поэтому его недостаточно для описания термодинамических процессов. Это и определяет неполноценность I начала термодинамики.
Слайд 24
II начало термодинамики:
вечный двигатель второго рода невозможен
– формулировка Томсона.
вечный двигатель второго рода – периодически
действующий двигатель, совершающий работу только за счёт охлаждения источника тепла – формулировка Освальда
Его к.п.д. η = 1, т.е. это двигатель, работающий только за счёт получения тепла извне.
Слайд 25
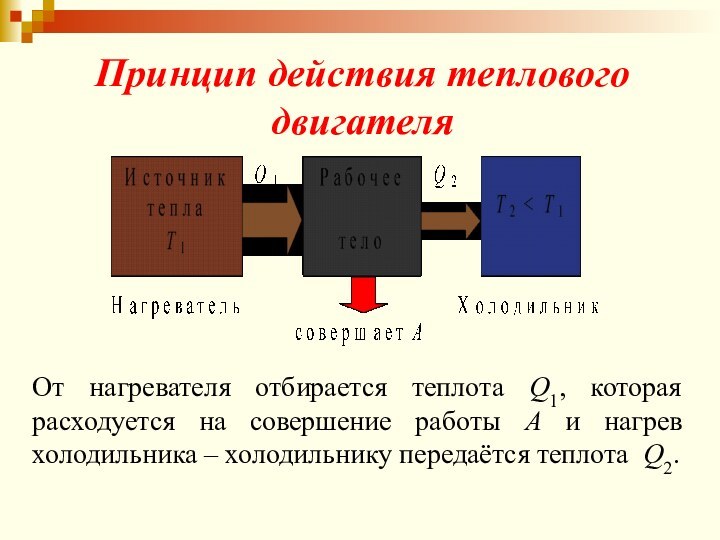
Принцип действия теплового двигателя
От нагревателя отбирается теплота Q1,
которая расходуется на совершение работы А и нагрев холодильника
– холодильнику передаётся теплота Q2.
Слайд 26
Если η = 1, то Q2 = 0 , т.е. тепловой двигатель
имеет только один источник тепла, а холодильника не имеет.
Это невозможно – доказано Карно (французский физик и инженер, 1796 – 1832 гг.). Поток тепла в тепловой машине от тела, более нагретого, к менее нагретому Карно сравнивал с падением воды в водяном двигателе с более высокого уровня на более низкий.
Слайд 27
Томсон: невозможен круговой процесс, единственным результатом которого было
бы производство работы за счёт охлаждения теплового резервуара (источника
тепла, нагревателя).
Клаузиус: теплота не может самопроизвольно переходить от тела, менее нагретого, к телу, более нагретому, т.е. невозможно создать какое-либо устройство или придумать способ, когда без всяких изменений в природе можно передавать тепло от менее нагретого тела к более нагретому.
Но если процесс не самопроизвольный, сопровождается изменениями в окружающей среде, то это возможно, что, например, осуществляется за счёт работы машины в холодильнике.
Слайд 28
Обратимые и необратимые процессы
Состояние изолированной системы, в которое
она переходит по истечении достаточно большого промежутка времени, сравнимого
или большего времени релаксации, является равновесным.
Если термодинамическая система выведена из состояния равновесия и предоставлена сама себе, то она возвращается в исходное состояние. Этот процесс называется релаксацией.
Слайд 29
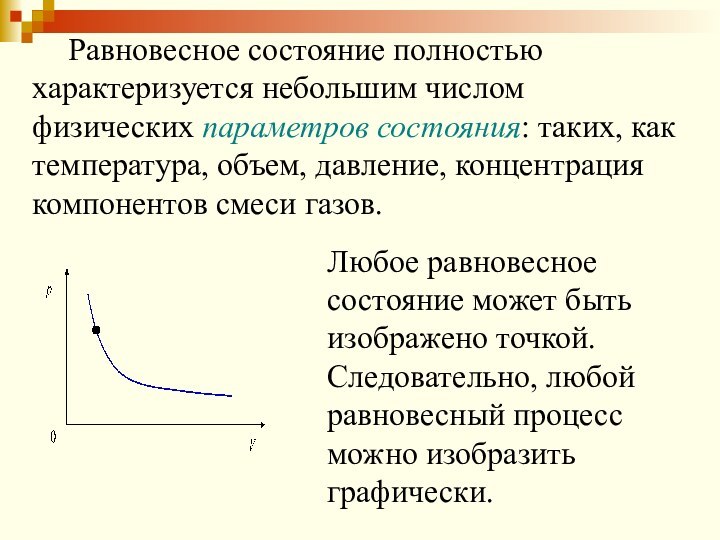
Равновесное состояние полностью характеризуется небольшим числом физических параметров
состояния: таких, как температура, объем, давление, концентрация компонентов смеси
газов.
Любое равновесное состояние может быть изображено точкой.
Следовательно, любой равновесный процесс можно изобразить графически.
Слайд 30
При переходе из одного равновесного состояния в другое
под влиянием внешних воздействий система проходит через непрерывный ряд
состояний.
Процесс, протекающий бесконечно медленно и представляющий собой последовательность равновесных состояний, называется квазистатическим.
Слайд 31
Термодинамический процесс, совершаемый системой, называется обратимым, если после
него можно возвратить систему, и все взаимодействовавшие тела в
их начальные состояния таким образом, чтобы в других телах не возникло каких-либо остаточных изменений.
Если процесс не отвечает принципу обратимости, то он называется необратимым – все реальные процессы.
Примеры:
• тепло переходит от горячего тела к холодному,
• переход работы силы трения Fтр в тепло.
Слайд 32
Необходимое условие обратимости процесса – его равновесность.
Совокупность термодинамических
процессов, в результате которых система возвращается в исходное состояние,
называется круговым процессом (циклом).
Все равновесные процессы обратимы, т.к. происходят с бесконечно малой скоростью и представляют собой непрерывную цепь равновесных состояний.
Слайд 33
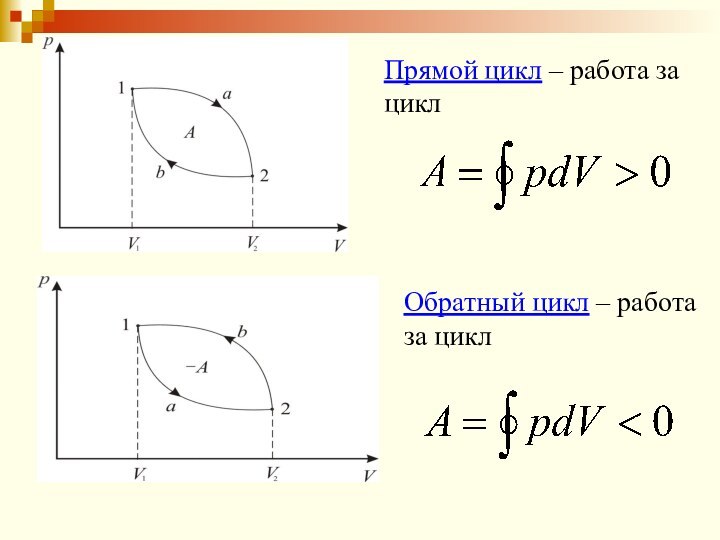
Прямой цикл – работа за цикл
Обратный цикл
– работа за цикл
Слайд 34
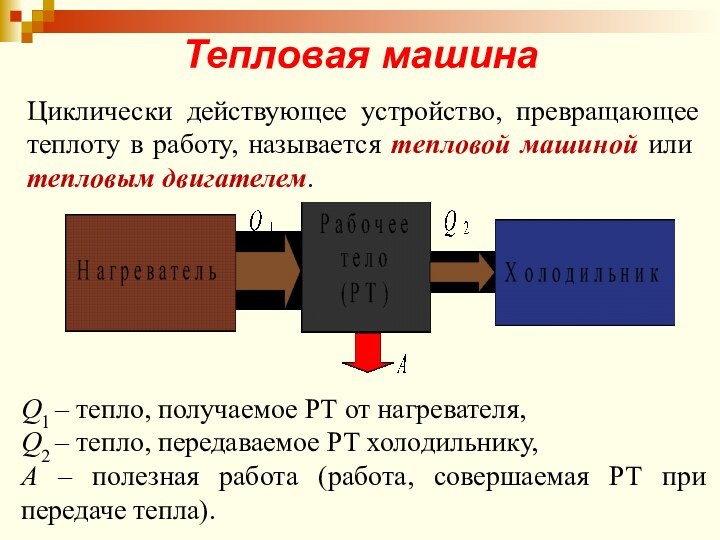
Тепловая машина
Циклически действующее устройство, превращающее теплоту в работу,
называется тепловой машиной или тепловым двигателем.
Q1 – тепло, получаемое
РТ от нагревателя,
Q2 – тепло, передаваемое РТ холодильнику,
А – полезная работа (работа, совершаемая РТ при передаче тепла).
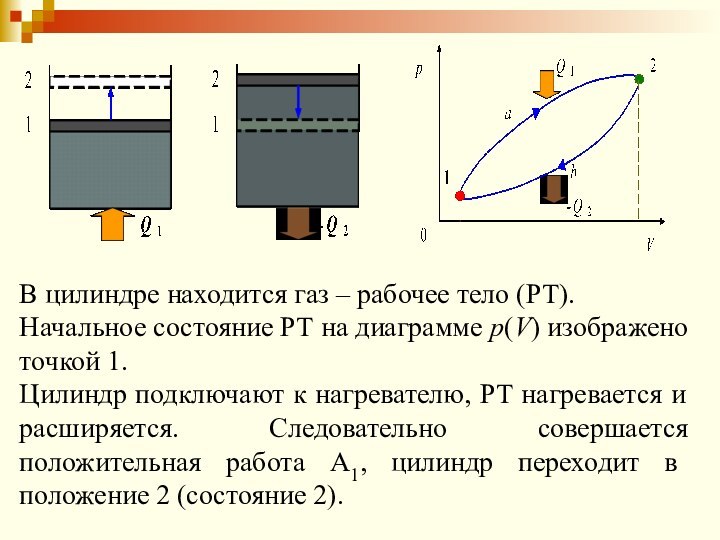
Слайд 37
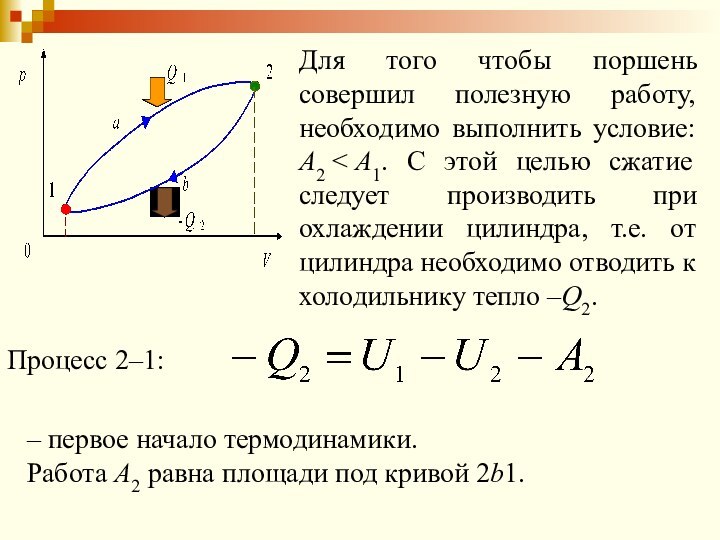
Для того чтобы поршень совершил полезную работу, необходимо
выполнить условие: А2
при охлаждении цилиндра, т.е. от цилиндра необходимо отводить к холодильнику тепло –Q2.
Процесс 2–1:
– первое начало термодинамики.
Работа А2 равна площади под кривой 2b1.
Слайд 38
Сложим два уравнения и получим:
Рабочее тело
совершает круговой процесс 1a2b1 – цикл.
К.п.д.
Слайд 39
Процесс возвращения рабочего тела в исходное состояние происходит
при более низкой температуре. Следовательно, для работы тепловой машины
холодильник принципиально необходим.
Слайд 40
Цикл Карно
Никола Леонард Сади КАРНО – блестящий
французский офицер инженерных войск, в 1824 г. опубликовал сочинение
«Размышления о движущей силе огня и о машинах способных развить эту силу».
Ввел понятие кругового и обратимого процессов, идеального цикла тепловых машин, заложил тем самым основы их теории. Пришел к понятию механического эквивалента теплоты.
Слайд 41
из всех периодически действующих тепловых машин, имеющих одинаковые
температуры нагревателей и холодильников, наибольшим КПД обладают обратимые машины.
Причем КПД обратимых машин, работающих при одинаковых температурах нагревателей и холодильников, равны друг другу и не зависят от конструкции машины. При этом КПД меньше единицы.
Карно вывел теорему, носящую теперь его имя:
Слайд 43
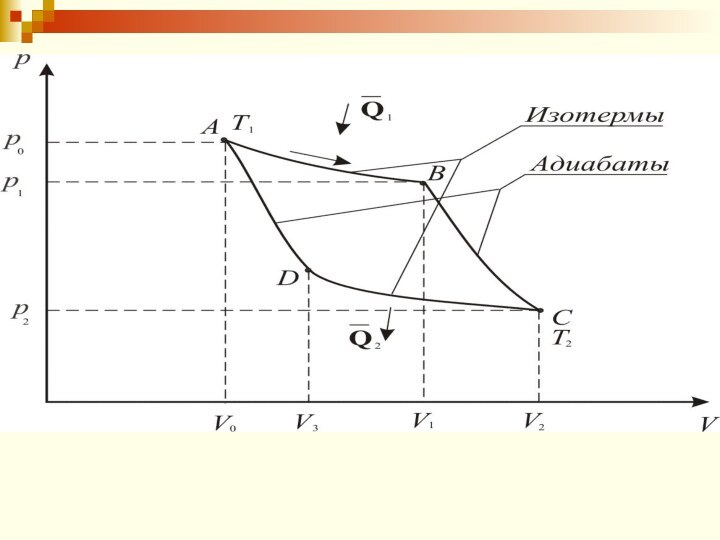
Процесс А-В – изотермическое расширение
Процесс В-С – адиабатическое
расширение.
– коэффициент Пуассона.
Слайд 44
Процесс С-D – изотермическое сжатие
Процесс D-A – адиабатическое
сжатие.
Слайд 46
КПД цикла Карно η < 1 и зависит
от разности температур между нагревателем и холодильником (и не
зависит от конструкции машины и рода рабочего тела).
Если Т2 = 0, то η = 1, что невозможно, т.к. абсолютный нуль температуры не существует.
Если Т1 = ∞, то η = 1, что невозможно, т.к. бесконечная температура не достижима.