и.т.п.
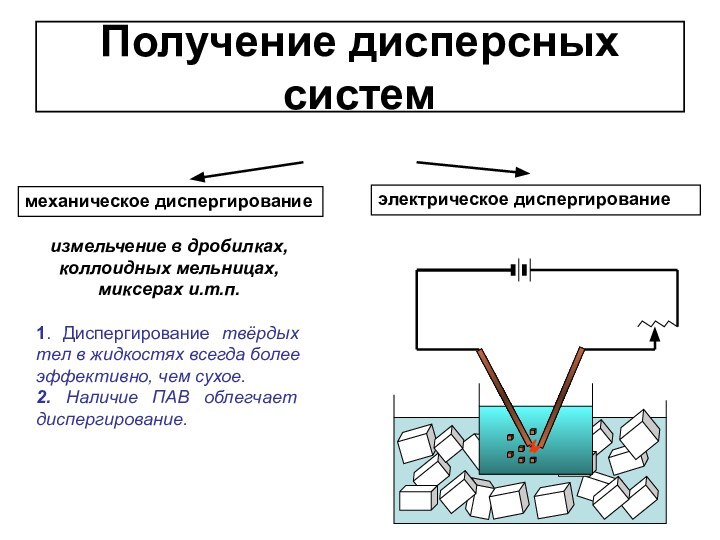
1. Диспергирование твёрдых тел в жидкостях всегда более эффективно,
чем сухое.2. Наличие ПАВ облегчает диспергирование.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть













Диспергирование
В общем случае работа диспергирования состоит из двух частей: работы объемного деформирования тела Wд и работы образования новой поверхности Wп:
W= Wд + Wп
(1)
Уравнение (1) называется уравнением Ребиндера. Работа деформирования пропорциональна объему тела V:
В то же время, объем тела пропорционален кубу линейных размеров тела
l : V ≈ l ³ ; а ΔS ≈ l ² − линейным размерам тела l в квадрате.
Wд=KV
(2)
где K – коэффициент пропорциональности; V – объем тела.
Работа образования поверхности пропорциональна увеличению поверхности ΔS с коэффициентом пропорциональности, равному энергии образования 1 ед. поверхности σ:
Wп=σΔS
(3)
(5)
Полная работа определяется только работой деформирования (дробления) тела, т. е. бесполезной работой, поскольку энергия при деформировании теряется безвозвратно.
При малых l можно пренебречь работой объемного деформирования, и полная работа будет определяться только работой образования новой поверхности и называется работой измельчения (полезной работой):
(6)
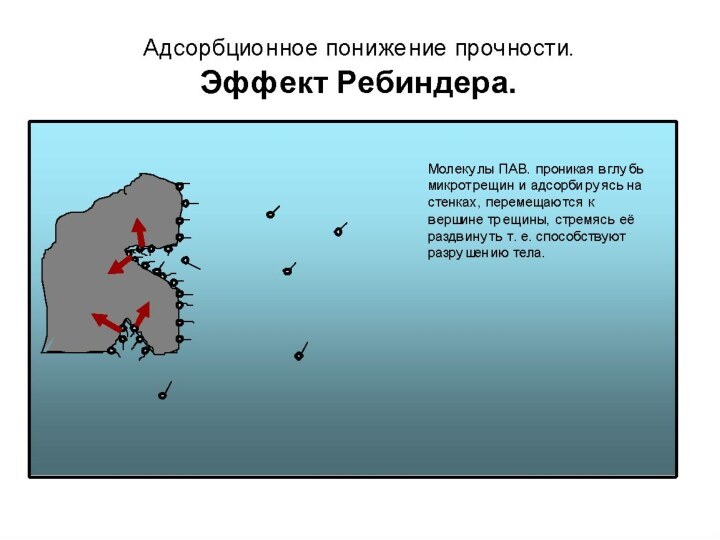
Для облегчения диспергирования материалов и снижения энергозатрат обычно используют специальные добавки, называемые понизителями прочности, составляющие ~ 0,1 % от массы измельчаемых веществ. Эффект снижения прочности твердых тел в присутствии понизителей прочности называется эффектом Ребиндера. С помощью этого эффекта можно снизить энергозатраты на получение дисперсных систем примерно наполовину. Действие добавок, представляющих из себя чаще всего поверхностно-активные вещества (ПАВ), сводится, прежде всего, к снижению поверхностного натяжения и уменьшению работы измельчения Wп.
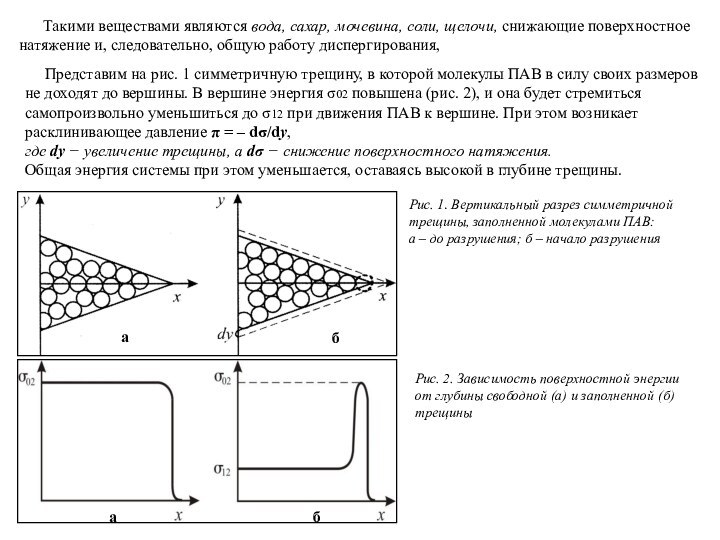
Представим на рис. 1 симметричную трещину, в которой молекулы ПАВ в силу своих размеров не доходят до вершины. В вершине энергия σ02 повышена (рис. 2), и она будет стремиться самопроизвольно уменьшиться до σ12 при движения ПАВ к вершине. При этом возникает расклинивающее давление π = – dσ/dу,
где dy − увеличение трещины, а dσ − снижение поверхностного натяжения.
Общая энергия системы при этом уменьшается, оставаясь высокой в глубине трещины.
Рис. 1. Вертикальный разрез симметричной трещины, заполненной молекулами ПАВ:
а – до разрушения; б – начало разрушения
а
б
Рис. 2. Зависимость поверхностной энергии от глубины свободной (а) и заполненной (б) трещины
а
б
Добавки помогают не только разрушить материал, но и стабилизируют систему в дисперсном состоянии, так как, адсорбируясь на поверхности частиц, мешают их обратному слипанию. Действие понизителей прочности специфично, то есть для определенных поверхностей подходят одни и не подходят другие вещества. Например, для разрушения твердых металлов используют жидкие металлы, для монокристаллов − органические вещества, для твердых солей − расплавы солей, растворы ПАВ, воду и т. д.
2) Ультразвуковое диспергирование с частотой применяют для дробления жидких и твердых непрочных тел (мел, графит). Под влиянием ультразвука в системе возникают локальные сжатия и расширения вещества, которые разрушающим образом действуют на систему. Этот метод широко используют для получения эмульсий.
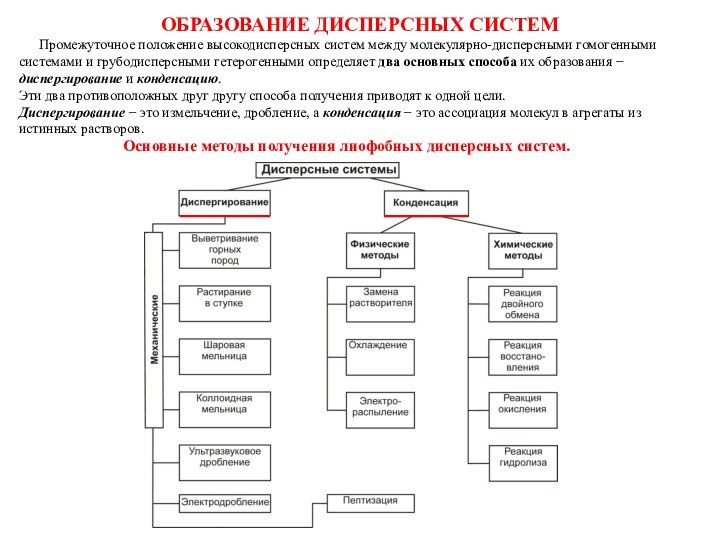
Основные методы диспергирования
Минимальный размер частиц, который можно получить методом диспергирования, соответствует микрогетерогенным системам. Для получения ультрамикрогетерогенных систем пользуются методом конденсации.
(8)
где P − давление пересыщенного пара; х − концентрация в пересыщенном растворе; РS − давление насыщенного пара; х∞ − концентрация в насыщенном растворе.
Для образования новой фазы необходима определенная степень пересыщения − критическая γкр. Например, при образовании облаков в атмосфере в присутствии промышленных выбросов γкр ≈ 1. Если же нет дополнительных центров конденсации, то γкр ≈ 4.
При γ > γкр в системе идет конденсация (кристаллизация), при γ < γкр идет испарение (растворение); если γ = γкр, то вероятность роста и исчезновения ядер конденсации (кристаллизации) одинакова. Связь степени пересыщения с размерами частиц можно видеть из уравнения Кельвина (Томсона):
(9)
Из (9) следует, что для образования мелких частиц
(r − мало) нужно большое пересыщение γ.
Для более крупных частиц оно меньше.
ΔG=ΔGV+ΔGS
(10)
Объемная или химическая составляющая, характеризует степень отклонения метастабильного состояния от стабильного. Она представляет собой энергетически выгодную работу переноса вещества из парообразного состояния в конденсированное, и для 1 моля вещества может быть выражена через давление пара над искривленной Р и ровной PS поверхностями:
(11)
с учетом (9)
(12)
(13)
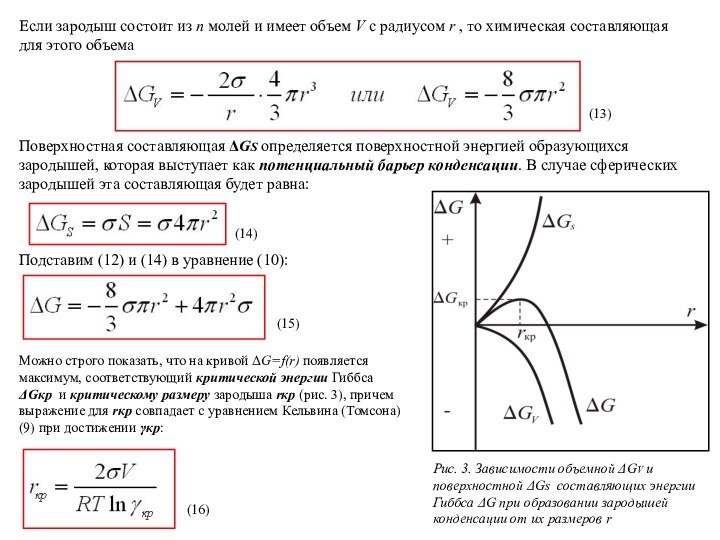
Поверхностная составляющая ΔGS определяется поверхностной энергией образующихся зародышей, которая выступает как потенциальный барьер конденсации. В случае сферических зародышей эта составляющая будет равна:
(14)
Подставим (12) и (14) в уравнение (10):
(16)
Рис. 3. Зависимости объемной ΔGV и поверхностной ΔGs составляющих энергии Гиббса ΔG при образовании зародышей конденсации от их размеров r
Можно строго показать, что на кривой ΔG=f(r) появляется максимум, соответствующий критической энергии Гиббса ΔGкр и критическому размеру зародыша rкр (рис. 3), причем выражение для rкр совпадает с уравнением Кельвина (Томсона) (9) при достижении γкр:
(15)
(18)
Из уравнения (18) следует, что чем выше степень пересыщения γкр, тем меньше ΔGкр, и тем меньше, согласно (16), rкр. Это означает, что максимум кривой на рис. 3. будет ближе к началу координат. Если γкр уменьшится, то rкр и ΔGкр возрастут, и положение максимума отодвинется вправо. Уменьшению ΔGкр способствует также снижение поверхностного натяжения. Например, появление заряда на поверхности зародыша снижает поверхностное натяжение, поэтому зародыши, несущие заряд, образуются при меньших степенях пересыщения.
(18)
(19)
где ΔG1 − свободная энергия образования зародыша; A1 − константа.
Скорость доставки вещества J2 пропорциональна скорости "выживания" возникших центров:
(20)
где Eη – энергия активации вязкого течения; A2 − константа.
Поскольку эти процессы последовательные, их вероятности перемножаются:
(21)
Представим на графике (рис. 4) зависимость J1, J2 и υ1 от температуры.
Из рис. 4 следует, что кривая υ1=f(T) , то есть общая скорость первой стадии, проходит через максимум и оказывается меньше скоростей ее составляющих.
Вторая стадия − рост зародышей также состоит из двух процессов: возникновение двухмерных зародышей и образование новых слоев, то есть доставка вещества к двухмерным зародышам. Уравнение для скорости роста зародышей υ2 аналогично уравнению для υ1 в первой стадии:
(22)
где B – константа; ΔG2 − энергия образования двухмерных зародышей.
Зависимость υ2=f(T) представляет из себя также кривую с максимумом. Для анализа всей кинетики в системе на один график наносят две кривые υ1=f(T) и υ2=f(T) – температурные зависимости скоростей образования центров конденсации и скоростей их роста.
Соотношение между величинами скоростей и их взаимное расположение определяет характер конденсации в системе.
2
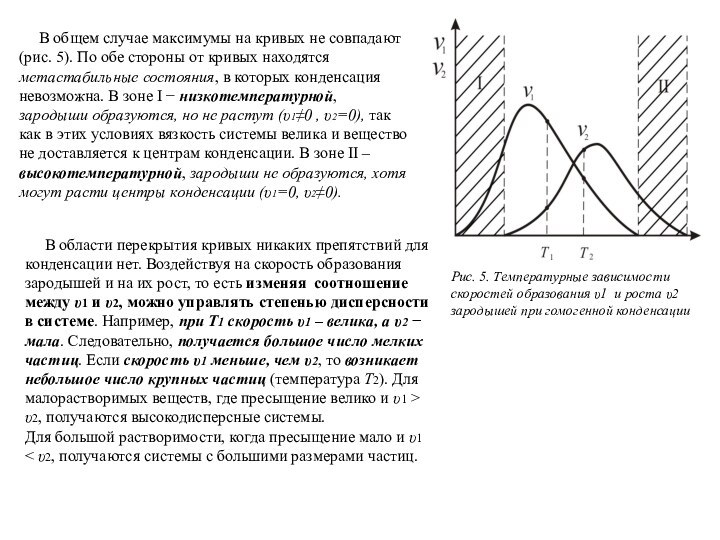
Рис. 5. Температурные зависимости
скоростей образования υ1 и роста υ2 зародышей при гомогенной конденсации
В области перекрытия кривых никаких препятствий для конденсации нет. Воздействуя на скорость образования зародышей и на их рост, то есть изменяя соотношение между υ1 и υ2, можно управлять степенью дисперсности в системе. Например, при Т1 скорость υ1 – велика, а υ2 − мала. Следовательно, получается большое число мелких частиц. Если скорость υ1 меньше, чем υ2, то возникает небольшое число крупных частиц (температура Т2). Для малорастворимых веществ, где пресыщение велико и υ1 > υ2, получаются высокодисперсные системы.
Для большой растворимости, когда пресыщение мало и υ1 < υ2, получаются системы с большими размерами частиц.
Физические методы связаны с изменением природы среды или условий (температуры, давления) существования раствора таким образом, чтобы вещество из растворимого становилось нерастворимым. К физическим методам относятся: замена растворителя, собственно конденсация при охлаждении, электрораспыление в дуге постоянного или переменного тока. Так, при резком охлаждении воздуха и конденсации водяных паров образуется туман в природе.
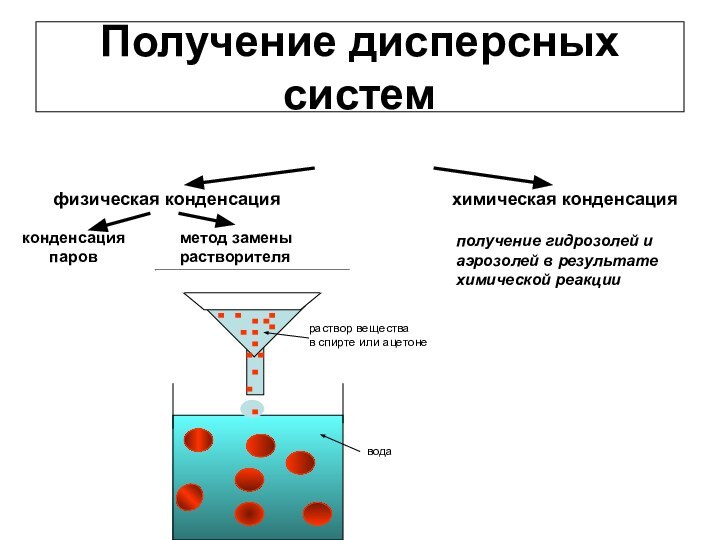
1) Наиболее распространен метод замены растворителя. Раствор какого-либо вещества добавляют в жидкость, в которой это вещество нерастворимо. Получается пересыщенный раствор, и идет конденсация молекул в частицы.
2) Электрораспыление в дуге постоянного тока носит название метода Бредига, а в дуге переменного тока – метода Сведберга. Эти методы в равной мере можно отнести и к диспергированию.
Основные методы конденсации