- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Азот и аммиак
Содержание
- 2. Тест на тему: Азот. Аммиак.
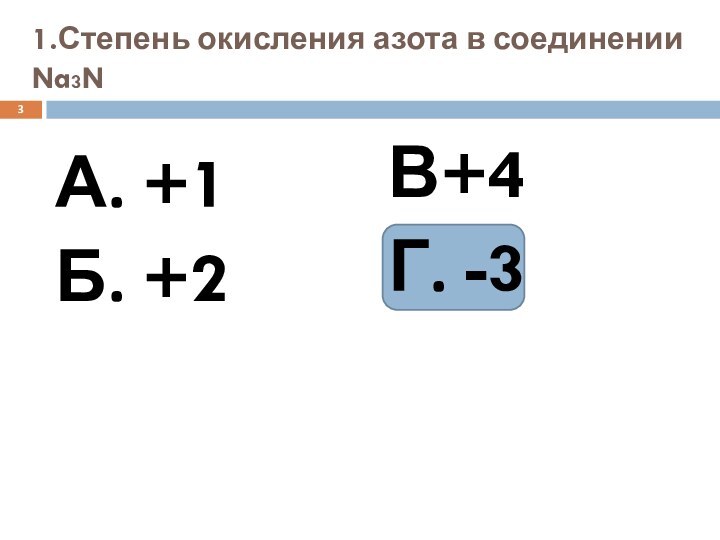
- 3. 1.Степень окисления азота в соединении Na3NА. +1Б. +2В+4Г. -3
- 4. 2. Молекула аммиака NH3 имеет форму:А. изогнутуюБ. линейнуюВ. плоскуюГ.тетраэдрическую
- 5. 3.Азот в составе аммиака является:А. только окислителемБ. восстановителемВ. как окислителем, так и восстановителемГ. Акцептором электронов
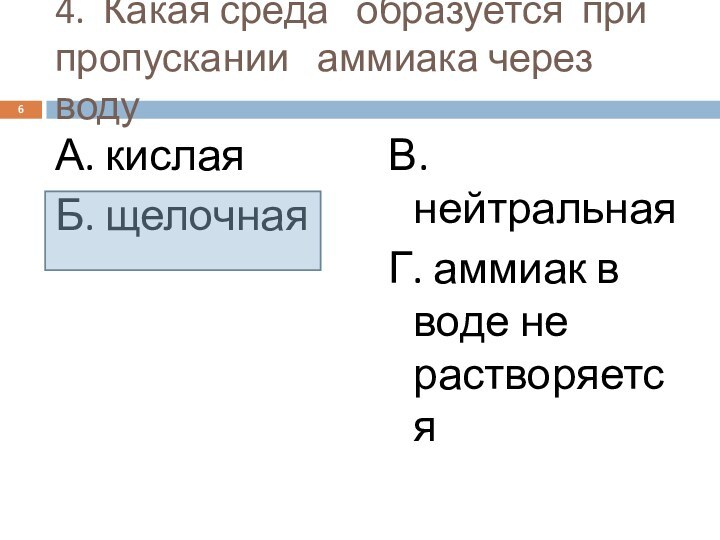
- 6. 4. Какая среда образуется при пропускании
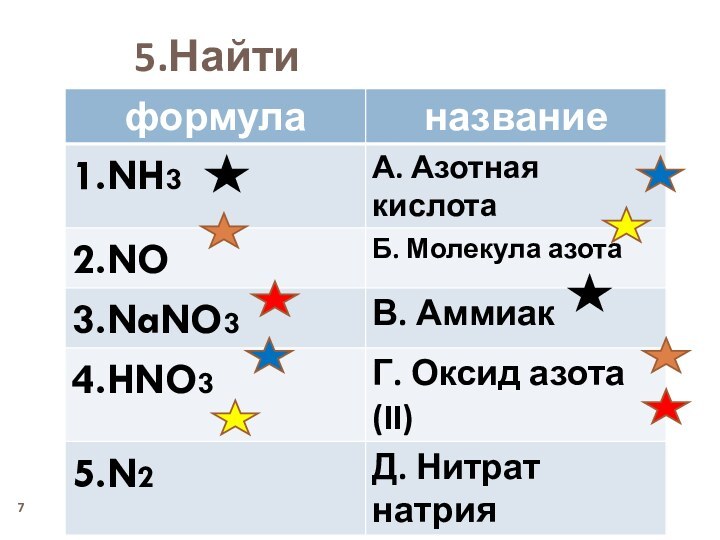
- 7. 5.Найти соответствие
- 8. За каждый правильный ответ – 1 баллВсего:
- 9. Урок «Соли аммония»
- 10. Цель урока: рассмотреть физические и химические свойства солей аммония. Применение солей аммония.
- 11. Задачи:1. Обеспечить в ходе урока усвоение следующих
- 12. Задачи: к следующему уроку учащиеся должны: знать:
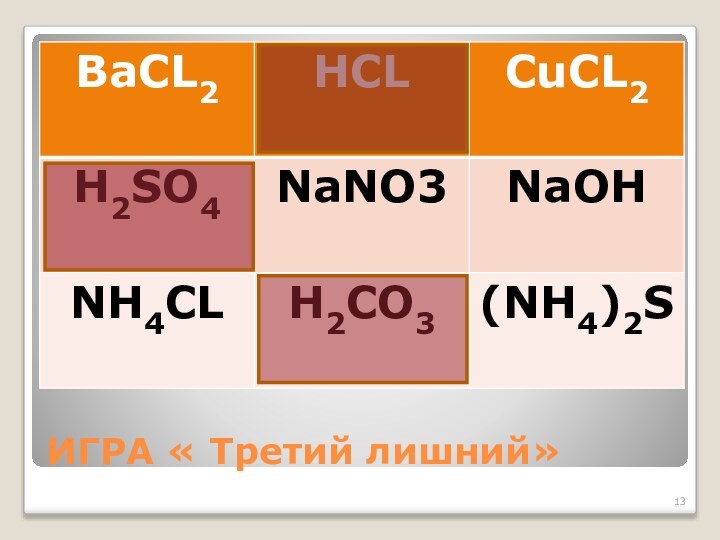
- 13. ИГРА « Третий лишний»
- 14. Тема урока : « Соли аммония»План урока:1.
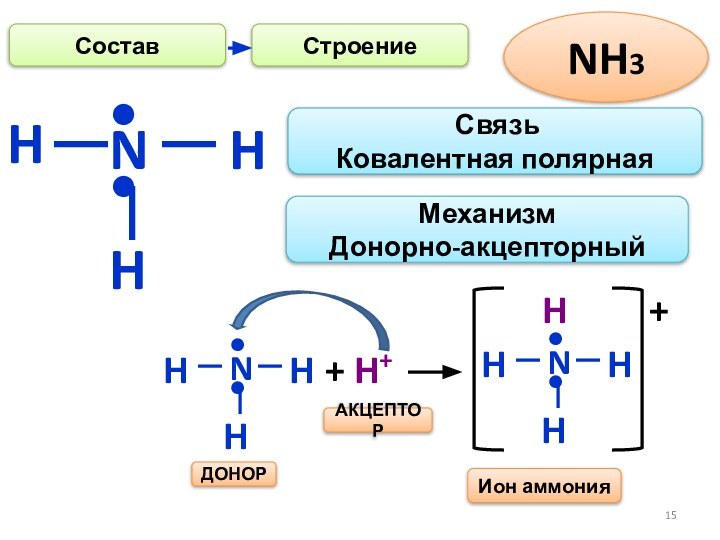
- 15. Ион аммония15HСтроениеNHH••МеханизмДонорно-акцепторный СвязьКовалентная полярнаяNHHH••+ H+NHHH•• H+ АКЦЕПТОРДОНОРСоставNH3
- 17. Получение солей аммонияNH3 + НCL = NH4Cl NH3+HNO3=2NH4OH+H2SO4 =NH4NO3(NH4)2SO4+2H2O
- 18. Будут ли соли аммония проявлять характерные свойства класса солей? Какие?
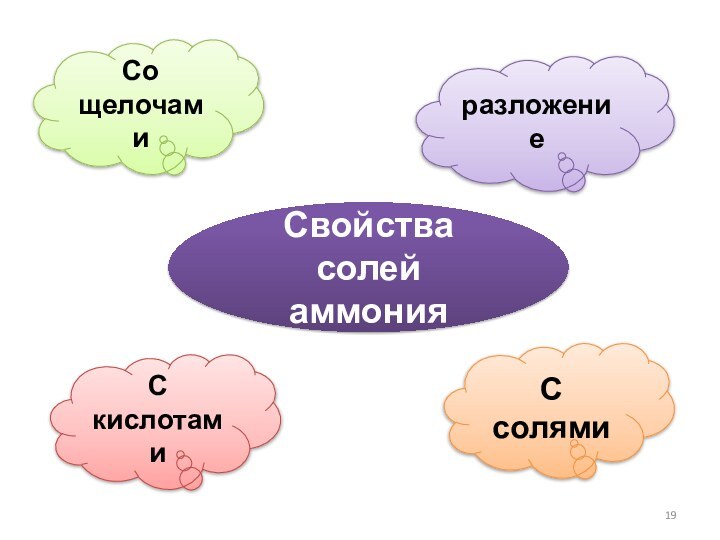
- 19. Свойства солей аммонияСо щелочамиС кислотамиС солямиразложение
- 20. Техника безопасности
- 21. Лабораторная работа
- 22. Группа № 1Качественная реакция на ион аммонияNH4Cl
- 23. Группа № 2Разложение хлорида аммонияNH4Cl = NH3↑ + НCl
- 24. Группа № 3Взаимодействие с солямиNH4Cl + AgNO3
- 25. Группа № 4Взаимодействие с кислотами(NH4)2СO3 + 2НCl=>СО2
- 26. Реактив Несслера. 2K2[HgI4] + NH3 .
- 27. Особые свойства солей аммонияРазложение солей аммония (NH4)2Cr2O7
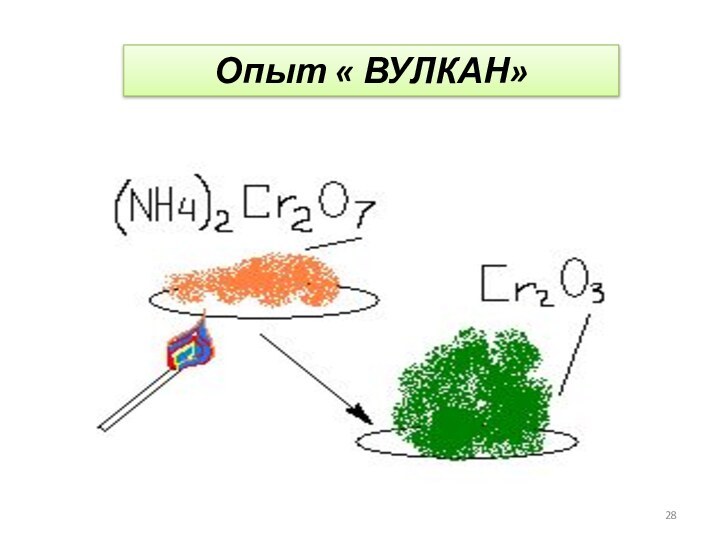
- 28. Опыт « ВУЛКАН»
- 29. Опыт «Фараонова Змея»(NH4)2Cr2O7 = Cr2O3 + N2↑
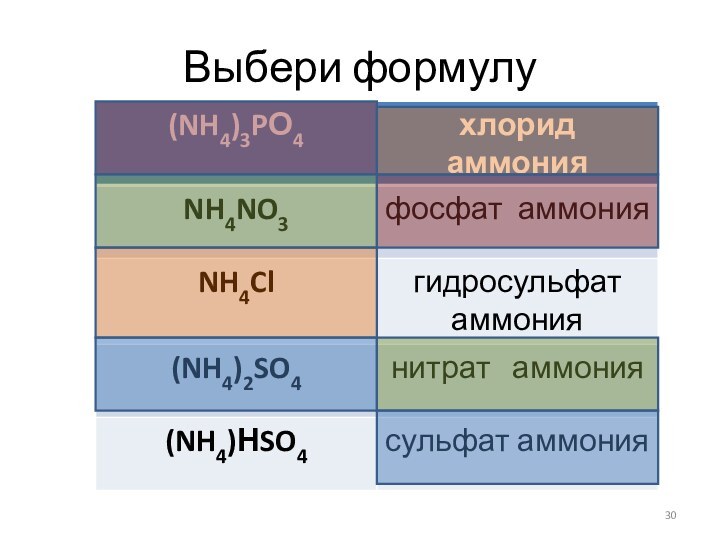
- 30. Выбери формулу
- 31. «Да» или «нет»1)Ион аммония имеет заряд -12)
- 32. РефлексияДостигли ли вы поставленной цели? Что для
- 33. Домашнее задание п. 26. вопрос
- 34. Скачать презентацию
- 35. Похожие презентации
Тест на тему: Азот. Аммиак.















![Азот и аммиак Реактив Несслера. 2K2[HgI4] + NH3 . H2O + 3 KOH =](/img/tmb/11/1074776/7a16b82fab3b1a3c06e8270f7aa31294-720x.jpg)






Слайд 5
3.Азот в составе аммиака является:
А. только окислителем
Б. восстановителем
В.
как окислителем, так и восстановителем
Г. Акцептором электронов
Слайд 6 4. Какая среда образуется при пропускании
аммиака через воду
А. кислая
Б. щелочная
В. нейтральная
Г. аммиак в воде
не растворяется
Слайд 8
За каждый правильный ответ – 1 балл
Всего: 9
баллов.
Если правильно 9 баллов – оценка «5»
8 – 6 баллов – «4»5 – 3 балла – «3»
2 балла - « 2»
Оценивание:
Слайд 10 Цель урока: рассмотреть физические и химические свойства солей
аммония. Применение солей аммония.
Слайд 11
Задачи:
1. Обеспечить в ходе урока усвоение следующих понятий:
соли
аммония
качественные реакции на ион аммония
химические свойства солей аммония
2. Формирование
следующих специальных умений и навыков:умение составлять химические уравнения реакций
умение пользоваться химической символикой и химическим языком
умение работать с химическим оборудованием и химическими реактивами
выполнять требования инструкций техники безопасности
3. Воспитание самостоятельности при выполнении лабораторных работ, упражнений, бережного отношения к окружающей среде, соблюдение правил техники безопасности
4. Развитие творчества, интереса к предмету, развитие интеллекта, эмоциональной мотивации в развитии личности, работа с учебником.
Слайд 12
Задачи: к следующему уроку учащиеся должны:
знать:
качественные реакции
на ион аммония
способы получения солей аммония на примере хлорида
аммонияуметь:
составлять соответствующие уравнения реакций, отражающие свойства солей аммония
проводить эксперимент, отражающий свойства солей аммония.
Слайд 14
Тема урока : « Соли аммония»
План урока:
1. Строение
солей аммония.
2. Получение
3. Физические и химические свойства.
4. Применение
(сообщение ученика)5. Закрепление
6. Рефлексия.
7. Задание на дом.
Слайд 15
Ион аммония
15
H
Строение
N
H
H
••
Механизм
Донорно-акцепторный
Связь
Ковалентная полярная
N
H
H
H
••
+ H+
N
H
H
H
••
H
+
АКЦЕПТОР
ДОНОР
Состав
NH3
Слайд 22
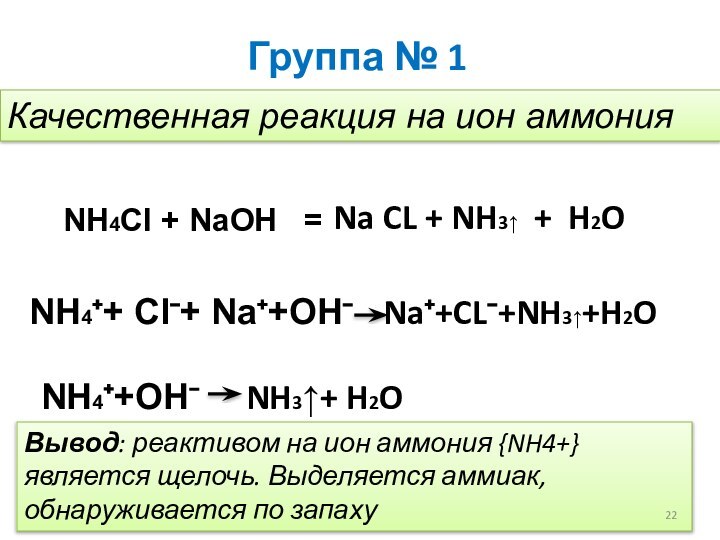
Группа № 1
Качественная реакция на ион аммония
NH4Cl +
NaOH =
Na CL + NH3↑ + H2O
NH4⁺+ Cl⁻+
Na⁺+OH⁻ Na⁺+CL⁻+NH3↑+H2ONH4⁺+OH⁻ NH3↑+ H2O
Вывод: реактивом на ион аммония {NH4+} является щелочь. Выделяется аммиак, обнаруживается по запаху
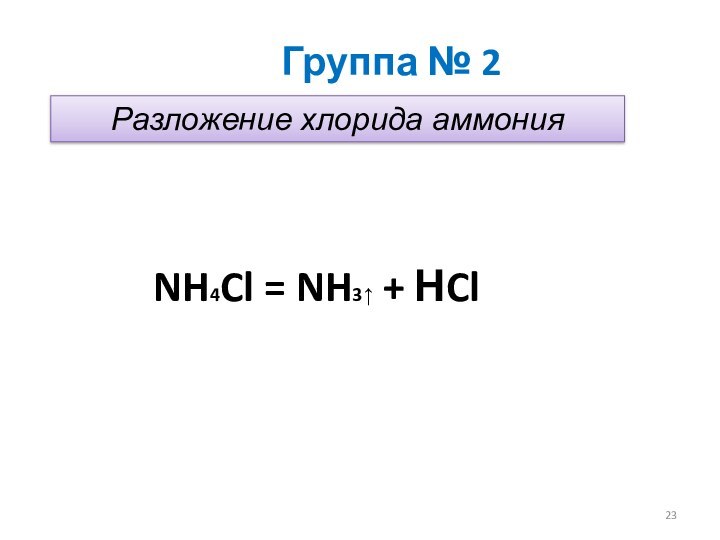
Слайд 24
Группа № 3
Взаимодействие с солями
NH4Cl + AgNO3 =>
NH4NO3 + AgCl↓
NH4⁺ +Cl⁻ + Ag⁺+NO3⁻ =>NH4⁺+NO3⁻+AgCl↓
Cl⁻ +
Ag⁺ =>AgCl↓
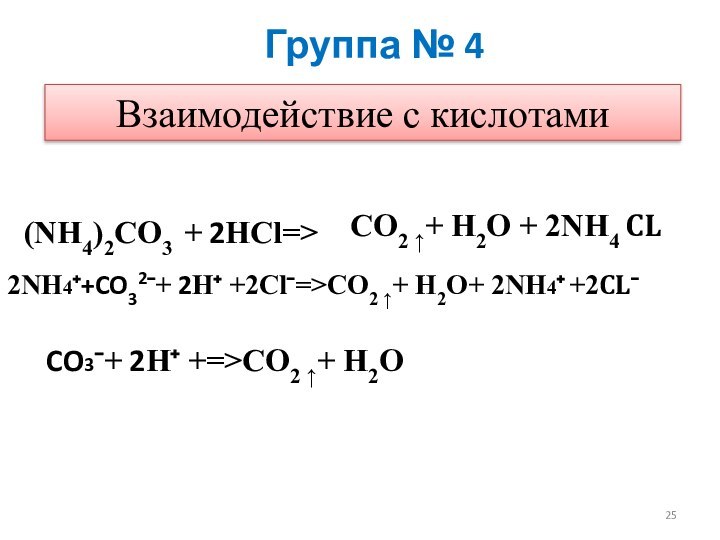
Слайд 25
Группа № 4
Взаимодействие с кислотами
(NH4)2СO3 + 2НCl=>
СО2 ↑+
Н2О + 2NH4 CL
2NH4⁺+CO32⁻+ 2Н⁺ +2Cl⁻=>СО2 ↑+ Н2О+ 2NH4⁺
+2CL⁻CO3⁻+ 2Н⁺ +=>СО2 ↑+ Н2О
Слайд 27
Особые свойства солей аммония
Разложение солей аммония
(NH4)2Cr2O7 =
N2 + Cr2O3 + 4H2O
3(NH4)2SO4 => N2 + 3SO2
+ 6H2О + 4NH3NH4NO2 => N2 + 2H2O
(NH4)2CO3 => 2NH3 + CO2 + H2O
Слайд 29
Опыт «Фараонова Змея»
(NH4)2Cr2O7 = Cr2O3 + N2↑ +
4H2O
2KNO3 = O2↑ + 2KNO2
C12H22O11 + 6O2 =
6CO2↑ + 11H2O + 6C
Слайд 31
«Да» или «нет»
1)Ион аммония имеет заряд -1
2) Соли
аммония белые кристаллические вещества
3) Все соли аммония хорошо
растворимы в воде 4)Дыма без огня не бывает
5)Соли аммония обладают всеми свойствами солей
6)Ион аммония имеет форму пирамиды
7)степень окисления азота в ионе аммония -4
8)Соли аммония можно определить действием щёлочи
9) Аммиак не имеет характерного запаха
10) соли аммония – минеральные удобрения
11)нашатырный спирт – это раствор аммиака в воде
НЕТ
ДА
НЕТ
ДА
ДА
ДА
ДА
ДА
ДА
НЕТ
НЕТ