Слайд 2
4. Гольдберт К.А., Вигдергауз М.С. Введение в газовую
хроматографию. М: Химия, 1990. 352 с.
5. Рудаков О.Б., Востров
И.А. и др. Спутник хроматографиста. Методы жидкостной хроматографии. Воронеж: Водолей, 2004. 528 с.
6. Барам Г.И. Курс лекций “ВЭЖХ для всех”. Новосибирск. 2007.
7. Стыскин Е.Л., Ициксон Л.Б., Брауде Е.В. Практическая высокоэффективная жидкостная хроматография. Москва, 1986. 280 с.
8. Руководство по капиллярному электрофорезу. / Под ред. А.М. Волощука, Научный совет по хроматографии. М.: Наука, 1996.
Слайд 3
9. Пецев Н., Коцев Н. Справочник по газовой
хроматографии: Пер. с болг. М:Мир, 1987. 260 с.
10. Король
А.Н. Неподвижные фазы в газожидкостной хроматографии. М: Химия, 1985. 240 с
Слайд 4
Основные понятия и определения
Хроматография
– физико-химический метод разделения веществ,
основанный на распределении компонентов между двумя фазами: неподвижной и
подвижной;
– аналитический метод, позволяющий разделять многокомпонентную смесь (газообразные, жидкие и твердые вещества с различной молекулярной массой), идентифицировать компоненты и определять количественный состав смеси.
Слайд 5
Основные понятия и определения
Сущность метода хроматографии - разделяемые
вещества перемещаются через слой неподвижной фазы вместе с подвижной
фазой (жидкой или газообразной) с разной скоростью вследствие различной сорбируемости.
Компоненты анализируемой смеси должны хорошо растворяться в подвижной фазе и иметь умеренное сродство к неподвижной фазе.
Константы равновесия компонентов смеси должны достаточно различаться, чтобы было возможно их разделение.
Слайд 6
Особенность процесса хроматографирования - многократность повторения сорбции вещества
на поверхности сорбента и десорбции с поверхности сорбента, что
обеспечивает высокую эффективность разделения.
Растворенное вещество, покидающее жидкую фазу вместе с элюентом называется элюатом.
Процесс перемещения образца с элюентом называется элюированием.
Основные понятия и определения
Слайд 7
Сорбцию можно осуществить двояко:
статическая сорбция –
процесс протекает при относительном покое обеих фаз и завершается
установлением равновесного распределения веществ между фазами.
динамическая сорбция – процесс, в котором происходит направленное перемещение подвижной фазы относительно неподвижной
Основные понятия и определения
Слайд 8
Основные понятия и определения
Классификация хроматографических методов
1. По агрегатному
состоянию фаз
Слайд 9
Основные понятия и определения
Классификация хроматографических методов
2. По механизму
взаимодействия сорбента и сорбата:
- распределительная: основана на различии в
растворимости разделяемых веществ в НФ;
- ионообменная: основана на разной способности веществ к ионному обмену;
- адсорбционная: основана на различной сорбируемости веществ твердым сорбентом;
- эксклюзионная: на различии размеров и форм молекул разделяемых веществ;
- аффинная: на специфических взаимодействиях.
Слайд 10
Основные понятия и определения
Классификация хроматографических методов
3. По технике
выполнения:
- колоночная (набивные и капиллярные колонки);
- плоскостная (бумажная и
тонкослойная).
4. по способу проведения процесса:
- фронтальная;
- вытеснительная;
- проявительная.
Слайд 11
Основные понятия и определения
Классификация хроматографических методов
5.
По цели проведения хроматографических процессов:
Аналитическая хроматография – установление качественного
и количественного состава смесей;
Неаналитическая хроматография – исследование физико-химических характеристик сорбатов: давления пара, теплот растворения, коэффициентов активности;
Препаративная хроматография – получение веществ в чистом виде;
Промышленная хроматография – получение индивидуальных веществ, например, лекарственных препаратов в больших количествах.
Слайд 12
Хроматограф включает в свой состав:
систему подготовки газов (установка,
стабилизация и очистка потоков газа);
систему подачи в колонку газа-носителя
с постоянной объемной скоростью.
Системы имеют автоматические регуляторы давления и (или) расхода газа-носителя.
систему ввода пробы – дозирующее устройство, позволяющее вводить в поток газа-носителя непосредственно перед колонкой определенное количество анализируемой смеси в парообразном состоянии.
Основные понятия и определения
Слайд 13
Разделенные в колонке компоненты с газом-носителем подаются в
детектор, который преобразует возникающее изменение физических или физико-химических свойств
бинарных смесей (по сравнению с чистым газом-носителем) в электрический сигнал.
Величина сигнала зависит как от природы компонента, так и от содержания его в анализируемой смеси.
детектор с системой сбора и обработки данных;
систему термостатирования: колонки, детекторы, дозирующие устройства помещены в термостаты, управляемые терморегулятором.
Если необходимо повышать температуру кипения в процессе анализа, используют программатор температуры колонки.
Слайд 14
Детектор – прибор непрерывного действия, дающий отклик на
соединения в элюате.
Комплект современного газового хроматографа содержит 4-6
детекторов.
Подразделяются:
– на селективные и универсальные;
– на интегральные и дифференциальные,
– на потоковые и концентрационные.
Наибольшее распространение получили в силу универсальности, превосходных характеристик и высоких эксплуатационных качеств, детекторы ПИД и ДТП.
Слайд 15
Интегральный детектор – регистрирует изменение во времени суммарного
количества выходящего из колонки компонента, например, общий объем или
количество раствора, израсходованного на нейтрализацию анализируемого вещества.
Эти детекторы имеют весьма ограниченное применение из-за большой инерционности и недостаточной универсальности.
Слайд 16
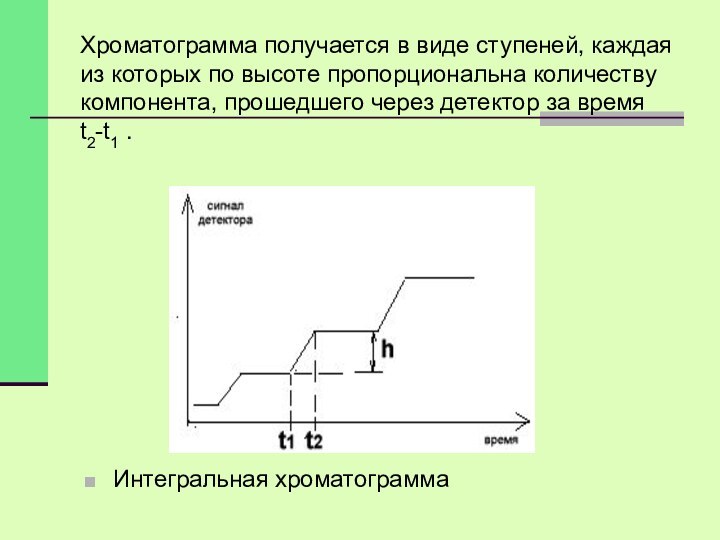
Хроматограмма получается в виде ступеней, каждая из которых
по высоте пропорциональна количеству компонента, прошедшего через детектор за
время t2-t1 .
Интегральная хроматограмма
Слайд 17
Дифференциальный детектор – измеряет мгновенную концентрацию или массовую
скорость вещества в потоке газа-носителя.
Хроматограмма представляет собой ряд пиков,
причем количество каждого компонента пропорциональна площади А соответствующего пика.
Дифференциальная хроматограмма
Слайд 18
При использовании потокового детектора все количество анализируемого компонента
успевает однократно зарегистрироваться вне зависимости от скорости пропускания (ПИД
- сгорание органических соединений);
тогда как в концентрационном детекторе от скорости зависит число актов регистрации каждой молекулы и, чем больше скорость, тем меньше актов взаимодействия при одном и том же числе молекул (ДТП).
При измерении площадей пиков потоковые детекторы более предпочтительны из-за независимости их показаний от колебаний давления и расхода.
Слайд 19
Характеристики детекторов
Чувствительность – характеризует отношение сигнала детектора к
количеству вещества.
От чувствительности зависит выбор величины пробы и возможность
использования различных типов колонок.
Применение высокочувствительных детекторов позволяет уменьшить величину вводимой пробы, что улучшает качество разделения компонентов анализируемой смеси.
Слайд 20
Предел детектирования - минимальная концентрация анализируемого вещества в
потоке газа-носителя, которая может быть зарегистрирована Сmin.
Для этого нужно
знать, какое наименьшее значение сигнала детектора можно измерить, учитывая уровень флуктуационных шумов нулевой линии прибора.
Нулевая линия (Base Line). Сигнал детектора, когда из колонки не элюируется вещество.
Слайд 21
Нестабильностями нулевой линии являются дрейф и шумы.
Дрейф нулевой
линии (Base Line Drift). Любое низкочастотное изменение сигнала детектора.
Дрейф часто возникает из-за изменений объемной скорости газа-носителя, иногда связанных с дрейфом температуры термостата колонок.
В анализе с программированием температуры обусловлен уносом неподвижной фазы из колонки.
Может быть обусловлен элюированием больших количеств очень сильно удерживаемого вещества, введенного задолго до того, как был начат текущий анализ.
Шумы (Noise). Высокочастотные флуктуации сигнала нулевой линии детектора.
Слайд 22
Наименьший детектируемый полезный сигнал
Минимальным сигналом Еmin, поддающимся измерению,
принято считать сигнал, амплитуда которого вдвое превышает уровень шумов
δ: Еmin= 2 δ.
Слайд 23
Концентрация анализируемого вещества, вызывающего этот сигнал, для концентрационного
детектора:
Сmin= Еmin / Rс = 2 δ / Rс
, где
Rс = А * V * F / qw , где А-площадь пика,
V-чувствительность,
F-скорость газа-носителя, мл/с,
q-масса компонента,
w-скорость ленты, см/с.
Слайд 24
Для потокового детектора:
Сmin= 2 δ / Rj *
F , где
Rj = A * V / q
* w
Предел детектирования наиболее часто выражают в мг/мл; мл/мл; %об.
Слайд 25
В повседневной практике часто путают понятия «чувствительность» и
«предел детектирования», понимая под чувствительностью минимальные концентрации, определяемые детектором.
Чувствительность
характеризуется наклоном зависимости сигнал детектора - концентрация вещества,
а предел детектирования – отрезком на оси абцисс, соответствующим точке пересечения градуировки с ординатой, равной минимальному сигналу, доступному для измерения (двойной уровень шума 2δ).
Слайд 26
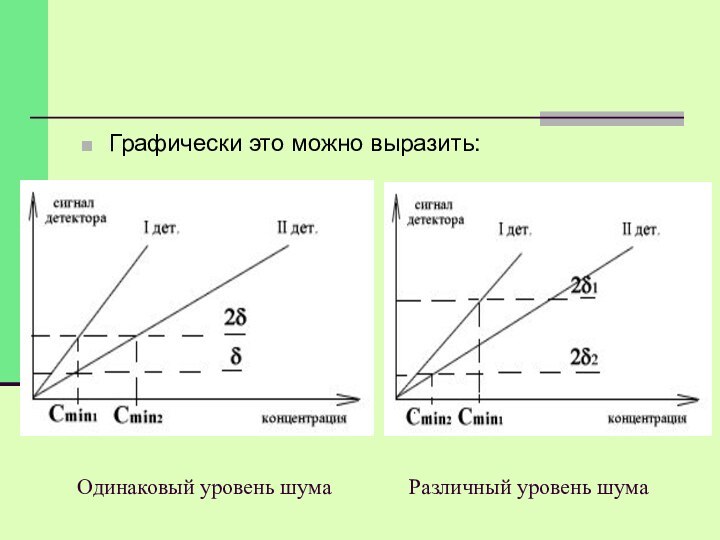
Одинаковый уровень шума
Различный уровень шума
Графически это можно выразить:
Слайд 27
Предельные возможности хроматографа в отношении измерения малых концентраций
могут быть расширены двумя независимыми путями: увеличением чувствительности и
уменьшением шумов.
Следует подчеркнуть, что предел детектирования соответствует концентрации вещества в ПФ, а не концентрации анализируемых веществ в пробе при введении в колонку.
Учитывая процесс размывания пробы нужно иметь ввиду, что практически измеренная минимальная концентрация вещества в пробе, по крайней мере, в 5-10 раз выше предела детектирования.
Слайд 28
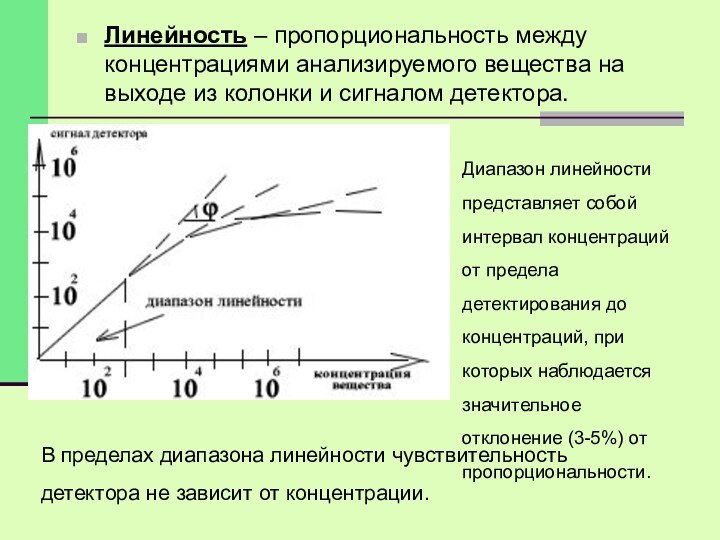
Линейность – пропорциональность между концентрациями анализируемого вещества на
выходе из колонки и сигналом детектора.
Диапазон линейности представляет собой
интервал концентраций от предела детектирования до концентраций, при которых наблюдается значительное отклонение (3-5%) от пропорциональности.
В пределах диапазона линейности чувствительность детектора не зависит от концентрации.
Слайд 29
Селективность детектора
определяют по отношению чувствительности одного
детектора к двум веществам
S = Rа / Rв
При этом
детектор считается селективным, если его чувствительность для двух веществ различается не меньше, чем на порядок.
Слайд 30
Воспроизводимость – характеризуется стандартным отклонением серии сигналов при
вводе одних и тех же проб.
Стабильность работы – характеризуется
низкой чувствительностью к колебаниям температуры и скорости потока подвижной фазы.
Слайд 31
Коэффициент распределения D - описывает равновесие при распределении
вещества между неподвижной и подвижной фазами
D = cнеподв/сподв = cS/cm ,
Для каждого вида хроматографии D имеет свое название:
в распределительной и ионообменной – коэффициент разделения,
в адсорбционной – коэффициент адсорбции, в гель-фильтрационной – коэффициент проницаемости
Теоретические основы хроматографии
Основные характеристики
Слайд 32
Теоретические основы хроматографии
Основные характеристики
Слайд 33
Характеристики пиков:
Время удерживания, ширина и форма
Время удерживания
tR – время от момента ввода пробы в колонку
до появления на выходе из колонки максимума пика
Время удерживания складывается:
tR = tm + ts ,
где tm – время пребывания в подвижной фазе, ts – время пребывания в неподвижной фазе,
tm – фактически равно времени прохождения через колонку несорбируемого компонента
Теоретические основы хроматографии
Основные характеристики
Слайд 34
tR - не зависит от количества пробы, но
зависит от природы вещества и сорбента, а также от
упаковки сорбента
Поэтому для характеристики истинной удерживающей способности применяют исправленное время удерживание tR’
tR’ = tR – tm
Теоретические основы хроматографии
Основные характеристики
Слайд 35
Объем удерживания VR = tR* F,
где F –
объемная скорость потока
Исправленный объем удерживания
VR’ = VR –
Vm ,
где Vm - мертвый объем (объем, необходимый для вымывания несорбируемого компонента) включает объем колонки, незанятой сорбентом
Теоретические основы хроматографии
Основные характеристики
Слайд 36
Коэффициент (индекс) удерживания R показывает долю времени нахождения
вещества в подвижной фазе
R = tm/tR
= Vm/VR
Коэффициент распределения связан с хроматографическими параметрами
ts/tm = csVs/cmVm = D* Vs/Vm
Так как R = tm/tR = tm/(tm+ ts) =1/(1 + ts/tm),
то получаем R = 1/(1 + D*Vs/Vm) = Vm/(Vm+ DVs)
Теоретические основы хроматографии
Основные характеристики
Слайд 37
Так как R = Vm/VR , то
VR = Vm + DVs
D* Vs/Vm называют коэффициентом емкости k’
k’ – обычно равен 1 – 5
k’ вычисляют по экспериментальным данным
k’ = (VR-Vm)/Vm = VR’/Vm = tR’/tm
Коэффициент емкости показывает во сколько раз вещество находится дольше в неподвижной фазе, чем в подвижной
Теоретические основы хроматографии
Основные характеристики
Слайд 38
Если k’ значительно меньше 1, то вещество слабо
удерживается и продвигается по колонке со скоростью практически равной
скорости подвижной фазы
Если k’ >20, то на практике это приводит к неприемлемо большим временам удерживания
Теоретические основы хроматографии
Основные характеристики
Слайд 39
Исправленный объем удерживания связан с D соотношением
VR’ = VR –Vm = D*Vs - основное
уравнение
хроматографии
Vs – зависит от количества неподвижной фазы (жидкой фазы, нанесенной на единицу объема или массы сорбента), от длины и диаметра колонки
Теоретические основы хроматографии
Основные характеристики
Слайд 40
Коэффициент разделения (селективности) компонентов А и В
α
= kВ’/kА’ α = DА/DВ
α = (tR’)B/(tR’)A
Является мерой разделения двух веществ
Теоретические основы хроматографии
Основные характеристики
Слайд 41
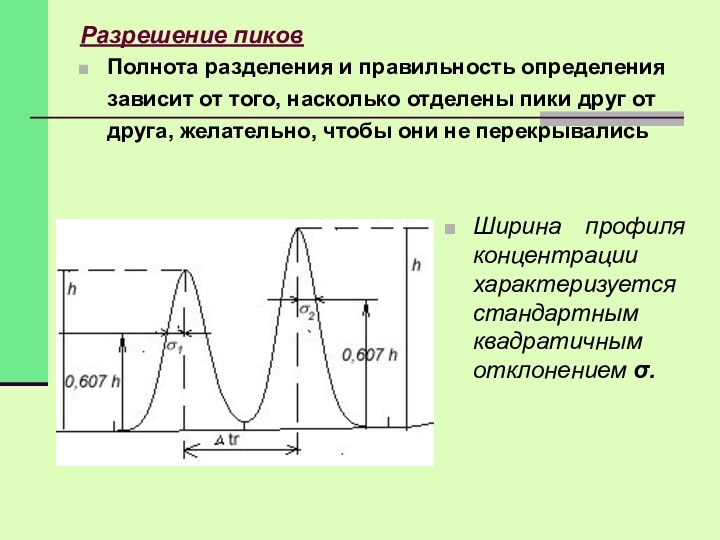
Разрешение пиков
Полнота разделения и правильность определения зависит от
того, насколько отделены пики друг от друга, желательно, чтобы
они не перекрывались
Т
Ширина профиля концентрации характеризуется стандартным квадратичным отклонением σ.
Слайд 42
Условия раздельной регистрации концентрационного профиля двух компонентов:
Достаточное разделение
происходит, если
ΔtR = 2 (σ1 + σ2);
Перекрытие (наложение) пиков настолько велико, что оба компонента воспринимаются детектором как пик с одним максимумом при ΔtR ≤ σ1 + σ2;
Практически полное разделение происходит при
ΔtR ≥ 3 (σ1 + σ2).
Теоретические основы хроматографии
Основные характеристики
Слайд 43
Для характеристики разделения пиков служит величина, называемая разрешением
Rs
Rs
= (tR(A) –tR(B))*2/(wA +wB)
Если wA ≈ wB , то Rs = ΔtR/w
Слайд 44
Теоретические основы хроматографии
Теория хроматографии
Для объяснения явлений, происходящих при
хроматографировании, для расчета длины колонок, положения и формы пиков,
для выбора оптимальных условий процессов существует два подхода – теория теоретических тарелок и кинетическая теория
Теория теоретических тарелок рассматривает процесс хроматографирования как результат совокупности дискретных актов распределения в колонке в целом
Теоретическая тарелка – абстрактная величина, ее можно представить в виде узкого слоя колонки, в котором достигается равновесие между подвижной и неподвижной фазами
Слайд 45
Т
Мартин и Синг (Нобелевская премия, 1952 г.) ввели
понятие высоты, эквивалентной теоретической тарелке H, (ВЭТТ) и число
теоретических тарелок N
Если вещество движется по колонке, это означает, что происходит последовательный переход от одного акта разделения или одного равновесия к другому
Число теоретических тарелок N рассчитывается как отношение общей длины колонки L к высоте, эквивалентной теоретической тарелке, Н:
N = L / H
Теоретические основы хроматографии
Теория хроматографии
Слайд 46
Высота тарелки и число теоретических тарелок
характеризуют эффективность колонки.
Высота, эквивалентная теоретической тарелке, рассчитывается:
Дисперсия σL2
, относящаяся к длине колонки, измеряется в см2,
σt2 , относящаяся к времени удерживания, в с2.
Теоретические основы хроматографии
Теория хроматографии
Слайд 47
Теоретические основы хроматографии
Теория хроматографии
Для ширины у основания w
= 4 σt , с учетом этого:
Разрешение, с использованием
выражения для расчета числа теоретических тарелок, описывается уравнением:
Слайд 48
Если коэффициенты емкости близки, то часто используется уравнение
в упрощенной форме:
Если известно разрешение, то зная коэффициент селективности
и коэффициент емкости для компонента В:
Теоретические основы хроматографии
Теория хроматографии
Слайд 49
Однако теория теоретических тарелок не позволяет выявить зависимости
N и Н от скорости подачи подвижной фазы, природы
и дисперсии сорбента, не позволяет определить причины размывания пиков
С позиций кинетической теории вполне объяснима форма пиков в виде гауссовой кривой
Теоретические основы хроматографии
Теория хроматографии
Слайд 50
Хроматограмма отражает статистическое поведение множества молекул, а не
индивидуальной молекулы.
Из-за случайного стечения обстоятельств одни молекулы могут передвигаться
с несколько более высокими скоростями, чем другие
Поэтому наблюдаются отклонения от среднего значения скорости движения в ту или иную сторону, что выражается кривой распределения
Форма пика отражает поведение усредненной молекулы
Теоретические основы хроматографии
Теория хроматографии
Слайд 51
Теоретический подход, объясняющий размывание пиков, основан на изучении
форм изотерм сорбции – графической зависимости количества вещества в
неподвижной фазе сs от его концентрации в подвижной фазе сm при Т=const
Угол наклона изотермы равен D= dсs/dсm
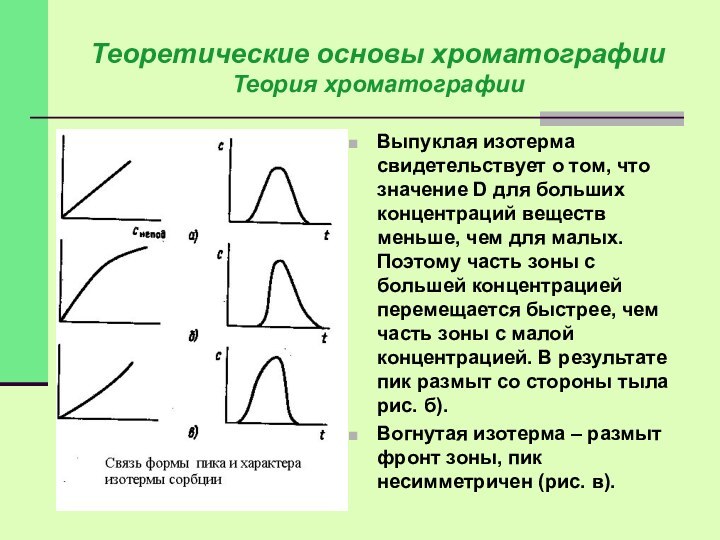
Если изотерма линейна – пик симметричен, D=const. Концентрация вещества максимальна в центре зоны и симметрично убывает по краям. Каждый компонент перемещается с постоянной скоростью, с такой же скоростью перемещается вся зона (рис. а).
На практике - когда количества вводимых веществ малы изотерма линейна
Теоретические основы хроматографии
Теория хроматографии
Слайд 52
Теоретические основы хроматографии
Теория хроматографии
Выпуклая изотерма свидетельствует о том,
что значение D для больших концентраций веществ меньше, чем
для малых. Поэтому часть зоны с большей концентрацией перемещается быстрее, чем часть зоны с малой концентрацией. В результате пик размыт со стороны тыла рис. б).
Вогнутая изотерма – размыт фронт зоны, пик несимметричен (рис. в).
Слайд 53
Обычно работают в областях, характеризующихся линейной изотермой.
На продвижение
частиц влияет ряд факторов, искажающих форму пика и снижающих
эффективность колонки:
структура неподвижной фазы (размеры гранул, их однородность, плотность и равномерность заполнения колонки);
cкорость установления равновесия сорбции-десорбции (массообмен);
диффузия молекул из зоны большей концентрации в зону меньшей концентрации.
Теоретические основы хроматографии
Теория хроматографии
Слайд 54
Влияние этих факторов на эффективность колонки учитывает кинетическая
теория, разработанная Ван-Деемтером.
Согласно этой теории размывание пиков обусловлено тремя
независимыми вкладами, учитывающими неравномерность потока
H = A + B/v + Cv,
где А – слагаемое, учитывающее вихревую диффузию,
B/v – молекулярную диффузию,
Cv – отклонения от сорбционного равновесия (сопротивление массопереносу),
v – скорость потока.
Теоретические основы хроматографии
Теория хроматографии
Слайд 55
Вихревая диффузия связана со структурой сорбента и изменяется
по длине колонки.
А –
описывает расстояние , проходимое потоком подвижной фазы до того, как его скорость значимо изменяется под действием сорбента;
A = 2 λdp, где λ - коэффициент гомогенной упаковки колонки (0,8-0,1);
плохая упаковка приводит к увеличению λ и уширению полосы вихревой диффузии. Поэтому колонку необходимо заполнять мелким и однородным сорбентом;
А – не зависит от скорости потока.
Теоретические основы хроматографии
Теория хроматографии
Слайд 56
Молекулярная (продольная) диффузия
обусловливает размывание полос
из-за миграции молекул в подвижной фазе из участков с
большей концентрацией в сторону участков с меньшей концентрацией.
В = 2γDm/v , где γ – коэффициент, учитывающий ограниченность движения диффузии в наполненной колонке (γ<1),
Dm- коэффициент диффузии вещества.
Эффективность колонки выше при применении мелких и однородных сорбентов.
Теоретические основы хроматографии
Теория хроматографии
Слайд 57
Dm в жидкости значительно ниже, чем в газе,
поэтому массообмен в жидкостной хроматографии и В не имеет
большого значения при скоростях потока, используемых в ЖХ, однако, в ГХ он очень важен
Влияние продольной диффузии на высоту Н обратно пропорционально линейной скорости подвижной фазы
Теоретические основы хроматографии
Теория хроматографии
Слайд 58
Диффузия уменьшается при увеличении линейной скорости подвижной фазы,
Н
– уменьшается при увеличении линейной скорости из-за эффектов массопереноса
Этот
эффект возникает потому, что для массопереноса между фазами требуется конечное время.
В проточной системе недостаточно времени для достижения состояния равновесия, так что уменьшение массопереноса становится более очевидным при увеличении скорости потока
Теоретические основы хроматографии
Теория хроматографии
Слайд 59
Сопротивление массопереносу Сv учитывает размывание пика за счет
сопротивления массопереносу при непрерывном переходе вещества из подвижной фазы
в неподвижную и обратно, т.е. характеризует распределение вещества между двумя фазами.
CV = Csv + Cmv, где Cs и Cm – коэффициенты массопереноса в неподвижной и подвижной фазах соответственно.
Теоретические основы хроматографии
Теория хроматографии
Слайд 60
Теоретические основы хроматографии
Теория хроматографии
Приравнивая к нулю dH/dv, получаем
скорость, отвечающую минимальному значению Н:
Откуда:
Слайд 61
Эффективное разделение за более короткое время достигается при
небольшой высоте тарелки Н.
Нmin – достигается:
Малым размером твердых частиц
или малой толщиной жидкого покрытия неподвижной фазы;
Гомогенной упаковкой неподвижной фазы с выравненным размером частиц;
Малым диаметром колонки;
Большими коэффициентами диффузии в неподвижной фазе и малыми коэффициентами диффузии в подвижной фазе.
Теоретические основы хроматографии
Теория хроматографии
Слайд 62
В ГХ коэффициенты диффузии в подвижной фазе могут
быть значительно уменьшены снижением температуры.
Поскольку коэффициенты диффузии для различных
размеров молекул различаются, размывание пиков также зависит от относительной молекулярной массы.
Малые молекулярные массы разделяемых веществ также способствуют повышению эффективности колонки.
Теоретические основы хроматографии
Теория хроматографии
Слайд 63
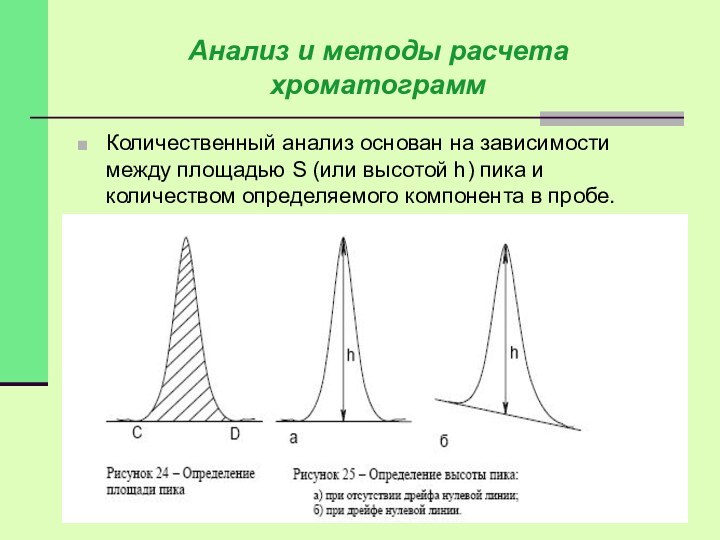
Количественный анализ основан на зависимости между площадью S
(или высотой h) пика и количеством определяемого компонента в
пробе.
Анализ и методы расчета хроматограмм
Слайд 64
[S]=[мм2];[A*с];[В*с]
[h]=[мм]
Анализ и методы расчета хроматограмм
Слайд 65
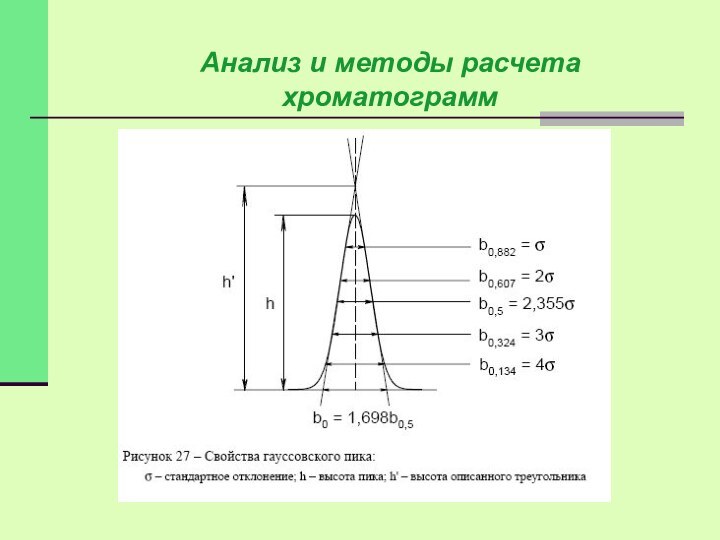
Наиболее просто измеряются и рассчитываются параметры гауссовых пиков.
Контур
этих пиков описывается уравнением:
Анализ и методы расчета хроматограмм
Слайд 66
Анализ и методы расчета хроматограмм
Слайд 67
Расчет площади пика как площади, ограниченной гауссовой кривой
(для симметричных пиков), проводят по формуле, полученной интегрированием гауссовой
функции:
Анализ и методы расчета хроматограмм
Пик считается гауссовым если:
b0.5=1.67-1.73 - критерий Эттре
Слайд 68
Ассиметричность пика может быть вызвана:
1. Перегрузкой колонки анализируемым
веществом (рис. а);
2. Наличием остаточной адсорбционной активности твердого носителя
(рис. б).
Анализ и методы расчета хроматограмм
Слайд 69
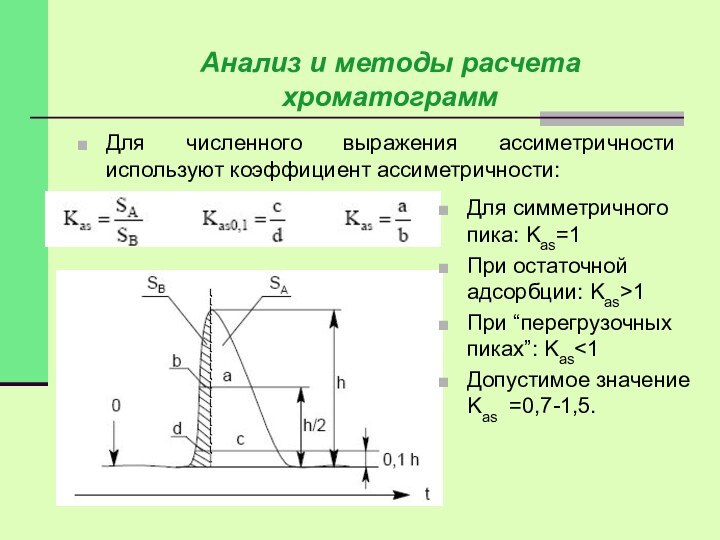
Для численного выражения ассиметричности используют коэффициент ассиметричности:
Анализ и
методы расчета хроматограмм
Для симметричного пика: Kas=1
При остаточной адсорбции: Kas>1
При
“перегрузочных пиках”: Kas<1
Допустимое значение Kas =0,7-1,5.
Слайд 70
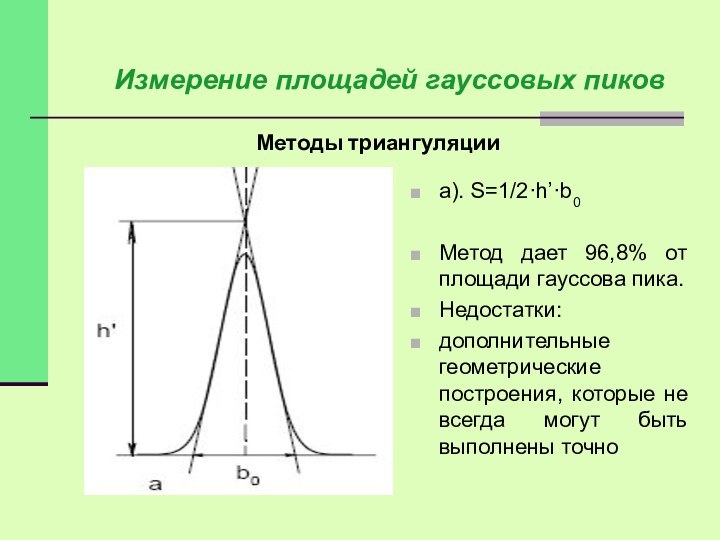
Методы триангуляции
Измерение площадей гауссовых пиков
а). S=1/2·h’·b0
Метод дает 96,8%
от площади гауссова пика.
Недостатки:
дополнительные геометрические построения, которые не всегда
могут быть выполнены точно
Слайд 71
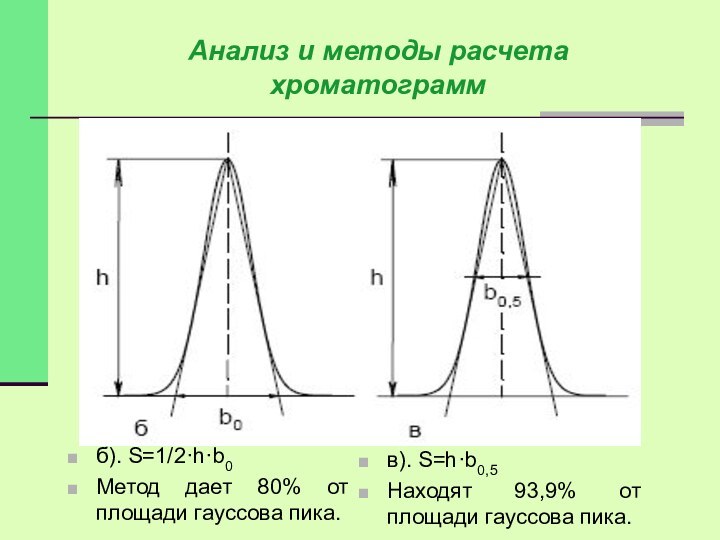
Анализ и методы расчета хроматограмм
б). S=1/2·h·b0
Метод дает 80%
от площади гауссова пика.
в). S=h·b0,5
Находят 93,9% от площади гауссова
пика.
Слайд 72
Истинная площадь гауссова пика может быть найдена:
Sист=h·b0.368
Анализ и
методы расчета хроматограмм
Слайд 73
Количественный состав пробы определяют:
Методом нормировки (внутренней нормализации)
Методом внешней
стандартизации (абсолютной градуировки)
Методом внутренней стандартизации (нормализации)
Анализ и методы расчета
хроматограмм
Слайд 74
Метод нормировки применяется наиболее часто.
Для его применения
необходимо, чтобы на хроматограмме были зарегистрированы все компоненты, входящие
в состав анализируемой смеси.
Доля площади пика соответствует содержанию компонента в мас. %.
Анализ и методы расчета хроматограмм
Слайд 75
При анализе смеси трех компонентов, относительное содержание компонентов
рассчитывают
Х,% = 100 % * Sx /(Sx +Sy +Sz )
при условии одинаковой чувствительности детектора к каждому из разделяемых компонентов
Анализ и методы расчета хроматограмм
Слайд 76
Если чувствительность детектора различна по отношению к каждому
компоненту пробы, то используют поправочные коэффициенты f:
х,% = 100 % * Sx* fx /ΣSn*fn
Поправочные коэффициенты получают при анализе стандартных серий и рассчитывают по формуле:
fx = fст * Sст *cx / Sx*cст
Анализ и методы расчета хроматограмм
Слайд 77
Метод внешней стандартизации (абсолютной градуировки)
Используют при определении отдельных
веществ в простых смесях, при определении микропримесей
Метод предполагает построение
градуировочного графика по стандартным смесям, как и в других методах анализа
Анализ и методы расчета хроматограмм
Слайд 78
Метод внутренней стандартизации применяют при отсутствии на хроматограмме
пиков некоторых компонентов смеси
Метод основан на том, что в
анализируемую смесь вводят определенное количество стандартного вещества. Это вещество должно быть инертным, отсутствовать в пробе и полностью отделяться от других компонентов смеси, tR должно быть близким к tR определяемого вещества, пик симметричным
Анализ и методы расчета хроматограмм
Слайд 79
Сi =k*Сст* Si /Sст;
x%
=100 %*k*r* Si /Sст
Поправочный коэффициент k рассчитывают по
стандартной смеси внутреннего стандарта и определяемого соединения:
k = Sст *Сх /Sx *Cст ;
r =mст/mпробы
Анализ и методы расчета хроматограмм
Слайд 80
Качественный анализ
Время удерживания, объем удерживания - характеризуют природу
анализируемого вещества
Идентификация по времени удерживания
Совпадение величин удерживания неизвестного и
стандартного соединения свидетельствует об идентичности этих веществ
При использовании данных, полученных на разных хроматографах (или справочных данных), более надежна идентификация по исправленному времени удерживания tR’.
Анализ и методы расчета хроматограмм
Слайд 81
Идентификация по относительному времени удерживания
Часто для идентификации
используют величину относительного удерживания, зависящую только от состава подвижной
и неподвижной фаз:
tотн =tR‘/tR,ст
Vотн= VR’/VR,ст
Анализ и методы расчета хроматограмм
Слайд 82
Идентификация по индексам удерживания Ковача
За стандарт берут
два соседних алкана, один из которых элюируется до, а
второй после исследуемого соединения
tR‘(z)
где z – число атомов углерода в алкане.
I =100 (lgtR‘(x) – lgtR‘(z)) / (lgtR‘(z+1) ) – lgtR‘(z)) + 100z
Анализ и методы расчета хроматограмм
Слайд 83
Идентификация по линейным зависимостям параметров удерживания в
гомологическом ряду органических соединений:
lgVR’= А +
Bz
lgVR’=A + BTкип
А и В – константы, зависящие от условий анализа,
z - число углеродных атомов,
Ткип – температура кипения.
Иногда для идентификации используют химические реакции до или после хроматографирования (реакционная хроматография).
Анализ и методы расчета хроматограмм

























































![Основные понятия и определения. Хроматография [S]=[мм2];[A*с];[В*с][h]=[мм]Анализ и методы расчета хроматограмм](/img/tmb/15/1424709/bce8f42bb1f14d50c8526fb73aca511b-720x.jpg)