- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Радиационное воздействие
Содержание
- 2. Определение биологической дозиметрии (по M.L.Mendelsohn, 1991)Оценка величины
- 3. К вопросу о терминахНеобходимость развития методов биологической
- 4. Цитогенетическая оценка дозы по средней частоте дицентриков
- 5. Прогноз тяжести костномозгового синдромаПри обследовании пациентов с
- 6. Прогноз тяжести костномозгового синдрома: ЧАЭСВ Таблице приведена
- 7. Неравномерное облучение: метод DolphinY / (1 –
- 8. Неравномерное облучение: Qdr-методQdr = X / NU
- 9. Неравномерное облучение: соотношениеF =(Nd/NPd)×104, где F −
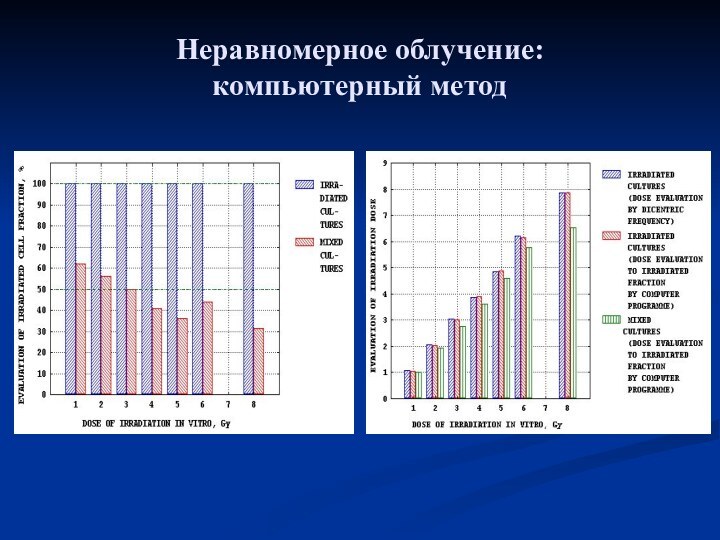
- 10. Неравномерное облучение: компьютерный методF(n) = ∫ f(D)F[n,
- 11. Неравномерное облучение: компьютерный метод
- 12. Неравномерное облучение: компьютерный метод
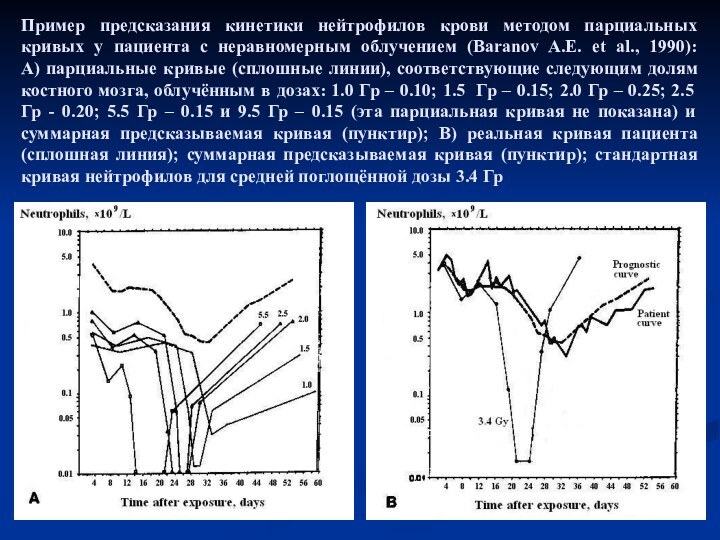
- 13. Пример предсказания кинетики нейтрофилов крови методом парциальных
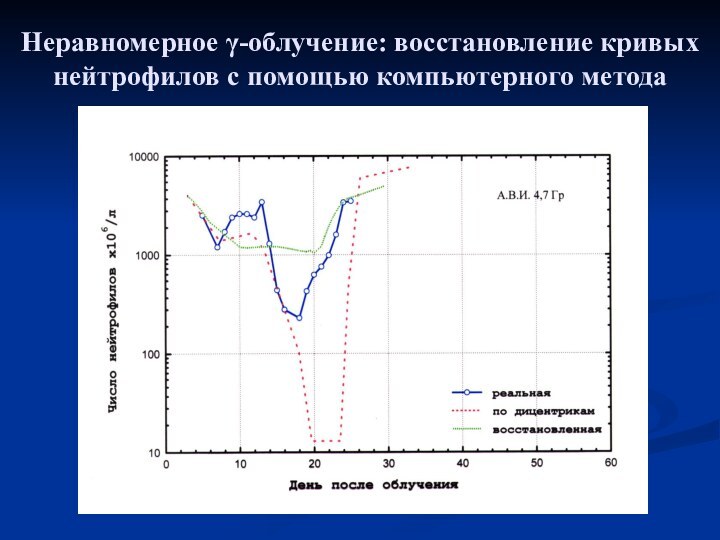
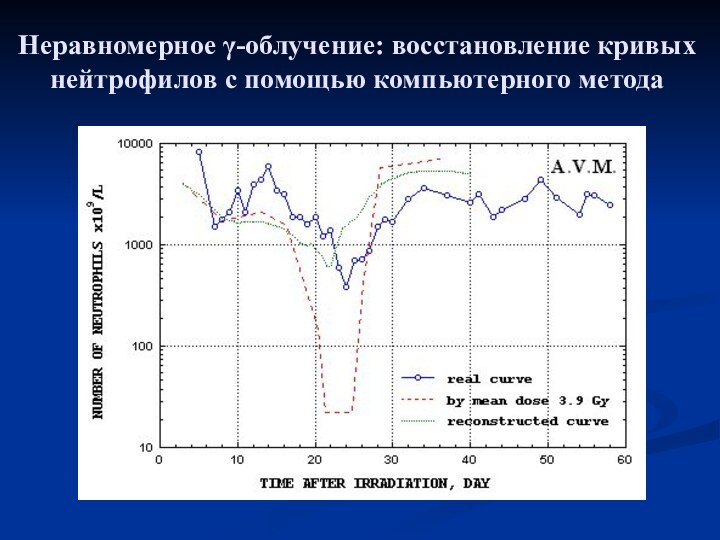
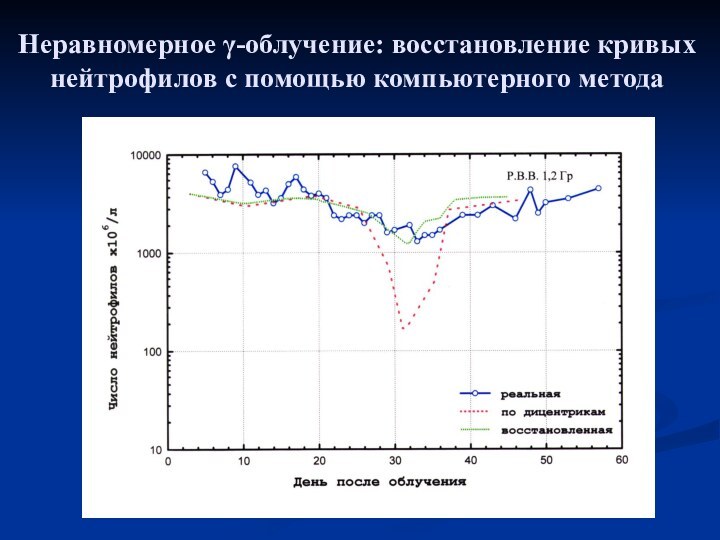
- 14. Неравномерное γ-облучение: восстановление кривых нейтрофилов с помощью компьютерного метода
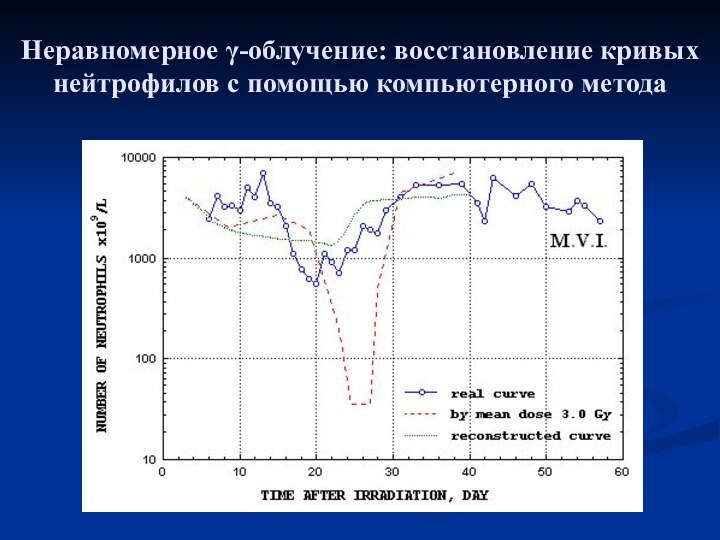
- 15. Неравномерное γ-облучение: восстановление кривых нейтрофилов с помощью компьютерного метода
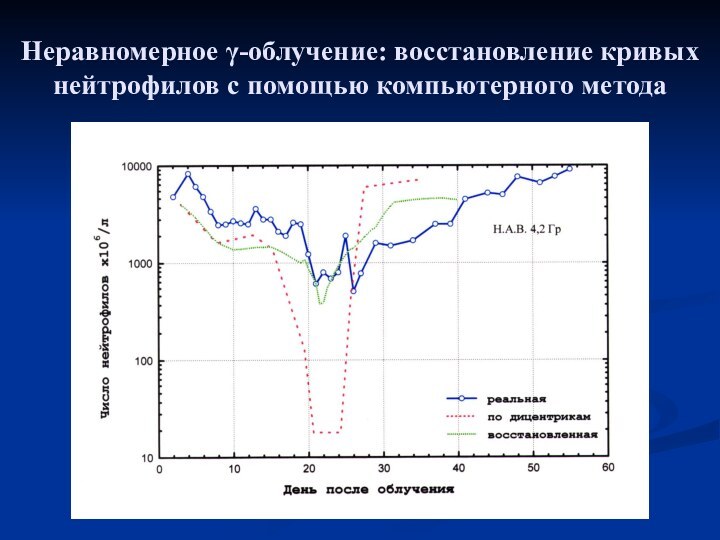
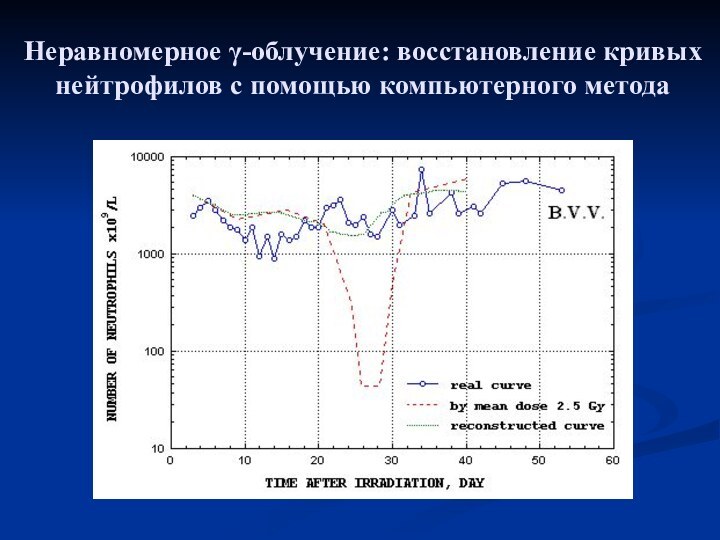
- 16. Неравномерное γ-облучение: восстановление кривых нейтрофилов с помощью компьютерного метода
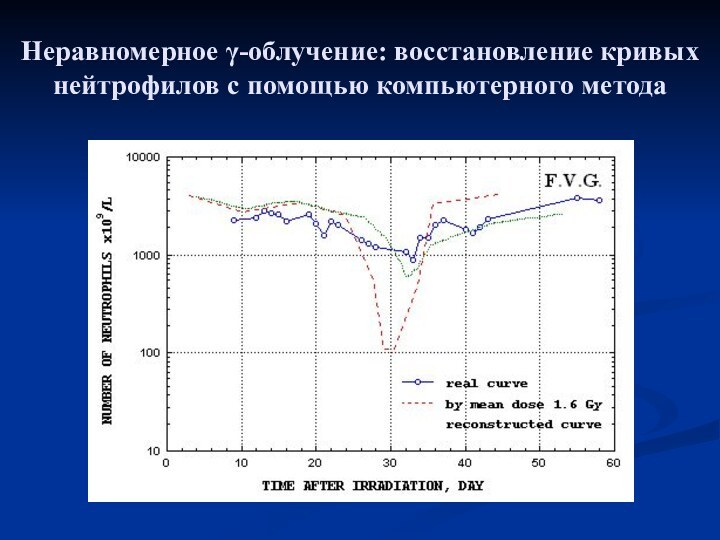
- 17. Неравномерное γ-облучение: восстановление кривых нейтрофилов с помощью компьютерного метода
- 18. Неравномерное γ-облучение: восстановление кривых нейтрофилов с помощью компьютерного метода
- 19. Неравномерное γ-облучение: восстановление кривых нейтрофилов с помощью компьютерного метода
- 20. Неравномерное γ-облучение: восстановление кривых нейтрофилов с помощью компьютерного метода
- 21. Неравномерное γ-облучение: восстановление кривых нейтрофилов с помощью компьютерного метода
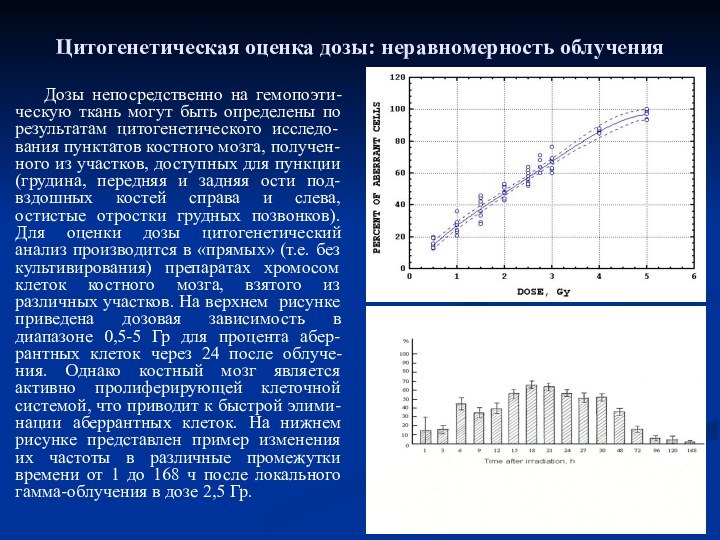
- 22. Цитогенетическая оценка дозы: неравномерность облученияДозы непосредственно на
- 23. Цитогенетическая оценка дозы: неравномерность облученияВозникает необходимость учесть
- 24. Аберрации хроматидного типа в клетках костного мозга
- 25. Аберрации хроматидного типа в клетках костного мозга
- 26. Аберрации хроматидного типа в клетках костного мозга (дозы 4-6 Гр)
- 27. Аберрации хроматидного типа в клетках костного мозга (дозы 4-6 Гр)
- 28. Аберрации хроматидного типа в клетках костного мозга (дозы 8-9 Гр)
- 29. Аберрации хроматидного типа в клетках костного мозга (дозы больше 8-9 Гр)
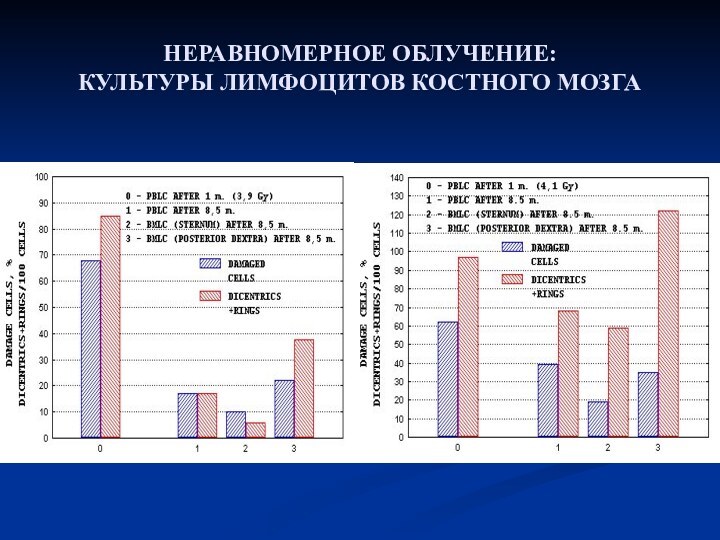
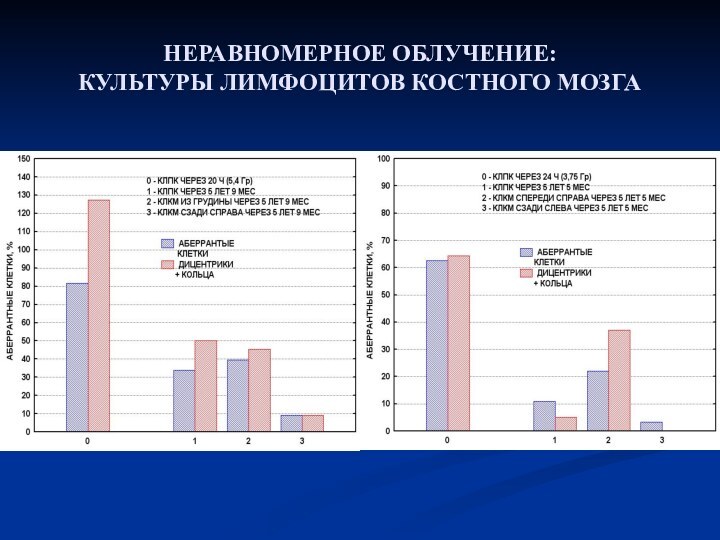
- 30. НЕРАВНОМЕРНОЕ ОБЛУЧЕНИЕ: КУЛЬТУРЫ ЛИМФОЦИТОВ КОСТНОГО МОЗГА
- 31. НЕРАВНОМЕРНОЕ ОБЛУЧЕНИЕ: КУЛЬТУРЫ ЛИМФОЦИТОВ КОСТНОГО МОЗГА
- 32. Скачать презентацию
- 33. Похожие презентации
Определение биологической дозиметрии (по M.L.Mendelsohn, 1991)Оценка величины дозы предшествующего воздействия путём измерения любыми методами (физическими, химическими, биологическими, клиническими) произошедших изменений в биологических объектах или извлечённых из них субстратов





![Радиационное воздействие Неравномерное облучение: компьютерный методF(n) = ∫ f(D)F[n, Y(D)]dD,](/img/tmb/12/1128944/13238097064f534b6dd34fd19b53e649-720x.jpg)









Слайд 2
Определение биологической дозиметрии
(по M.L.Mendelsohn, 1991)
Оценка величины дозы предшествующего
Слайд 3
К вопросу о терминах
Необходимость развития методов биологической дозиметрии
обусловлена тем, что объективно более точная физическая дозиметрия после
случайного воздействия радиации часто бывает недоступна, т.к., если и есть физический дозиметр (у профессионалов, у других лиц он отсутствует), то он скорее всего не предназначен для учёта высоких воздействий, расчётный же метод ограничен наличием достоверных сведений о временных и геометрических характеристиках облучения, обычно воспроизводимых со слов пострадавшего.Биологическая дозиметрия − это часто применяемый термин, но он некорректен с физической точки зрения. Действительно, доза есть количество энергии, поглощённой единицей массы вещества. Однако величина биологического эффекта зависит не только от дозы. Другие характеристики облучения, например, его вид, энергия, длительность и фракционированность, влияют на величину пострадиационных изменений биологического материала. Также и состояние самого этого биологического материала влияет на пострадиационные эффекты.
Поэтому более правильно говорить о биологической индикации дозы.
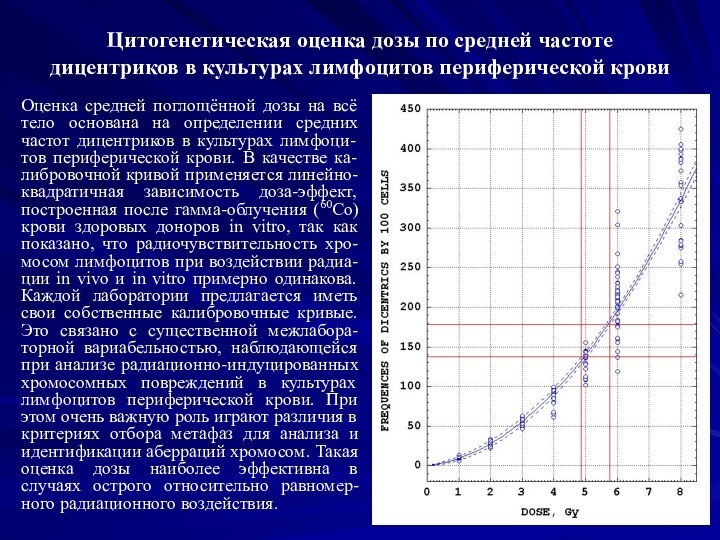
Слайд 4 Цитогенетическая оценка дозы по средней частоте дицентриков в
культурах лимфоцитов периферической крови
Оценка средней поглощённой дозы на всё
тело основана на определении средних частот дицентриков в культурах лимфоци-тов периферической крови. В качестве ка-либровочной кривой применяется линейно-квадратичная зависимость доза-эффект, построенная после гамма-облучения (60Со) крови здоровых доноров in vitro, так как показано, что радиочувствительность хро-мосом лимфоцитов при воздействии радиа-ции in vivo и in vitro примерно одинакова. Каждой лаборатории предлагается иметь свои собственные калибровочные кривые. Это связано с существенной межлабора-торной вариабельностью, наблюдающейся при анализе радиационно-индуцированных хромосомных повреждений в культурах лимфоцитов периферической крови. При этом очень важную роль играют различия в критериях отбора метафаз для анализа и идентификации аберраций хромосом. Такая оценка дозы наиболее эффективна в случаях острого относительно равномер-ного радиационного воздействия.
Слайд 5
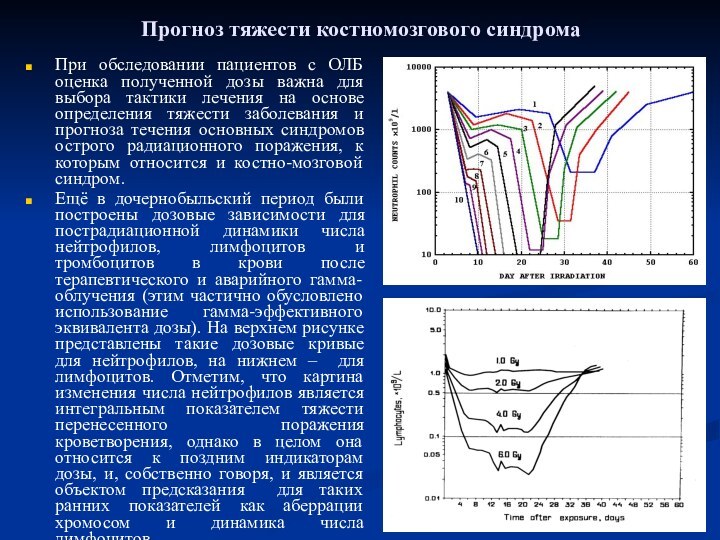
Прогноз тяжести костномозгового синдрома
При обследовании пациентов с ОЛБ
оценка полученной дозы важна для выбора тактики лечения на
основе определения тяжести заболевания и прогноза течения основных синдромов острого радиационного поражения, к которым относится и костно-мозговой синдром.Ещё в дочернобыльский период были построены дозовые зависимости для пострадиационной динамики числа нейтрофилов, лимфоцитов и тромбоцитов в крови после терапевтического и аварийного гамма-облучения (этим частично обусловлено использование гамма-эффективного эквивалента дозы). На верхнем рисунке представлены такие дозовые кривые для нейтрофилов, на нижнем – для лимфоцитов. Отметим, что картина изменения числа нейтрофилов является интегральным показателем тяжести перенесенного поражения кроветворения, однако в целом она относится к поздним индикаторам дозы, и, собственно говоря, и является объектом предсказания для таких ранних показателей как аберрации хромосом и динамика числа лимфоцитов.
Слайд 6
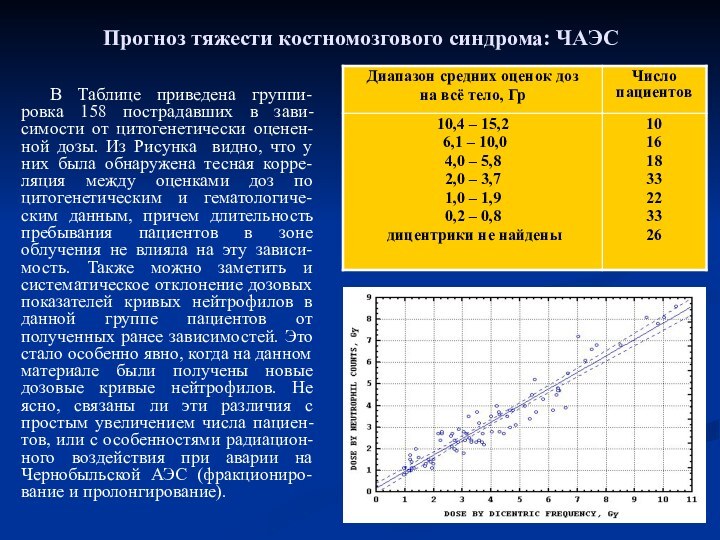
Прогноз тяжести костномозгового синдрома: ЧАЭС
В Таблице приведена группи-ровка
158 пострадавших в зави-симости от цитогенетически оценен-ной дозы. Из
Рисунка видно, что у них была обнаружена тесная корре-ляция между оценками доз по цитогенетическим и гематологиче-ским данным, причем длительность пребывания пациентов в зоне облучения не влияла на эту зависи-мость. Также можно заметить и систематическое отклонение дозовых показателей кривых нейтрофилов в данной группе пациентов от полученных ранее зависимостей. Это стало особенно явно, когда на данном материале были получены новые дозовые кривые нейтрофилов. Не ясно, связаны ли эти различия с простым увеличением числа пациен-тов, или с особенностями радиацион-ного воздействия при аварии на Чернобыльской АЭС (фракциониро-вание и пролонгирование).
Слайд 7
Неравномерное облучение: метод Dolphin
Y / (1 – e−Y)
= X / (N – n0)
(1)Y×f = X / N, (2)
где
f – доля облучённых клеток,
Y – частота дицентриков на 1 клетку,
N – число сосчитанных клеток,
X – число наблюдаемых дицентриков,
n0 – число клеток без дицентриков.
Слайд 8
Неравномерное облучение: Qdr-метод
Qdr = X / NU =
YDR / [1 − exp(−YDR−YAc)], (3)
где
X – наблюдаемое число дицентриков + центрических колец,
NU – число клеток с нестабильными аберрациями хромосомного типа,
YDR и YAc – функции дозовой (D) зависимости частот дицентриков + центрических колец и ацентриков соответственно.
Qdr = (сDR+aDR×D +bDR×D2) / [1 – exp (-сDR -aDR×D -bDR×D2 -сAc -aAc×D -bAc×D2)]
(D)
Слайд 9
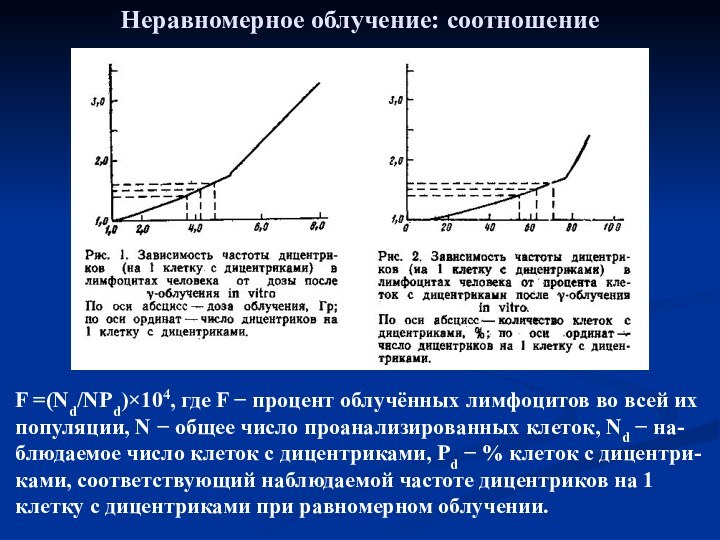
Неравномерное облучение: соотношение
F =(Nd/NPd)×104, где F − процент
облучённых лимфоцитов во всей их популяции, N − общее
число проанализированных клеток, Nd − на-блюдаемое число клеток с дицентриками, Pd − % клеток с дицентри-ками, соответствующий наблюдаемой частоте дицентриков на 1 клетку с дицентриками при равномерном облучении.
Слайд 10
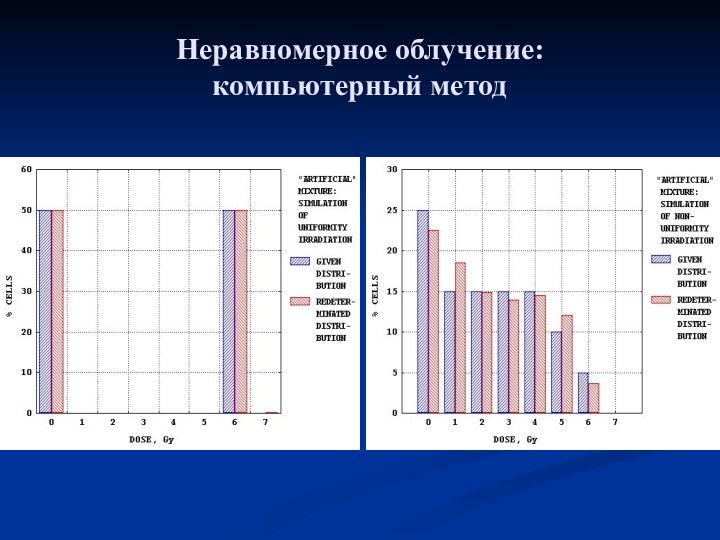
Неравномерное облучение: компьютерный метод
F(n) = ∫ f(D)F[n, Y(D)]dD,
(4)
где f(D) – искомое распределение лимфоцитов по полученной дозе, F(n) – эмпирическое распределение лимфоцитов по числу содержащихся в них дицентриков, n – частота дицентриков на 1 клетку, F[n, Y(D)] – аналитически заданное распределение Пуассона со средней величиной Y,
Y(D) – аналитически заданная калибровочная зависимость от дозы среднего числа дицентриков на 1 клетку, D – доза, Гр.
∫ f(D)dD = Σ F[n, Y(D)] = Σ F(n) = 1 (5)