- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Решение задач на законы электролиза
Содержание
- 3. I.Этап актуализации знаний Модель электролиза раствора СuCL2
- 4. Выводы по актуализации знаний к теме «Электролиз»Совокупность
- 5. Задание: ЕГЭ В-4 -2006г.1.Составить уравнения ОВР данных
- 6. Фронтальный опрос.В каких состояниях может находится вещество?
- 7. II. Этап изучение нового материалаПример решения задач
- 8. Пример решения задач по физикеИтак, при электролизе
- 9. Майкл Фарадей (1711 – 1867) – английский
- 10. Решение задач по физике.Задача: При никелировании детали
- 11. Применение электролиза. «Любое научное открытие интересно
- 12. III этап. Операционно- исполнительский .Индивидуальная работа с
- 13. IV этап. Закрепление знаний Тест: 1.
- 14. Скачать презентацию
- 15. Похожие презентации
I.Этап актуализации знаний Модель электролиза раствора СuCL2 Катод

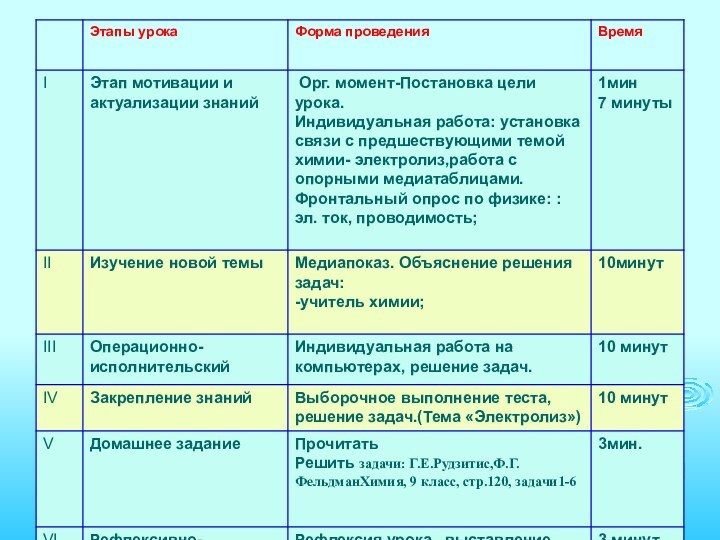
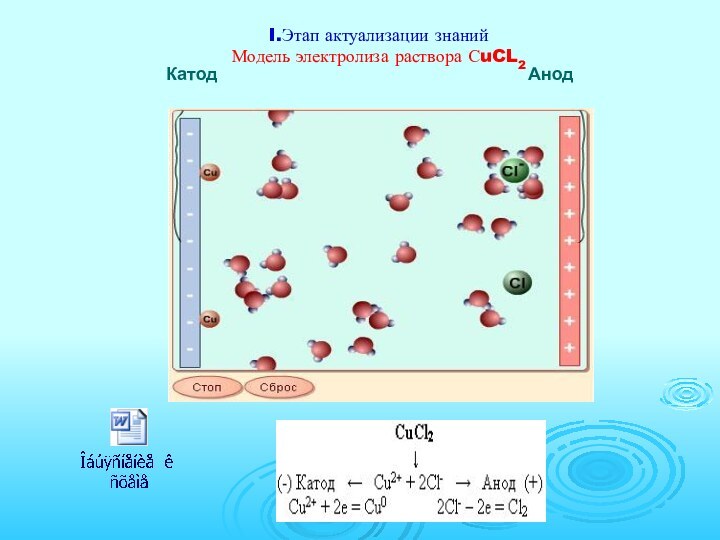










Слайд 4
Выводы по актуализации знаний к теме «Электролиз»
Совокупность окислительно-восстановительных
реакций, которые протекают на электродах в растворах или расплавах
электролитов при пропускании через них электрического тока, называют электролизом.На катоде(-) источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является “восстановителем”.
На аноде(+) происходит отдача электронов анионами, поэтому анод является “окислителем”.
При электролизе, как на аноде, так и на катоде могут происходить конкурирующие процессы.
Правила при составлении электролиза:
1. Процессы на аноде- могут образовываться следующие продукты: а) при электролизе растворов, содержащих в своем составе анионы F+, SO42-, NO3-, PO43-, а также растворов щелочей выделяется кислород; б) при окислении анионов бескислородных кислот Cl -, Br -, I -, выделяются соответственно хлор, бром, йод; 2. Процессы на катоде- могут образовываться следующие продукты:
а) если ионы металлов, расположены в ряду напряжений левее Al3+, выделяется водород;
б)если ион расположен в ряду напряжений правее водорода, то на катоде выделяется металл.
в)При электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений между Al3+ и H+ , на катоде могут протекать конкурирующие процессы как восстановления катионов, так и выделения водорода.
К+ , Са 2+, Na+, Mg2+, AL3+, Zn2+, Fe2+, Ni2+, Sn2+,Pb2+,H+,Cu2+,Hg2+,Ag+,Pt4+,Au3+,
Слайд 5
Задание: ЕГЭ В-4 -2006г.
1.Составить уравнения ОВР данных веществ
на электродах.
2.Установите соответствие между формулой вещества и продуктами электролиза
его водного раствора на инертных электродах.
Слайд 6
Фронтальный опрос.
В каких состояниях может находится вещество?
На
какие группы делятся вещества по проводимости электрического тока?
Какая
проводимость в металлах? Чем обусловлена собственная проводимость полупроводников?
Какая проводимость в газах?
Проводимости каких веществ мы еще не рассматривали?
Слайд 7
II. Этап изучение нового материала
Пример решения задач по
химии.
Условие задачи: При электролизе водного раствора бромида металла, образующего
однозарядный катион, содержащий 41,5г. этой соли выделилось 4,48л.Н2 при н.у. Определите бромид какого металла взяли?Решение.
1.Логическое рассуждение. Вопрос: у кого какие предложения, предположения по условию задачи? Подсказки (Если катион однозарядный, то…….Если одним из продуктов реакции является водород……) Вспомним правила электролиза, см. слайд.
2.Составление уравнения реакции: 2МеBr+2Н2О= Н2+ Br2 +2МеОН
41,5г. 4,48л.
3.Поставляем данные на уравнение реакции^ 2МеBr+2Н2О= Н2+ Br2 +2МеОН
х 22,4л/m
4. Находим по формуле количество вещества водорода:
n= V/Vm,n=4,48л./ 22,4л/m=0,2моль
5. Составляем соотношение молей по уравнению реакции: если на образование 1моля Н2 нужно 2 моли соли МеBr, то на 0,2моли газа нужно соответственно 0,4моли соли. Пропорция: 2-----1
0,4-----0,2
6.Находим молярную массу соли по формуле: М=m/n,значит М= 41,5г/ 0,4моль=103г/м.
7. Находим атомную массу металла: 103- 80=23, это металл-Na
Ответ: NaBr
Слайд 8
Пример решения задач по физике
Итак, при электролизе на
катодах происходит выделение вещества. От чего зависит масса вещества,
выделяющегося за определенный промежуток времени? Масса вещества, выделившегося на электроде равна:m = moi • Ni ,
где moi – масса одного иона, Ni – число ионов, достигших электродов.
Из курса физики и химии мы уже энаем:
moi = M/NА,
где М – молярная масса, NА – число Авогадро.
Ni = q/qoi, но qoi = n · e , q = I • t,
где n – валентность, е – заряд электрона, I – сила тока, t – время
Получаем m = M/NA · I t / n · e , или m = M/NA· n • e • I t
Если введем постоянную k = M/NA· n • e , то получаем m = k• I t ,
где k – электрохимический эквивалент вещества, коэффициент пропорциональности, зависящий от природы вещества.
Вывод: масса вещества, выделившегося на электроде за время t при прохождении электрического тока, пропорциональна силе тока и времени. Это утверждение, полученное нами теоретически, впервые было установлено экспериментально Фарадеем, носит название закона электролиза Фарадея.
Слайд 9 Майкл Фарадей (1711 – 1867) – английский физик,
основоположник учения об электрических и магнитных полях. М.Фарадей родился
в предместье Лондона в семье кузнеца. Свое образование он получил в начальной школе. В возрасте 13 лет ему пришлось поступить учеником в переплетную мастерскую. Увлекшись чтением книг, особенно по электричеству и химии, Фарадей начинает сам проделывать описанные в них опыты. И в 1813 году (22 года) он был принят на работу в лабораторию известного английского химика Г.Дэви. Так сказал о нем Столетов: “Никогда со времени Галилея свет не видел стольких поразительных и разнообразных открытий, вышедших из одной головы, и едва мы скоро увидим другого Фарадея…
Слайд 10
Решение задач по физике.
Задача: При никелировании детали в
течении 50 минут сила тока, проходящего через ванну, была
равна 2 А. Какова масса, выделившегося вещества на детали, если электрохимический эквивалент никеля k = 3 · 10 в степени – 7 кг/Кл?Слайд 11 Применение электролиза. «Любое научное открытие интересно только тогда, когда
находит практическое применение»
1.Электролиз растворов электролитов проводить энергетически
выгоднее, чем расплавов, так как электролиты – соли и щелочи – плавятся при очень высоких температурах.Электролиз широко используется для получения наиболее активных металлов (щелочных, щелочно-земельных, алюминия, магния), некоторых активных неметаллов (фтор, хлор) и сложных веществ (гидроксида натрия и калия).
2.Для очистки металлов от примесей (рафинирование). Так полученную из руды неочищенную медь отливают в форме толстых листов, которые помещают в ванну в качестве анодов. При электролизе медь анода будет растворяться, примеси выпадают на дно, на катоде, сделанном из особо чистой меди будет оседать чистая медь.Дорого обходится такая рафинированная медь с примесью всего 0,1% и менее, но все затраты покрываются стоимостью извлеченных из нее серебра, золота, селена, теллура.
3.Электролитическим путем покрывают поверхность одного металла тонким слоем другого ( никелем, хромом, оловом, золотом и т.д) для защиты поверхности от коррозии.
4.Если на поверхность металла нанести слой графита, то электролизом можно получить точную копию с рельефной поверхности. Это гальфанопластика, открыт русским ученым Б.Якоби, который в 1836 г применил этот способ для изготовления полых фигур в Исааковском соборе в Санк-Петербурге.
Слайд 12 III этап. Операционно- исполнительский .Индивидуальная работа с компьютерной
программой по решению задач.
Инструктивная карта по работе с обучающей
программой 1С Образовательная коллекция. Самоучитель. Химия для всех. Решение задач
Открываем раздел «Теоретическая химия»
Находим тему «Окислительно- восстановительные реакции»
По теме «Электролиз» решаем задачи:10060112,10060128, 10061401, В 09062252
Слайд 13
IV этап. Закрепление знаний
Тест:
1. При электролитической диссоциации в
растворе электролита присутствуют:
А) молекулы,
Б) ионы,
В) гидратированные ионы.
2. Какая проводимость
наблюдается в жидкостях?А) электронная, Б) ионная, В) электронно-ионная
4. Чем отличается проводимость электролитов от проводимости в металлах?
А) ни чем, Б) в электролитах ионы, в металлах ионы и электроны, В) в электролитах – ионы, в металлах – электроны.
5. Каким ученым связано развитие гальванотехники:
А) М.Фарадей, Б) Б.Якоби, В) С.Аррениус
6. Задача. При силе тока 1,6 А на катоде выделилась медь массой 0,316 г за 10 минут. Найдите значение k меди.





























