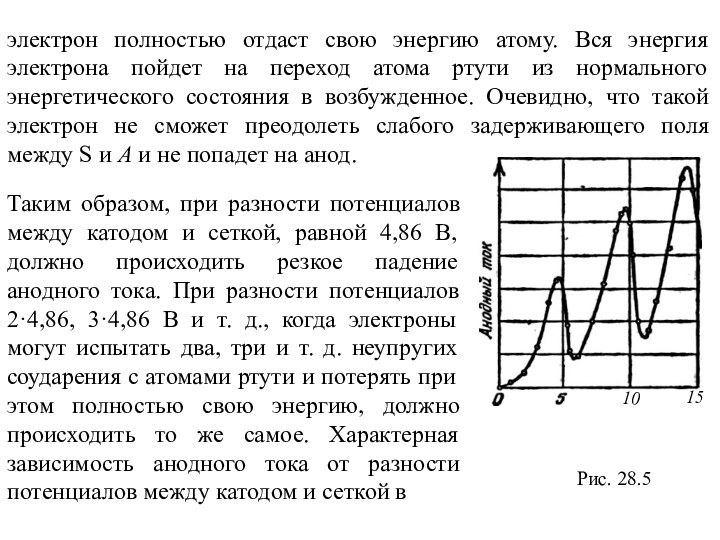
к описанию поведения электрона в атоме, выдвинул три постулата,
которые называются постулатами Бора. Сразу же заметим, что физический смысл этих постулатов не только не мог быть объяснен в классической физике, но, более того, находился в глубоком противоречии с классическим описанием движения электрона в атоме. Подлинный смысл и значение постулатов Бора вскрылись позднее, после создания квантовой механики.Теория Бора развивалась им для атома водорода и так называемых водородоподобных систем, состоящих из ядра с зарядом Ze и одного электрона, движущегося вокруг ядра. Примерами подобных систем являются однократно ионизованный гелий (Не+), двукратно ионизованный литий (Li++) и другие ионы. Такие системы называются также изоэлектронными водороду. Для водородоподобных систем все сериальные формулы, в частности формулы (28.5), вместо R содержат произведение RZ2.