Слайд 2
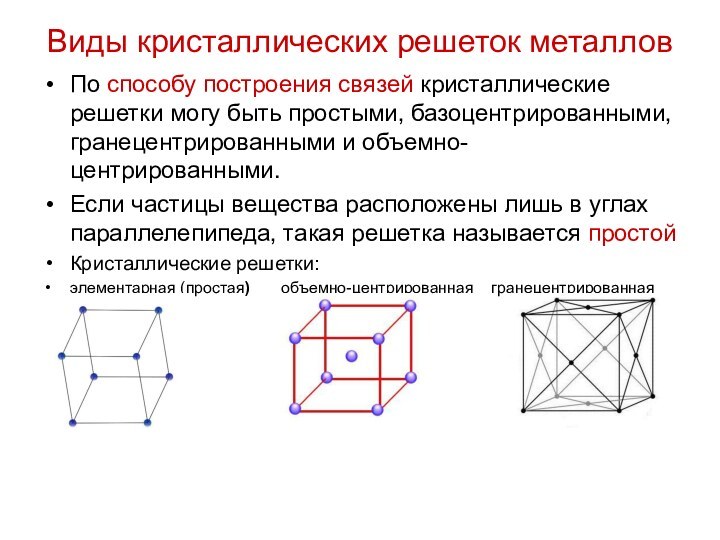
Виды кристаллических решеток металлов
По способу построения связей кристаллические
решетки могу быть простыми, базоцентрированными, гранецентрированными и объемно-центрированными.
Если
частицы вещества расположены лишь в углах параллелепипеда, такая решетка называется простой
Кристаллические решетки:
элементарная (простая) объемно-центрированная гранецентрированная
Слайд 3
Объемно-центрированный тип решетки в определенных диапазонах температур имеют
железо, хром, ванадий, вольфрам, молибден и др. металлы.
Гранецентрированный
тип решетки имеют железо, алюминий, медь, никель, свинец и др. металлы.
Третьей распространенной разновидностью плотноупакованных решеток является гексагональная плотноупакованная. Такую решетку имеют магний, цинк, кадмий, бериллий, титан и др.
Слайд 4
Дефекты кристаллической решетки металлов
В реальности кристаллическое строение металлов
отличается от идеального тем, что содержит множество дефектов или
структурных несовершенств, обусловленных отсутствием атомов (ионов) в узлах или нарушением правильного расположения их в кристаллической решетке.
По геометрическим признакам дефекты кристаллического строения подразделяются на точечные, линейные, поверхностные и объемные.
К точечным дефектам структуры относятся вакансии, т. е. отсутствие атомов (ионов) в узлах решетки (дефект Шоттки ), и междузельные атомы, расположенные внутри элементарной ячейки (дефект Френкеля).
Образованию вакансий способствует, например, процесс легирования, когда «примесный» атом располагается либо в узле решетки, либо в междоузлии.
Слайд 5
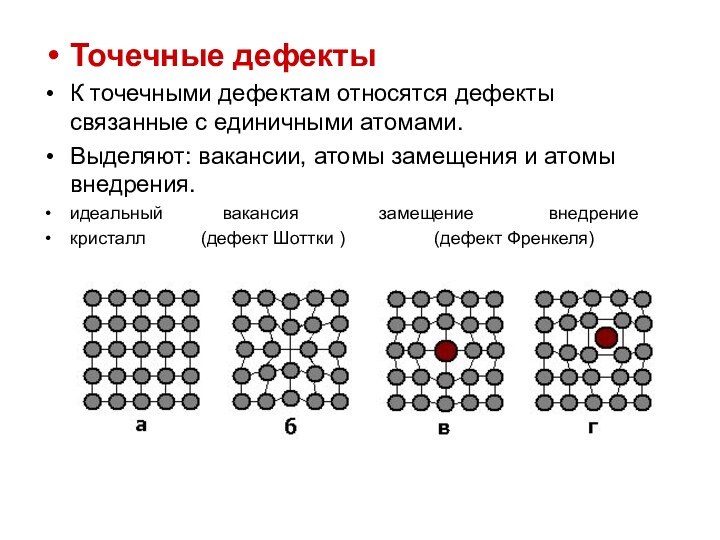
Точечные дефекты
К точечными дефектам относятся дефекты связанные с
единичными атомами.
Выделяют: вакансии, атомы замещения и атомы внедрения.
идеальный
вакансия замещение внедрение
кристалл (дефект Шоттки ) (дефект Френкеля)
Слайд 6
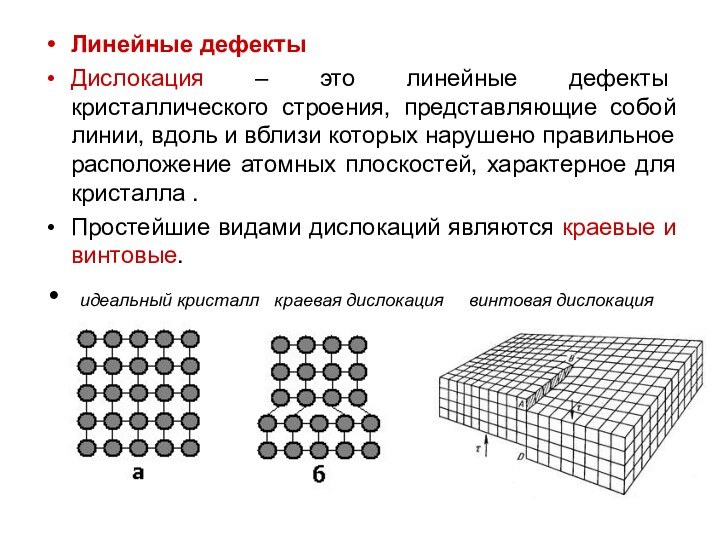
Линейные дефекты
Дислокация – это линейные дефекты кристаллического строения,
представляющие собой линии, вдоль и вблизи которых нарушено правильное
расположение атомных плоскостей, характерное для кристалла .
Простейшие видами дислокаций являются краевые и винтовые.
идеальный кристалл краевая дислокация винтовая дислокация
Слайд 7
Двухмерные дефекты
К дефектам этого типа можно отнести зоны
двойникования, границы зерен и другие.
Металлы, используемые в технике, состоят
из большого числа кристаллов неправильной формы, называемых зернами или кристаллитами.
По границам между зернами металла нарушается правильность строения кристаллической решетки. Обычно зерна повернуты произвольно.
Разориентация между соседними зернами составляет от нескольких градусов до десятков градусов (обычно более 50 ).
Граница между зернами называется – большеугловой.
Слайд 8
Каждое зерно металла состоит из отдельных блоков, субзерен.
Разориентировка между соседними субзернами составляет от нескольких секунд до
нескольких минут (малоугловые границы).
В пределах каждого субзерна (блока) решетка почти идеальна.
Дефект «границы зерен» дефект «границы субзерен»
Слайд 9
Границы между отдельными кристаллитами (зернами) представляют собой переходную
область шириной в 5 – 10 атомных размеров, в
которой решетка одного кристалла, имеющего определенную кристаллографическую ориентацию, переходит в решетку другого кристалла, имеющего иное кристаллографическое направление.
Поэтому на границе зерна атомы имеют менее правильное расположение, чем в объеме зерна.
К объемным (трехмерным) дефектам относят такие, которые имеют размеры в трех измерениях: неметаллические включения, царапины, макроскопические трещины, поры и т. д
Слайд 10
Сущность полиморфизма
Многие металлы в зависимости от температуры
могут существовать в разных кристаллических формах или, как их
называют, в разных полиморфных модификациях.
В результате полиморфного превращения атомы кристаллического тела, имеющие решетку одного типа, перестраиваются таким образом, что образуется кристаллическая решетка другого типа.
Полиморфную модификацию, устойчивую при более низкой температуре, для большинства металлов принято обозначать α, при более высокой – β, затем γ и т.д.
Слайд 11
При полиморфном превращении кристаллы (зерна) новой полиморфной формы
растут в результате неупорядоченных, взаимно связанных переходов атомов через
границу фаз.
Отрываясь от решетки исходной фазы (например, β), атомы по одиночке или группами присоединяются к решетке новой фазы (α), и в результате этого граница зерна α-модификации передвигается в сторону зерна β-модификации, «поедая» исходную фазу.
Зародыши новой модификации наиболее часто возникают на границах зерен исходных кристаллитов.
Вновь образующиеся кристаллы закономерно ориентированы по отношению к кристаллам исходной модификации.
Слайд 12
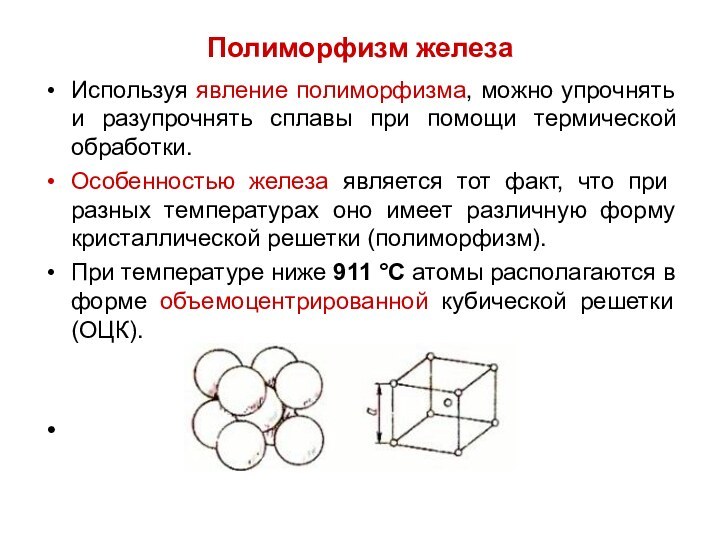
Полиморфизм железа
Используя явление полиморфизма, можно упрочнять и разупрочнять
сплавы при помощи термической обработки.
Особенностью железа является тот факт,
что при разных температурах оно имеет различную форму кристаллической решетки (полиморфизм).
При температуре ниже 911 °С атомы располагаются в форме объемоцентрированной кубической решетки (ОЦК).
Слайд 13
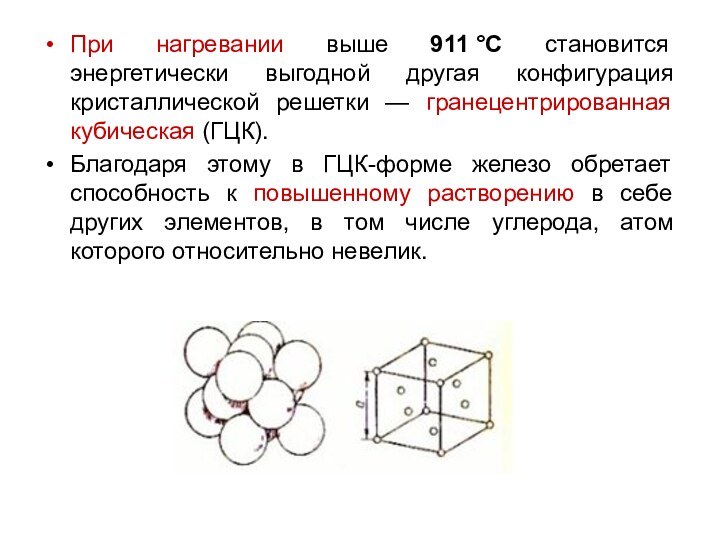
При нагревании выше 911 °С становится энергетически выгодной другая
конфигурация кристаллической решетки — гранецентрированная кубическая (ГЦК).
Благодаря этому
в ГЦК-форме железо обретает способность к повышенному растворению в себе других элементов, в том числе углерода, атом которого относительно невелик.
Слайд 14
При дальнейшем увеличении температуры порядок атомов вновь изменяется.
Выше 1 392 °С и до точки плавления (1539 0С) железо
опять представлено в качестве последовательности ОЦК - элементов.
Практическое применение:
- сталь при получении, охлаждаясь, проходит все эти полиморфические превращения, которые накладывают на ее конечные свойства отпечаток в зависимости от состава исходного расплава и от режима его затвердевания.
Слайд 15
Виды сплавов
Общие физические свойства
По способу изготовления сплавов
различают литые и порошковые сплавы.
Литые сплавы получают кристаллизацией
расплава смешанных компонентов.
Порошковые — прессованием смеси порошков с последующим спеканием при высокой температуре.
Компонентами порошкового сплава могут быть не только порошки простых веществ, но и порошки химических соединений. Например, основными компонентами твёрдых сплавов являются карбиды вольфрама или титана.
По способу получения заготовки (изделия) различают литейные (например, чугуны, силумины), деформируемые (например, стали) и порошковые сплавы.
Слайд 16
- В твердом агрегатном состоянии сплав может быть
гомогенным (однородным, однофазным — состоит из кристаллитов одного типа) и
гетерогенным (неоднородным, многофазным).
Твёрдый раствор является основой сплава.
Фазовый состав гетерогенного сплава зависит от его химического состава. В сплаве могут присутствовать: твердые растворы внедрения, твердые растворы замещения, химических соединений и кристаллиты простых веществ.
Основные классификационные сведения.
Стали. Все соединения железа, содержащие до 2% углерода, называются сталями. Если в составе имеется хром, ванадий или молибден, то их называют легированными.
Чугун. Если в сплаве железа содержится более 3-4% углерода, то он называется чугуном. Кроме того, его важным элементом является кремний.
Слайд 17
Медные сплавы. Чаще всего под этим термином понимаются
разные сорта латуни. Это такие сплавы меди, в которых
содержится от 5 до 45% цинка. Если его содержание колеблется в пределах 5 - 20%, то это красная латунь (томпак). Если же в материале содержится уже 20 – 36% Zn, то это – желтая латунь.
Сплавы свинца. Наиболее известен в настоящее время обычный припой, который изготавливается из одной части свинца и двух частей олова.
Сплавы на основе алюминия. Сплавы алюминия делятся сразу на три большие группы:
- литейные (Al – Si);
- сплавы, предназначенные для литья под давлением (Al – Mg);
- соединения повышенной прочности, самозакаливающиеся (Al – Cu).
Сплавы магния.
Слайд 18
Правило фаз Гиббса
Фаза — это однородная часть системы
или совокупность частей, имеющих одинаковый состав, строение и физико-химические
свойства.
Разные фазы всегда отделены друг от друга поверхностями раздела (межфазными поверхностями). Химический состав каждой фазы в сплаве можно выразить через концентрации компонентов.
Состояние системы определяется температурой, давлением, концентрацией компонентов в разных фазах.
При изменении этих факторов система переходит из одного состояния в другое, при этом совершаются фазовые превращения, при которых появляются новые фазы или исчезают старые.
Возможность изменения равновесного состояния системы определяется вариантностью.
Слайд 19
Число факторов, которые могут изменяться независимо друг от
друга без нарушения равновесия системы, называется числом степеней свободы
f.
Правило Гиббса - вариантность системы зависит от числа компонентов, числа равновесных фаз и количества внешних переменных.
f = К – Ф + 2 ,
где К - число компонентов в системе; Ф – число фаз в системе; 2 - число переменных, воздействующих на систему.
Если f = 0 (система называется нонвариантной), то все независимые переменные, определяющие состояние системы, имеют строго фиксированные (единственные) значения, которые нельзя изменить, не нарушив фазового равновесия системы.
Наличие одной, двух или большего числа степеней свободы позволяет независимо изменять одну, две или большее число переменных без изменения числа фаз, находящихся в равновесии.
Слайд 20
Фазовые равновесия в двухкомпонентных системах
Диаграмму состояния можно
изобразить на плоскости: на вертикальной оси откладывается температура, на
горизонтальной – масс. доля, % .
Один конец горизонтальной оси соответствует 100 % одного компонента, другой – 100 % второго компонента. Промежуточные точки на горизонтальной оси выражают любые соотношения двух компонентов.
На вертикальные оси, соответствующие содержанию 100 % компонентов, наносят их температуры плавления ТA и ТB.
Слайд 21
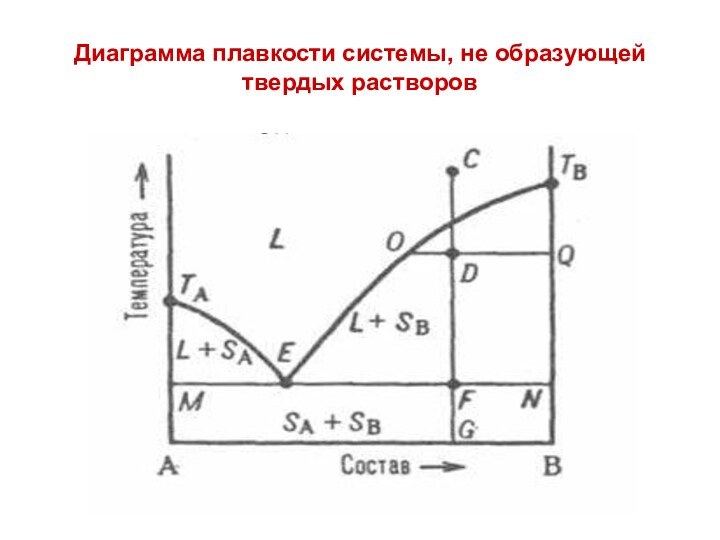
Диаграмма плавкости системы, не образующей твердых растворов
Слайд 22
Если к чистому веществу А добавлять возрастающие количества
вещества В, то в соответствии с законом Рауля будет
наблюдаться прогрессирующее понижение плавления смесей. Это же будет происходить и при добавлении вещества А к веществу В.
На диаграмме L - область существования системы в виде жидкости (расплава). Линия ТА-Е-ТВ называется «ликвидус», ниже ликвидуса вещество находится в состоянии (L+SA) и (L+SB) соответственно, т.е. область существования жидкой и твердой фаз одновременно.
Кривые л и к в и д у с а, показывают, при какой температуре и при каком составе расплава начинается кристаллизация компонентов А и В в зависимости от состава исходного расплава.
Линия МЕFN называется линией «солидус», ниже которой система находится в твердом состоянии, т.е в виде механической смеси кристаллов вещества А и В (SA+SB). Точка Е на диаграмме называется точкой эвтектики.
Эвтектикой называется механическая смесь двух и более видов кристаллов, кристаллизующихся одновременно.
Слайд 23
Реакция, когда жидкость реагирует с ранее выпавшими кристаллами
и образует новый вид кристаллов называется перитектической.
Любая точка на
линии ликвидуса называется фигуративной точкой и отражает состояние системы при изменении концентрации.
Если фигуративная точка исходной смеси располагается выше линии ликвидуса, система представляет собой одну фазу – расплав, если фигуративная точка располагается в полях ТА- Е- М и ТВ –Е- N, то система состоит из одной твердой (А или В соответственно) и жидкой фаз; ниже линии солидуса система состоит из двух твердых фаз – кристаллов А и кристаллов В. Кристаллы компонентов А и В, выпавшие первоначально в полях ТА- Е- М и ТВ –Е- N, имеют более крупные размеры, чем кристаллы А и В, выпавшие в эвтектике.
Диаграмма состояния двухкомпонентных систем позволяет определить не только температуры фазовых превращений и составы соответствующих фаз, но и их относительный состав при любой температуре.
Слайд 24
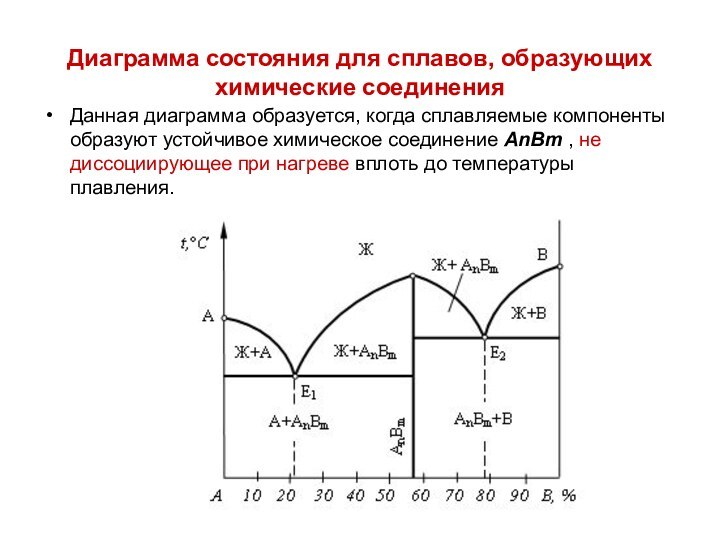
Диаграмма состояния для сплавов, образующих химические соединения
Данная диаграмма
образуется, когда сплавляемые компоненты образуют устойчивое химическое соединение АnВm
, не диссоциирующее при нагреве вплоть до температуры плавления.
Слайд 25
Диаграмма состояния с устойчивым химическим соединением для сплавов,
образующих химическое соединение
При концентрации, соответствующей химическому соединению Аn Вm
, отмечается характерный перелом на кривой свойств.
Это объясняется тем, что некоторые свойства химических соединений обычно резко отличаются от свойств образующих их компонентов.
В данном случае химическое соединение Аn Вm образует с компонентами А и В сплавы, относящиеся к диаграмме состояний, представленной на рисунке.
Структурный состав любого сплава системы А-В в твердом состоянии будет представлять смесь химического соединения и одного из исходных компонентов.
Слайд 26
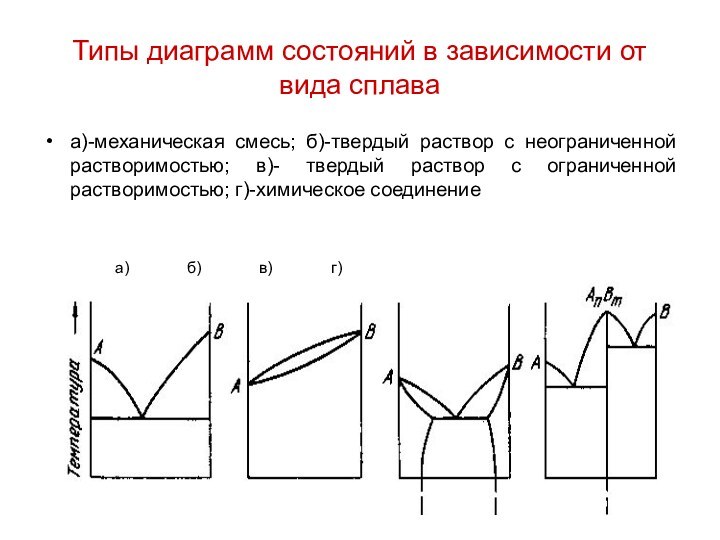
Типы диаграмм состояний в зависимости от вида сплава
а)-механическая
смесь; б)-твердый раствор с неограниченной растворимостью; в)- твердый раствор
с ограниченной растворимостью; г)-химическое соединение
а) б) в) г)
Слайд 27
Сталь
Сталь представляет собой сплав железа с углеродом, концентрация
которого не превышает 2,14%. В стали общего назначения его
содержание колеблется от 0,05 до 1%.
Легирование железа углеродом состоит из двух этапов. На первом к железу добавляют 6,67% углерода, в результате чего образуется карбид железа, или цементит.
При нормальных условиях обычная сталь состоит из двух гомогенных фаз – цементита и феррита. При нагревании цементит растворяется в железе с образованием аустенита.
Концентрация углерода влияет на основные механические свойства стали. Ее увеличение способствует снижению пластичности и вязкости, повышению твердости и прочности вещества.
Кроме того, углерод повышает литейные свойства, но ухудшает свариваемость и обрабатываемость стали.
Слайд 28
Марганец и кремний являются специальными добавками, вводимыми в
состав стали с целью удаления сернистых соединений железа и
двухвалентного оксида.
Концентрация кремния находится в пределах 0,4%, а марганца – 0,8%. Марганец и кремний также повышают предел прочности и упругость соответственно.
Фосфор повышает прочность вещества, уменьшая пластичность и вязкость. Отрицательное воздействие элемента заключается в придании стали хладноломкости, поэтому при производстве не допускается превышение его содержания в 0,045%.
Сера обуславливает красноломкость сплава, ее концентрация ограничена 0,05%.
Слайд 29
Классификации стали
Существует несколько классификаций стали:
1. В зависимости
от химического состава:
- углеродистые, в них присутствует железо, углерод
и примеси;
- легированные с различными специальными добавками.
2. В зависимости от концентрации углерода:
- высокоуглеродистые (свыше 0,7 %);
- среднеуглеродистые (0,25 – 0,7 %);
- низкоуглеродистые (до 0,25 %).
3. По назначению:
- конструкционные;
- инструментальные;
- специального назначения.
4. В зависимости от качества:
- обыкновенного качества,
- качественные,
- высококачественные;
- особо высококачественные
Слайд 31
Центры кристаллизации образуются в исходной фазе независимо друг
от друга в случайных местах.
Сначала кристаллы имеют правильную
форму, но по мере столкновения и срастания с другими кристаллами форма нарушается.
Рост продолжается в направлениях, где есть свободный доступ питающей среды.
После окончания кристаллизации имеем поликристаллическое тело.
Слайд 32
Термическая обработка стали
. Назначение термической обработки стали –
изменение структуры сплава, а следовательно, и его свойств, например,
придание изделию твердости и хрупкости или, наоборот, мягкости и пластичности.
Режимы термической обработки стали:
Суть процессов заключается в нагревании стальной заготовки, ее выдержке и охлаждении.
Все это происходит при строгом соблюдении определенных параметров, в частности, температуры и скорости.
На режимы влияет и классификация сталей. Термическая обработка сталей определенных видов требует разных условий для достижения одного и того же результата.
Слайд 33
Отжиг
Технология этого процесса состоит из нагревания стальных
заготовок, выдержки с последующим медленным охлаждением, после чего в
металле достигается равновесная структура.
Его задачей является уменьшение внутреннего напряжения в сплаве, а также увеличение пластичности.
Такая термическая обработка стали подразделяется на два рода. Они имеют существенные различия.
Отжиг I рода. Данный вид термообработки подразделяют на 4 группы:
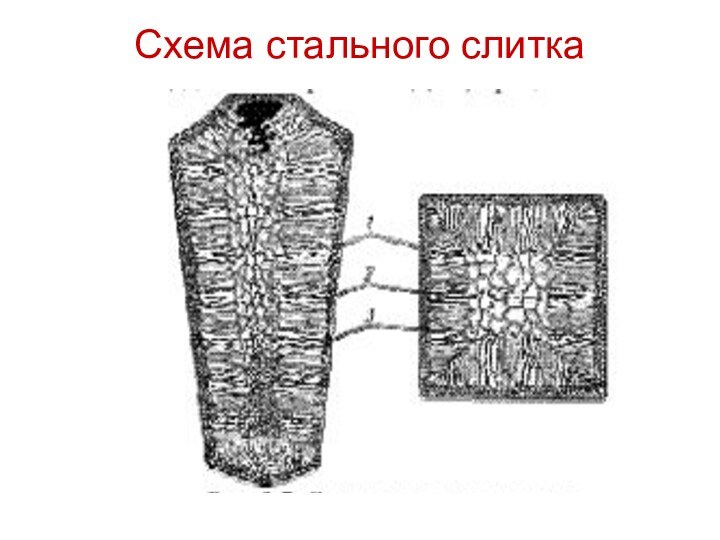
- гомогенизация. Сплавам после кристаллизации присущ неравномерный состав химических компонентов как для одного зерна, так и для всего объема слитка, что обуславливается разными температурами плавления элементов.
Такие неравновесные структуры в большей степени характерны для легированных сталей.
Слайд 34
Заготовки стали нагреваются в специальных печах, в которых
выдерживаются от 8 до 15 часов, после чего происходит
медленное охлаждение в печи.
Такая термическая обработка легированных сталей обеспечивает их пластичность, что значительно облегчает их обработку деформацией.
Рекристаллизационный отжиг.
Его применяют для снятия эффекта упрочнения стали, связанного с холодной пластической деформацией, в результате которой образуются дефекты кристаллической решетки, называемые дислокациями и вакансиями
Отжиг для снятия остаточных напряжений. Внутренние напряжения в стальных деталях возникают в результате таких процессов, как сварка, литье, резание, шлифовка, горячая деформация.
Слайд 35
Отжиг II рода С помощью этого процесса равновесная
структура материала достигается при фазовых превращениях.
Структура стали после
термической обработки частично или полностью изменяется.
Кардинальное изменение строения сплава происходит благодаря двойной перекристаллизации, в результате которой происходит уменьшение размеров зерен, устранение внутренних напряжений, снятие наклепа.
Виды термической обработки стали – полный (смягчающий) и неполный отжиг.
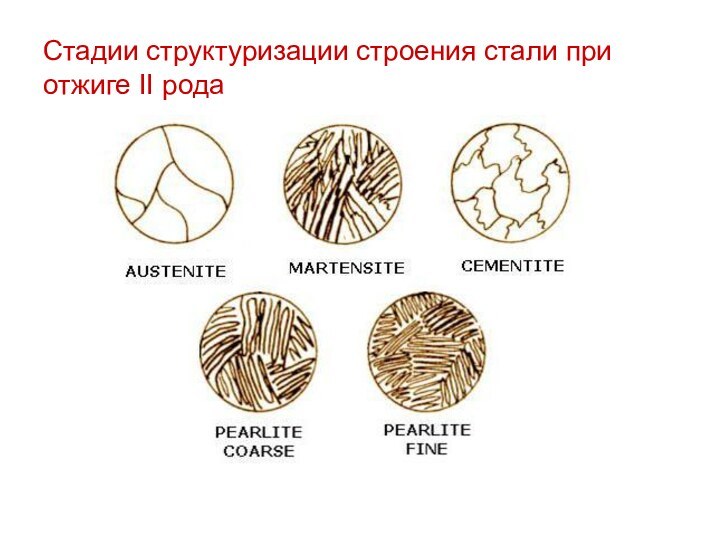
Полный отжиг. В результате данного процесса происходит превращение крупной ферритно-перлитной структуры в мелкую аустенитную, которая при медленном охлаждении (30-50 ºС) преобразуется в мелкую ферритно-перлитную.
Таким способом обрабатывается конструкционная сталь с целью повышения пластичности и снижения твердости
Неполный отжиг. В результате неполного отжига пластинчатый перлит превращается в зернистый ферритоцементит, проходя через стадию аустенита (около 780 ºС).
Такой процесс используется для инструментальных сталей
Слайд 36
Стадии структуризации строения стали при отжиге II рода
Слайд 37
Закалка
Это термическая обработка стали, благодаря которой происходит
повышение ее прочности, износостойкости, твердости, предела упругости, а также
снижение пластичных свойств.
Технология закалки состоит из нагрева до определенной температуры (примерно 850-900 ºС), выдержки и резкого охлаждения, благодаря которому эти свойства и достигаются. Закалка является самым распространенным способом улучшения физико-механических свойств сплава