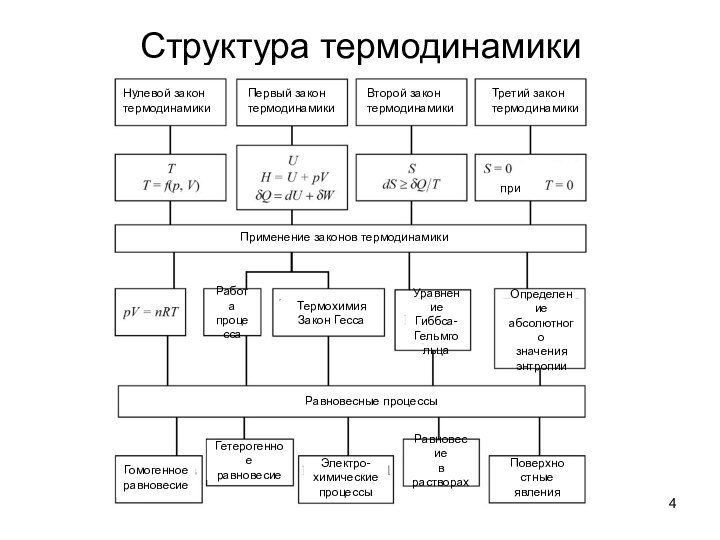
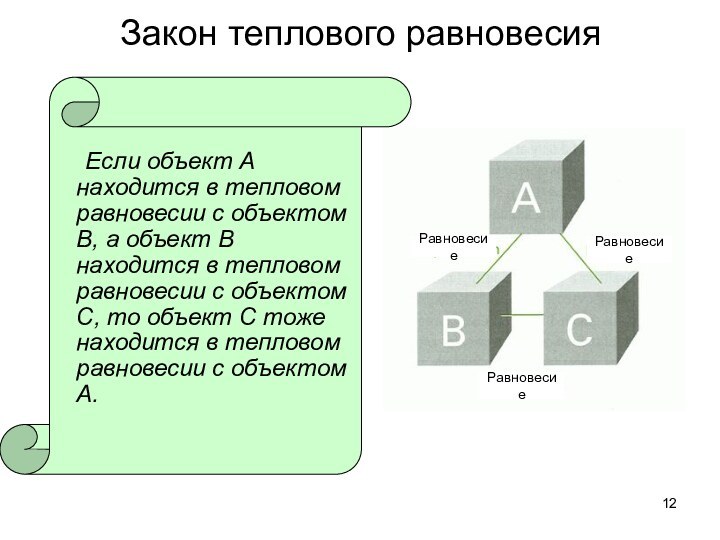
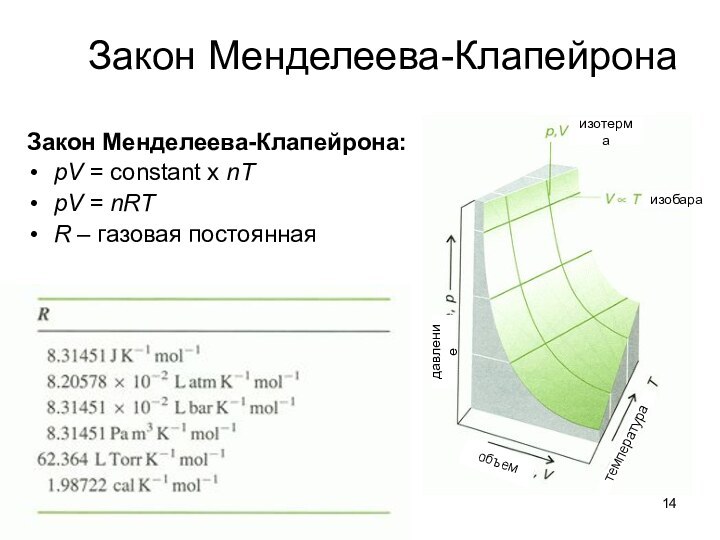
о законах химических процессов и химических явлениях.
Законы и
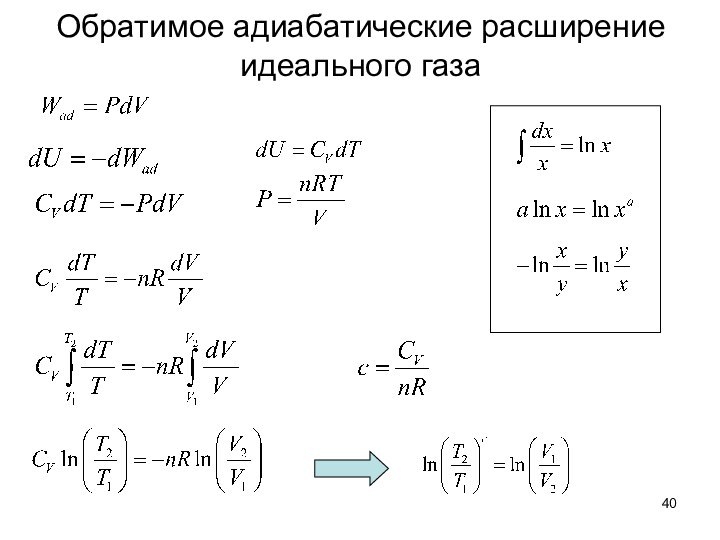
положения физической химии используются чтобы объяснить и понять физические и химические свойства материи. Физическая химия объясняет явления, которые основаны на физических законах и дает количественное описание химических процессов.
Внешняя среда
Система
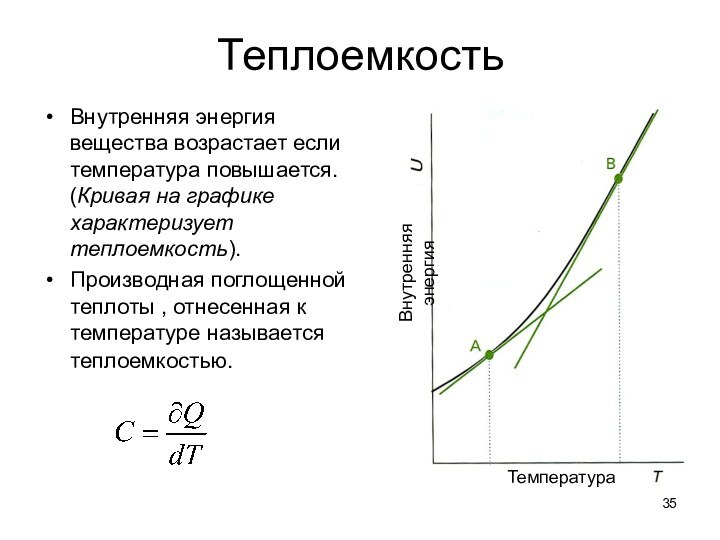
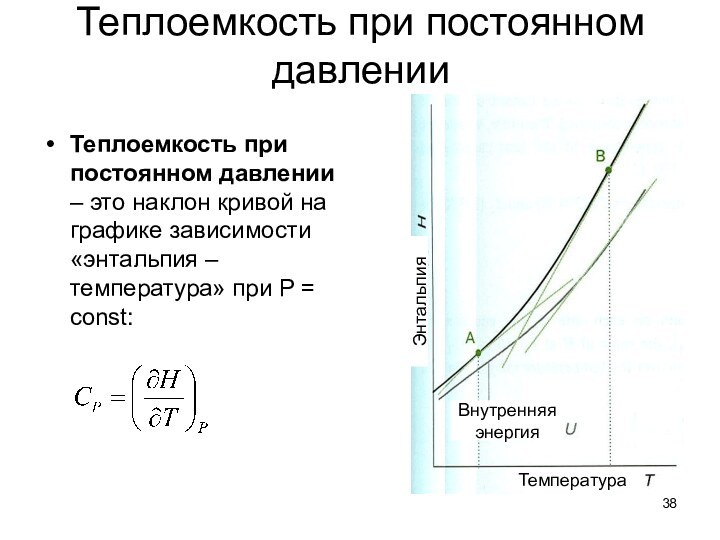
Энергия
Энергия