- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Конспект урока и презентация. Ионные уравнения.
Содержание
- 3. Пожар в центре Грабаря
- 4. Возвращенные шедевры
- 5. Леонардо да Винчи. Тайная вечеря.Картина неизвестного художника.Джорджоне.Юдифь. И.И. Левитан. У омута. И.К.Айвазовский.Радуга.
- 6. Ионные уравнения реакций.Цель: Познакомиться с понятием ионные
- 7. ВОПРОСЫКакие вещества называются электролитами?. Какие вещества называются
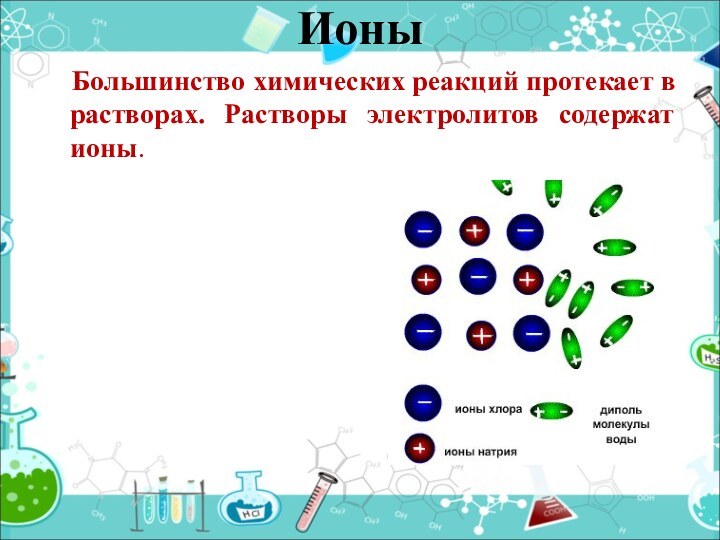
- 8. Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы. Ионы
- 9. НСl + AgNO3 → AgCl + НNO3
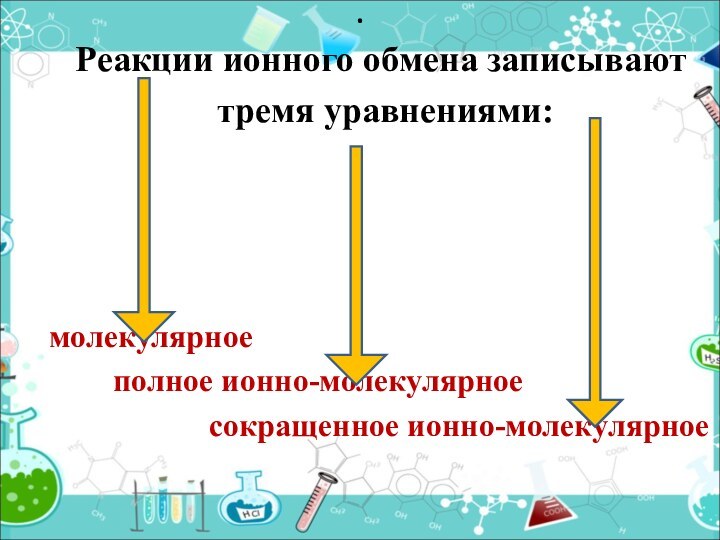
- 10. Реакции ионного обмена записывают тремя уравнениями:молекулярное
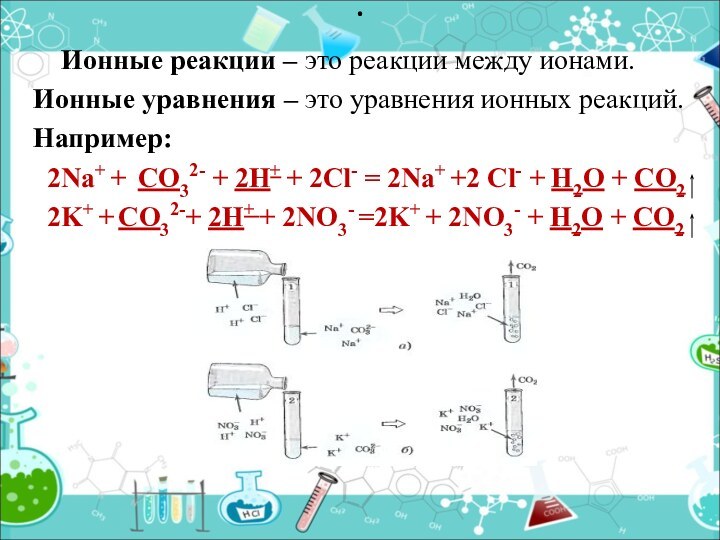
- 11. Ионные реакции – это
- 12. Практическое исследование
- 13. Помните, что любое вещество может быть опасным,
- 14. Никогда не пробуйте химические вещества на вкус!
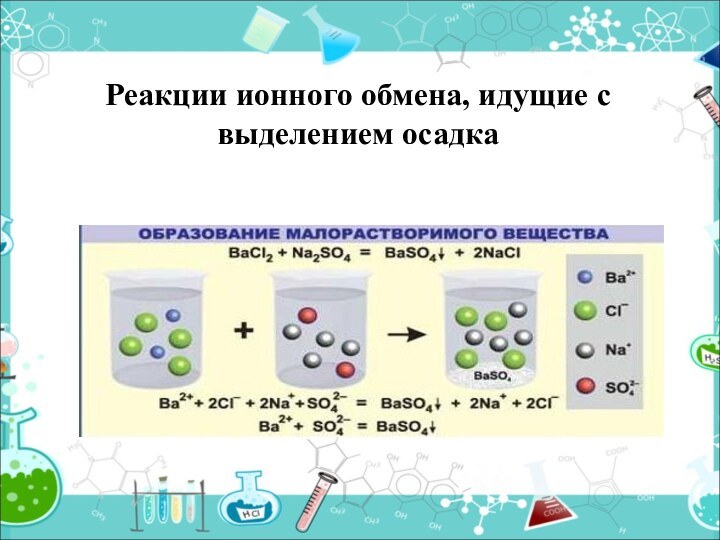
- 15. Реакции ионного обмена, идущие с выделением осадка
- 16. Выпадает осадок (↓)CuSO4 + 2NaOH= Cu(OH) 2
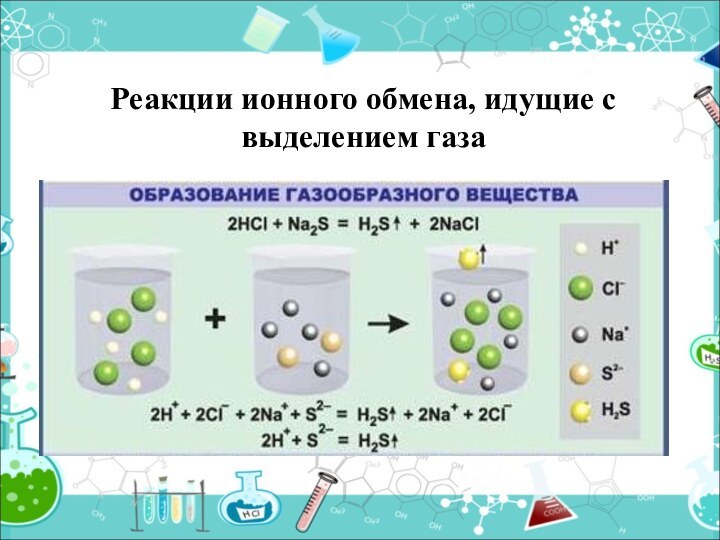
- 17. Реакции ионного обмена, идущие с выделением газа
- 18. Выделяется газ (↑) 2HCl + Na2CO3
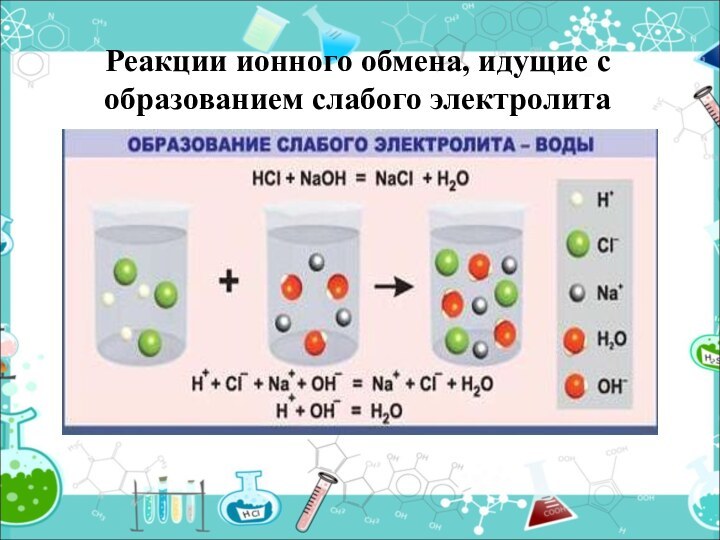
- 19. Реакции ионного обмена, идущие с образованием слабого электролита
- 20. Образуется водаHCl + NaOH = NaCl
- 21. Na2SO4 + KINa+SO42-K+I-1.Нет осадка2.Не выделяется газ3.Не образуется слабый электролитОбратимые реакции
- 22. В соответствии с правилом Бертолле ионные реакции
- 23. Идут до конца:Реакции ионного обменаCuSO4
- 24. Для уменьшения жёсткости воды путём замены обусловливающих
- 25. В пищевой промышленности:1.Очистка соков в производстве сахара.2.В
- 26. Применение ионитовВ медицине:1.Для увеличения сроков хранения крови.2.Для
- 27. Сокращенному ионному уравнению Bа2+ + SО42- BаSО4соответствуют схемы уравнений химических реакций
- 28. Сокращенному ионному уравнению Н+ + ОН- H2Oсоответствуют схемы уравнений химических реакций
- 29. Al2O3 + 6H+ = 2Al3+ + 6H2O
- 30. Установи соответствиемежду продуктами реакций ионного обмена
- 31. 1.SO42-и H+ ; Ag+ и Cl-2.Cl-
- 33. Домашнее задание§ 37, упр. 4, 5. В
- 34. Скачать презентацию
- 35. Похожие презентации






















Слайд 5
Леонардо да Винчи. Тайная вечеря.
Картина неизвестного художника.
Джорджоне.Юдифь.
И.И.
Левитан. У омута.
Слайд 6
Ионные уравнения реакций.
Цель: Познакомиться с понятием ионные уравнения
и рассмотреть случаи, при которых реакции ионного обмена протекают
до конца.
Слайд 7
ВОПРОСЫ
Какие вещества называются электролитами?
. Какие вещества называются неэлектролитами?
Что называется ионом?
Что называется электролитической
диссоциацией?
Что называется кислотой в
свете ТЭД?Что называется солью в свете ТЭД?
Что называется основанием в свете ТЭД?
Слайд 8 Большинство химических реакций протекает в растворах.
Растворы электролитов содержат ионы.
Ионы
Слайд 10
Реакции ионного обмена записывают
тремя уравнениями:
молекулярное
полное ионно-молекулярное
сокращенное ионно-молекулярное.
Слайд 11
Ионные реакции – это реакции
между ионами.
Ионные уравнения – это уравнения ионных реакций.
Например: 2Na+ + CO32- + 2H+ + 2Cl- = 2Na+ +2 Cl- + H2O + CO2
2K+ + CO32-+ 2H+ + 2NO3- =2K+ + 2NO3- + H2O + CO2
.
Слайд 13
Помните, что любое
вещество может быть
опасным, если
обращаться
с ним неправильно!
Без указания учителя не смешивайте неизвестные
вам вещества!
Слайд 16
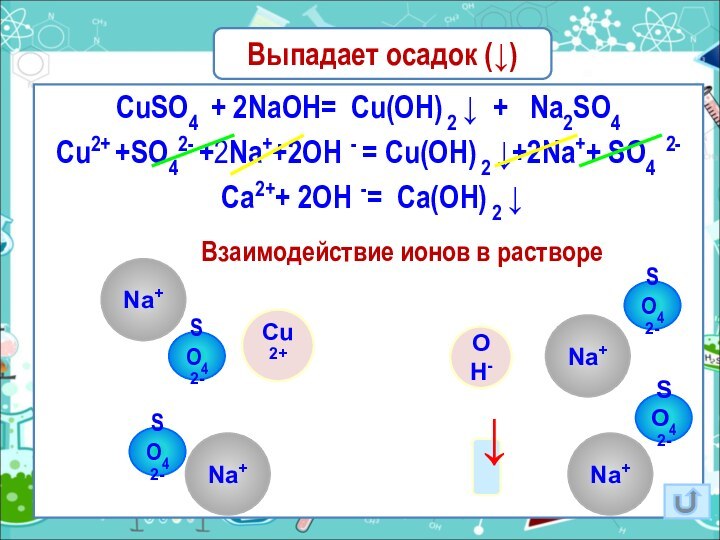
Выпадает осадок (↓)
CuSO4 + 2NaOH= Cu(OH) 2 ↓
+ Na2SO4
Cu2+ +SO42- +2Na++2OH - = Cu(OH) 2
↓+2Na++ SO4 2- Ca2++ 2OH -= Ca(OH) 2 ↓
SO42-
Na+
Cu2+
OH-
SO42-
Взаимодействие ионов в растворе
Na+
Na+
Na+
↓
SO42-
SO42-
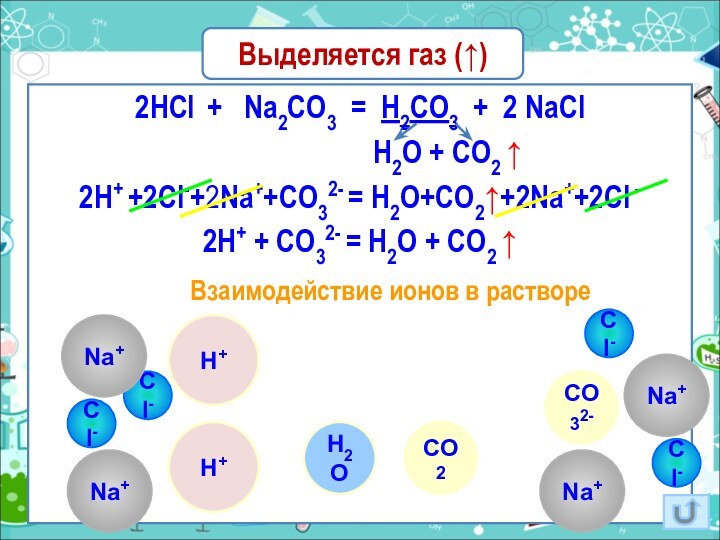
Слайд 18
Выделяется газ (↑)
2HCl + Na2CO3 =
H2CO3 + 2 NaCl
H2O + CO2 ↑2H+ +2Cl-+2Na++CO32- = H2O+CO2↑+2Na++2Cl -
2H+ + CO32- = H2O + CO2 ↑
Cl-
Cl-
H+
CO32-
Cl-
Cl-
Взаимодействие ионов в растворе
H+
CO2
H2O
Na+
Na+
Na+
Na+
Слайд 20
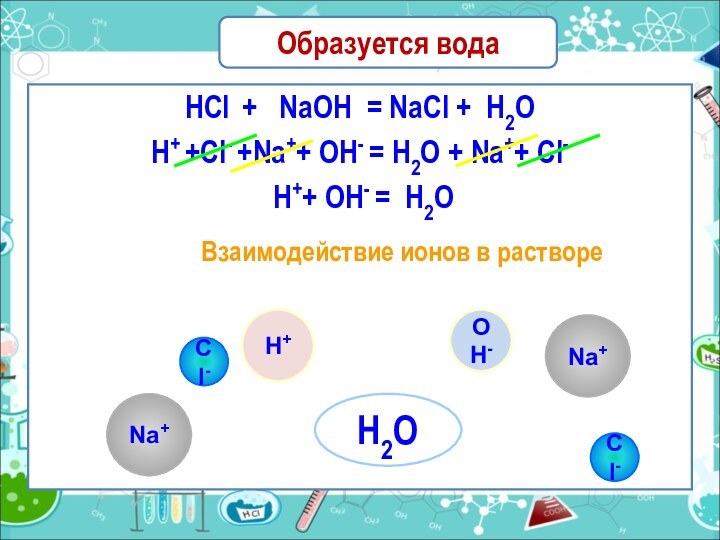
Образуется вода
HCl + NaOH = NaCl +
H2O
H+ +Cl- +Na++ OH- = H2O + Na++ Cl-
H++ OH- = H2O
Cl-
Na+
H+
OH-
Cl-
Взаимодействие ионов в растворе
Na+
H2O
Слайд 21
Na2SO4 + KI
Na+
SO42-
K+
I-
1.Нет осадка
2.Не выделяется газ
3.Не образуется
слабый электролит
Обратимые реакции
Слайд 22 В соответствии с правилом Бертолле ионные реакции протекают
практически необратимо:
I случай
II случай
III случай
В остальных случаях реакции обратимы!
Слайд 23
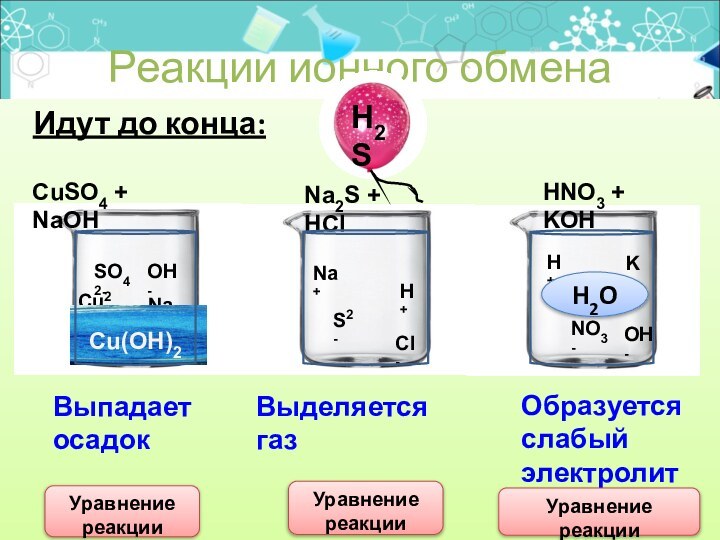
Идут до конца:
Реакции ионного обмена
CuSO4 +
NaOH
Na2S + HCl
HNO3 + KOH
Cu2+
SO42-
Na+
OH-
Na+
S2-
H+
Cl-
H+
NO3-
K+
OH-
Сu(OH)2
H2S
H2O
Выпадает
осадок
Выделяется газ
Образуется
слабый
электролит
Уравнение
реакции
Уравнение
реакции
Уравнение реакции
Слайд 24
Для уменьшения жёсткости воды путём замены обусловливающих её
ионов кальция и магния на другие, например, натрия.
Для
обессоливания воды, при этом удаляются и катионы, и анионы путём последовательного прохождения воды через катионит и анионит. Для обезжелезивания воды особую роль играет возможность катионов удалять двухвалентное железо.
Очистка сточных вод промышленных предприятий.
Очистка воды
Слайд 25
В пищевой промышленности:
1.Очистка соков в производстве сахара.
2.В производстве
дрожжей, фруктовых соков,
глицерина, глюкозы, сгущенного молока, какао,
кофе
со сгущенным молоком.
Слайд 26
Применение ионитов
В медицине:
1.Для увеличения сроков хранения крови.
2.Для производства,
выделения и очистки антибиотиков.
3.Использование ионитов, селективно извлекающих
токсические вещества
из крови человека.
Слайд 27
Сокращенному ионному уравнению
Bа2+ + SО42-
BаSО4
соответствуют схемы уравнений химических реакций
Слайд 28
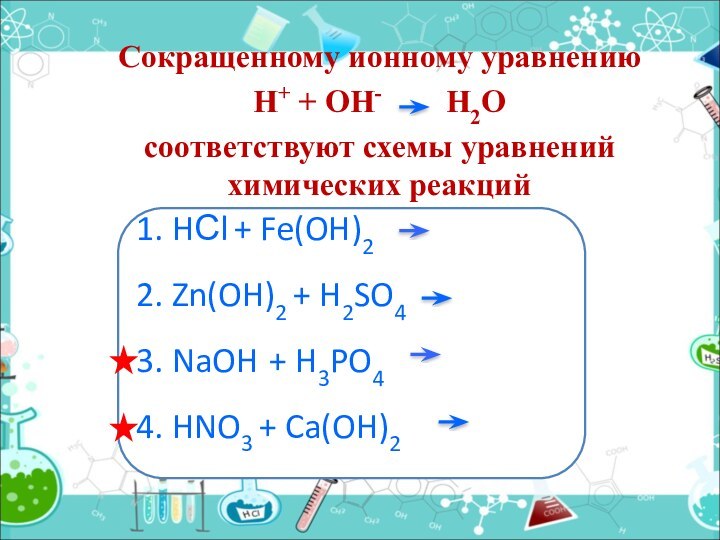
Сокращенному ионному уравнению
Н+ + ОН-
H2O
соответствуют схемы уравнений химических реакций
Слайд 29
Al2O3 + 6H+ = 2Al3+ + 6H2O
1.Al2O3 + 3CO2 = Al2(CO3)3
2.Al(NO3)3 + 3KOH =
3KNO3 + Al(OH)3 3.Al2O3 + 3H2SO4 = Al2(SO4)3 + 6H2O
4.AlCL3 + H2O = AlOHCl2+ + HCl
Правильно
Ошибка
Сокращенное ионное уравнение реакции соответствует взаимодействию:
Слайд 30
Установи соответствие
между продуктами реакций ионного обмена
и
схемами реакций
газ
Ca(OH)2 + НСl =>
NaOH + НРO3 =>
CaCO3 + Н2SO4 =>
НСl + K2S =>
осадок
вода
FeCl2 + KOH =>
Слайд 31
1.SO42-и H+ ; Ag+ и Cl-
2.Cl- и
Fe 2+ ; Fe2+ и OH-
3.OH- и Cu2+
; Na+ и SiO32-4.Ba2+ и SO42- ; Cu2+ и OH-
AgCl
Fe(OH)2
Cu(OH)2
BaSO4
Cu(OH)2
Укажите ряд, в котором ионы каждой пары взаимодействуют в растворах с образованием :





























