строения и физических свойств тел от характера движения и
взаимодействия между частицами, из которых состоят тела.«… теплота состоит во внутреннем движении материи» - из работы М.В. Ломоносова «Размышления о причине теплоты и холода» (1750)
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть








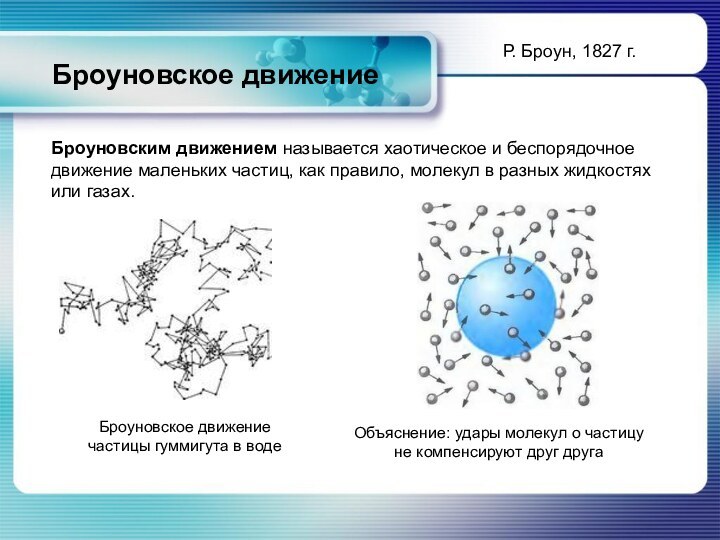


























«… теплота состоит во внутреннем движении материи» - из работы М.В. Ломоносова «Размышления о причине теплоты и холода» (1750)
Основные положения МКТ
«Мальчик и его атом»
Р. Броун, 1827 г.
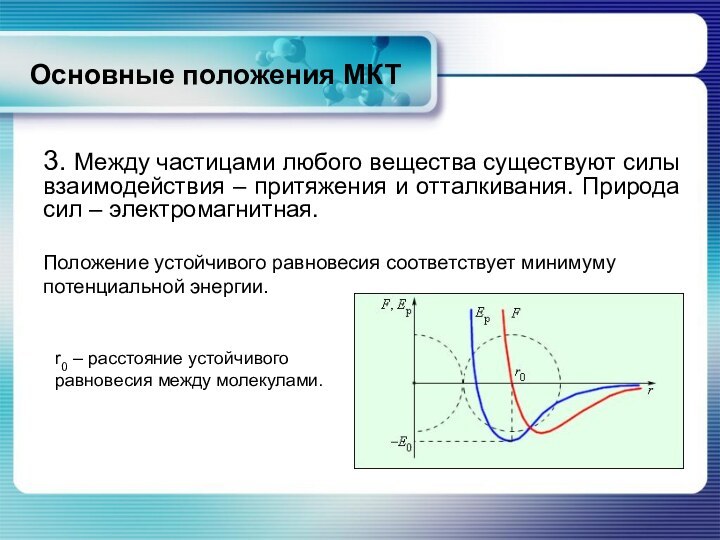
Положение устойчивого равновесия соответствует минимуму потенциальной энергии.
r0 – расстояние устойчивого равновесия между молекулами.
Задание 1
Определите относительную молекулярную массу следующих веществ: O2, HCl, Cu2SO4
1 а.е.м. (атомная единица массы) = 1/12 mC = 1,6610-27кг
Моль – количество вещества, содержащего столько же молекул (атомов), сколько содержится атомов в 0,012 кг углерода. Моль любого вещества содержит одинаковое число молекул (атомов), это число называют числом Авогадро.
NA = 6,0221023моль-1
Молярная масса М – масса одного моля вещества, кг/моль.
М = Mr10-3 кг/моль
N – число молекул (атомов) в веществе.
Задание 3
Определите массу одной молекулы воды.
Жидкости. Обладают текучестью, сохраняют объём. Состояние, в котором наблюдается упорядоченное относительное расположение соседних частиц.
Твёрдые тела. Сохраняют форму и объём. Атомы и молекулы расположены упорядоченно.
Плазма – состояние, в котором имеется большое количество положительно и отрицательно заряженных ионов, а также свободных электронов.
Реальные газы при больших разрежениях ведут себя подобно идеальному.
Состояние некоторой массы газа характеризуют параметрами состояния: объёмом V, давлением p, и абсолютной температурой Т.
Давление р – физическая величина, равная отношению силы F, действующий на элемент поверхности нормально к ней, к площади S этого элемента, измеряется в паскалях (Па).
Внесистемные единицы:
техническая атмосфера 1 ат = 9,81104Па
физическая атмосфера 1 атм = 1,013105Па
миллиметр ртутного столба 1 мм рт. ст. = 133 Па
При изменении температуры изменяются размеры тел, их объёмы, электрическое сопротивление и другие свойства. Для однозначного определения температуры необходим выбор термометрического тела и температурного параметра.
T = 273,16 + t
Основное уравнение МКТ определяет макроскопическую величину – давление газа через концентрацию n молекул, массу m0 отдельных молекул и среднюю квадратическую скорость их движения.
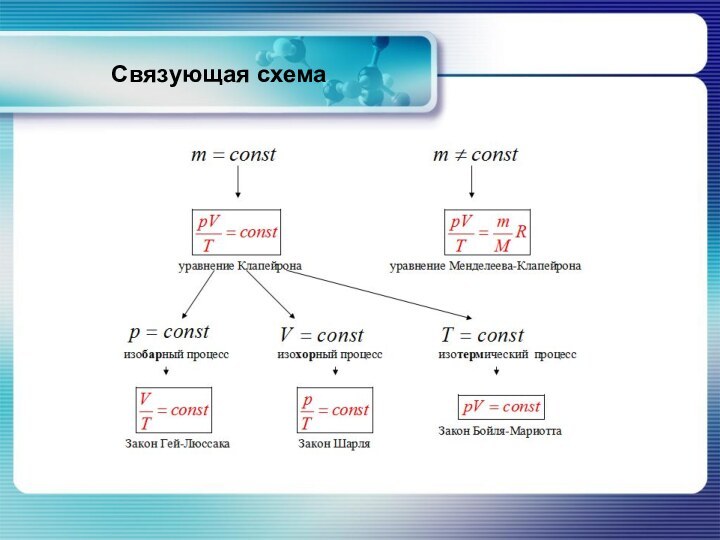
Уравнение состояния
Для двух состояний:
Для двух состояний:
Для двух состояний:
Для двух состояний:
Произведение давления данной массы газа на его объём пропорционально термодинамической температуре.
Задание 9
Определить, есть ли трещины в баллоне, если при повышении температуры с 100 К до 300 К давление повысилось с 120 кПа до 340 кПа.
Задание 11
На сколько изменится масса воздуха в аудитории, если в результате неисправности отопительной системы температура в комнате понизится от 20 до 70C? Объём аудитории определите самостоятельно.
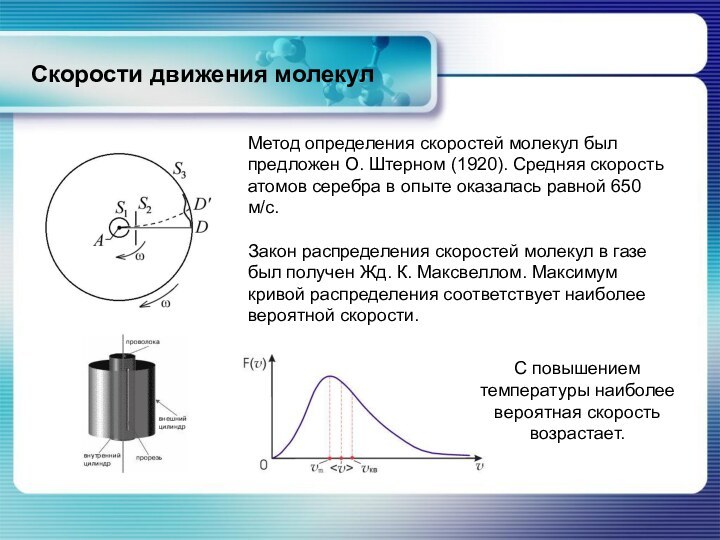
С повышением температуры наиболее вероятная скорость возрастает.
Задание 13
Какова концентрация молекул в воздухе при нормальных условиях?
Задание 14
Идеальный газ сначала изобарно расширили, а затем изотермически сжали до прежнего объёма. Изобразите эти процессы в координатах p-V, p-T, V-T.