Слайд 2
Цели урока:
сформировать представление учащихся о механизме коррозийных процессов,
об их последствиях и способах защиты от коррозии;
развивать умение
работать с опорным конспектом, наблюдать, делать выводы;
воспитывать эмоциональное отношение к изучаемому явлению.
Слайд 3
В III до нашей эры
на
острове Родос был построен
маяк в виде огромной
статуи
Гелиоса. Колосс
Родосский считался одним
из семи чудес света, однако
просуществовал всего 66 лет
и рухнул. У Колосса
Родосского бронзовая
оболочка была смонтирована
на железном каркасе. Под
действием влажного,
насыщенного солями
средиземноморского воздуха
железный каркас разрушился.
Слайд 4
Что является символом Парижа? – Эйфелева башня. Она
неизлечима больна, ржавеет и разрушается, и только постоянная химиотерапия
помогает бороться с этим смертельным недугом:
её красили 18 раз, отчего её масса 9000 т каждый раз увеличивается на 70 т.
Слайд 5
Чугун
Сплав железа с углеродом (2-4%)
Сталь
Сплав железа с углеродом
(меньше 2%)
Применяется в фасонном литье
При добавлении легирующих элементов улучшает
качества
Слайд 6
Коррозия – рыжая крыса,
Грызёт металлический лом.
В. Шефнер
Ежегодно в
мире «теряется»
до ¼ произведённого железа…
А.Н.Несмеянов
Знать
– значит победить!
Слайд 8
Путешествие по царству «Рыжего дъявола»
ст. Информационная
ст. Экспериментальная
ст. Практическая
Слайд 9
разрушение металлов и сплавов под воздействием окружающей среды.
Коррозия
Слайд 10
Виды коррозии
По характеру разрушения
сплошная (общая):
равномерная, неравномерная
локальная(местная):
точечная, пятнами, язвами,
подповерхностная, сквозная и др.
Слайд 11
Химическая коррозия
- вид коррозии, протекающий в средах, непроводящих
электрический ток. Коррозия происходит в результате взаимодействия металла с
разрушающим его веществом.
Образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:
8ē
3Fe0 + 2O20 → (Fe+2Fe2+3)O4-2
Видео- фрагмент
Лабораторный опыт – накаливание медной проволоки
Слайд 12
Электрохимическая коррозия
- в среде электролита возникает электрический ток
при контакте двух металлов (или на поверхности одного металла,
имеющего неоднородную структуру);
- коррозия напоминает работу гальванического элемента: происходит перенос электронов от одного участка металла к другому (от металла к включению).
Видео- фрагмент
Слайд 14
Образующиеся на аноде ионы Fe2+ окисляются до Fe3+
:
4Fe2+ (водн.) + O2 (г.) + (2n + 4)H2O
(ж.) = 2Fe2O3•nH2O (тв.) + 8H+ (водн.)
Коррозия металла на влажном воздухе
Слайд 16
Железо слабо прокорродировало в воде, в чистой воде
коррозия идет медленнее, т. к. вода слабый электролит.
Сравним результаты
опытов № 2 и № 5
Слайд 17
Добавка к воде NaCl усиливает коррозию Fe. добавка
к раствору NaCl – NaOH, как видно из опыта,
наоборот ослабила коррозию, ржавчины нет.
Сравним результаты опытов № 1 и № 2
Слайд 18
Т. о. скорость коррозии данного металла зависит от
состава омывающей среды. Одни составные части омывающий металл среды,
в частности Cl- - ионы усиливают коррозию металлов, другие составные части могут ослаблять коррозию. Коррозия Fe ослабевает в присутствии OH- - ионов.
Слайд 19
В обоих случаях Fe находится в одном и
том же растворе, но в одном случае оно соприкасается
с цинком, а в другом нет.
В пробирке № 2 осадок бурого цвета – это ржавчина, а в пробирке № 4 осадок – белого цвета – это Zn(OH)2
Вывод: В опыте № 4 корродировало не Fe, а Zn , т. к. железо почти не корродирует, если оно соприкасается с цинком.
Сравним результаты опытов № 2 и № 4
Слайд 20
Окисляется Zn, как более активный металл
А (-)
отщепляющиеся
от его атомов
перемещаются на поверхность Fe и
восстанавливают
К (+) Fe
Слайд 21
В обоих случаях Fe находится в одном и
том же растворе, но в одном случае оно соприкасается
с медью, а в другом нет. В обеих пробирках произошла коррозия и появился бурый осадок ржавчины.
В пробирке №2 ржавчины получилось меньше, чем в пробирке №3.
Вывод: таким образом, коррозия и ржавление железа сильно усиливается, когда оно соприкасается с медью.
Сравним результаты опытов № 2 и № 3
Слайд 22
А (-)
К (+) Cu
Реакция растворенного в
воде кислорода с железом приводит к образованию бурой ржавчины.
Слайд 23
Коррозия металла резко усиливается, если он соприкасается с
каким-либо другим, менее активным металлом, т. е. расположенным в
электрохимическом ряду напряжений металлов правее его. Но коррозия замедляется, если металл соприкасается с другим металлом, расположенным левее в электрохимическом ряду напряжений металлов, т. е. более активным.
Слайд 25
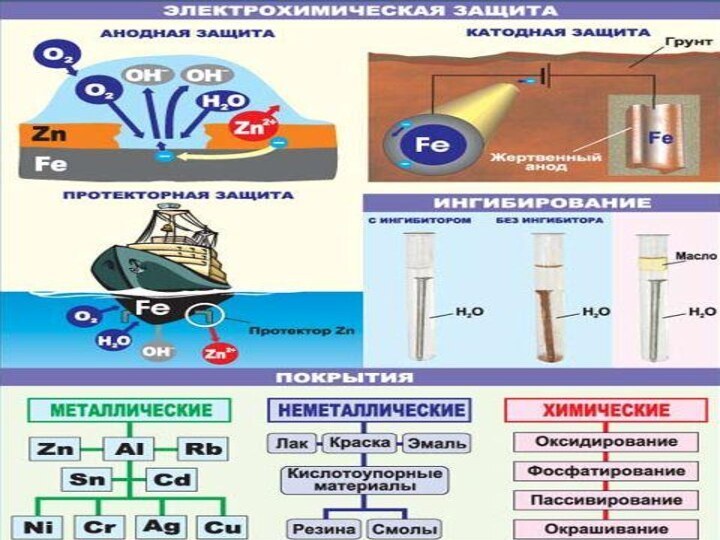
Защита от коррозии
- Изоляция металла от среды
-
Изменение состава металла
(сплава)
- Изменение среды
Слайд 26
Барьерная защита
- механическая изоляция поверхности при использовании поверхностных
защитных покрытий:
неметаллических (лаки, краски, смазки, эмали, гуммирование (резина), полимеры);
металлических (Zn, Sn, Al, Cr, Ni, Ag, Au и др.);
химических (пассивирование концентрированной азотной кислотой, оксодирование, науглероживание и др.)
Слайд 27
Какое поверхностное
защитное покрытие
использовалось
в данном случае?
К
какой группе
поверхностных
защитных покрытий
оно относится?
Барьерная защита
Слайд 28
Какое поверхностное
защитное покрытие
использовалось
в данном случае?
К
какой группе
поверхностных
защитных покрытий
оно относится?
Видео- фрагмент
Барьерная защита
Слайд 29
Изменение состава металла (сплава)
Протекторная защита
- добавление в материал
покрытия порошковых металлов, создающих с металлом донорские электронные пары;
создание контакта с более активным металлом (для стали - цинк, магний, алюминий).
Под действием агрессивной среды постепенно растворяется порошок добавки, а основной материал коррозии не подвергается.
Слайд 30
К основной конструкции прикрепляются заклёпки или пластины из
более активного металла, которые и подвергаются разрушению. Такую защиту
используют в подводных и подземных сооружениях.
Слайд 31
Пропускание электрического тока в направлении, противоположном тому, который
возникает в процессе коррозии.
Изменение состава металла (сплава)
Электрозащита
Слайд 32
В повседневной жизни человек
чаще всего встречается с покрытиями железа цинком и оловом.
Листовое железо, покрытое цинком, называют оцинкованным железом, а покрытое
оловом – белой жестью. Первое в больших количествах идет на кровли домов, а из второго изготавливают консервные банки.
Изменение состава металла (сплава)
Видео- фрагмент
Слайд 33
Введение в металл легирующих добавок:
Cr, Ni, Ti,
Mn, Mo, V, W и др.
Изменение состава металла (сплава)
Легирование
Слайд 34
Изменение среды
Ингибирование
Введение веществ, замедляющих коррозию (ингибиторов):
- для
кислотной коррозии: азотсодержащие органические основания, альдегиды, белки, серосодержащие органические
вещества;
- в нейтральной среде: растворимые фосфаты (Na3PO4), дихроматы (K2Cr2O7), сода (Na2CO3), силикаты (Na2SiO3);
- при атмосферной коррозии: амины, нитраты и карбонаты аминов, сложные эфиры карбоновых кислот.
Слайд 35
В какой пробирке гвоздь не заржавел и почему?
Изменение
среды
Слайд 36
Изменение среды
Деаэрация - удаление веществ, вызывающих коррозию:
нагревание
воды;
пропускание воды через железные стружки;
химическое удаление кислорода
(например,
2Na2SO3 + O2 → 2Na2SO4).
Слайд 37
Подумай и объясни
(домашнее задание)
1. В раствор хлороводородной
(соляной) кислоты поместили пластинку из Zn и пластинку из
Zn, частично покрытую Cu. В каком случае процесс коррозии происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
2. Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов.