- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Урок обобщение по теме Строение атома
Содержание
- 2. История возникновения понятия – химический элемент.Впервые понятие
- 3. Химический элемент Это– тип (вид, сорт) атомов с
- 4. СимволыВсе химические элементы обозначают специальными символами –
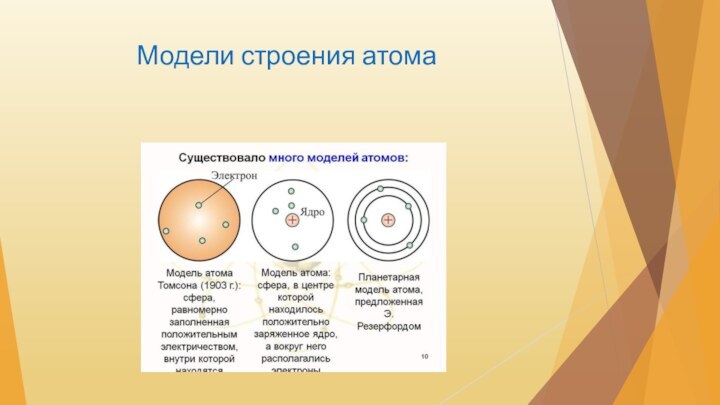
- 5. Модели строения атома
- 6. Строение атома Ядро атома состоит из протонов
- 8. Изотопы.Атомы химических элементов с одинаковым числом протонов,
- 9. Периодическая таблица Д.И.Менделеева В периодической таблице, которую составил
- 10. Ядерные реакции.Количество атомов химического элемента не изменяется
- 11. Аллотропия. Элемент может существовать в виде нескольких
- 12. Форма существования в природе. Формам существования химических
- 13. Разгадайте кроссворд
- 14. КроссвордПо горизонтали: 2. Химический элемент без
- 15. Скачать презентацию
- 16. Похожие презентации
История возникновения понятия – химический элемент.Впервые понятие химического элемента сформулировал Роберт Бойль в 1661 году. Срок элемент имеет в своей основе представления древних о первичных стихии, из которых по их мнению состояла материя: вода, воздух, земля,













Слайд 3
Химический элемент
Это– тип (вид, сорт) атомов с одинаковым
зарядом атомных ядер (т.е. одинаковым количеством протонов в ядре
атома) и определенной совокупностью свойств, но масса ядра атома химического элемента может быть различной, в зависимости от количества нейтронов в нем.
Слайд 4
Символы
Все химические элементы обозначают специальными символами – одной
или двумя латинскими буквами, причем первая буква всегда велика.
Например, водород обозначающие символ H, серу – символом S, железо – символом Fe, кислород – символом O и т.д. Современные символы химических элементов были введены в химию в начале XIX в.
Слайд 6
Строение атома
Ядро атома состоит из протонов (число которых
соответствует атомному числу химического элемента)
и нейтронов; число последних
может быть различным.Вокруг ядра движутся электроны.
Слайд 8
Изотопы.
Атомы химических элементов с одинаковым числом протонов, но
разным числом нейтронов называются изотопами. По своим химическим свойствам
изотопы химических элементов практически не отличаются между собой.
Слайд 9
Периодическая таблица Д.И.Менделеева
В периодической таблице, которую составил Менделеев
было 66 химических элементов. В 1913 году Генри Мозли
открыл то, что атомный номер химического элемента совпадает с зарядом его ядра. Кроме 89-и химических элементов, обнаруженных в природе, другие получены искусственно в результате ядерных реакций (атомы технеция, прометию, протактиния, нобелию в сверхмалых количествах были обнаружены в урановых и ториевых минералах.
Слайд 10
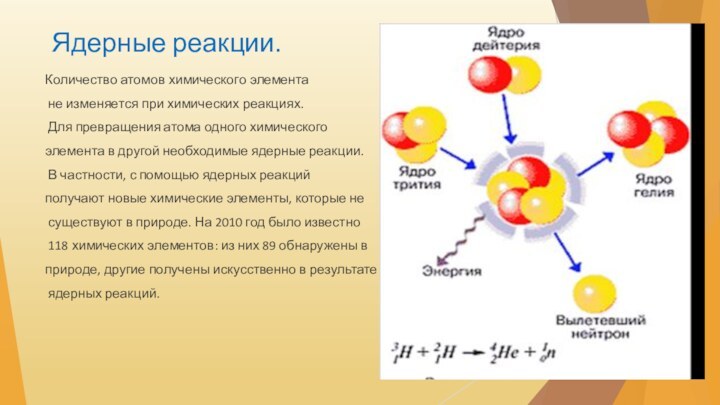
Ядерные реакции.
Количество атомов химического элемента
не изменяется при
химических реакциях.
Для превращения атома одного химического
элемента в
другой необходимые ядерные реакции.В частности, с помощью ядерных реакций
получают новые химические элементы, которые не
существуют в природе. На 2010 год было известно
118 химических элементов: из них 89 обнаружены в
природе, другие получены искусственно в результате
ядерных реакций.





























