- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Альдегиды
Содержание
- 2. Функциональная группа альдегидная (карбонильная) Альдегиды весьма реакционноспособные соединения, это обусловлено наличием в их молекуле поляризованной двойной связи
- 3. Физические свойстваальдегиды могут быть газообразными (формальдегид), жидкими
- 4. Химические свойства
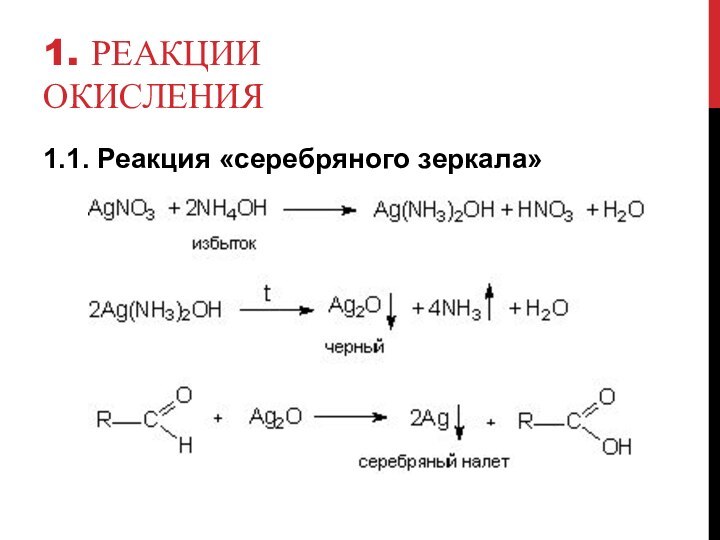
- 5. 1. Реакции окисления1.1. Реакция «серебряного зеркала»
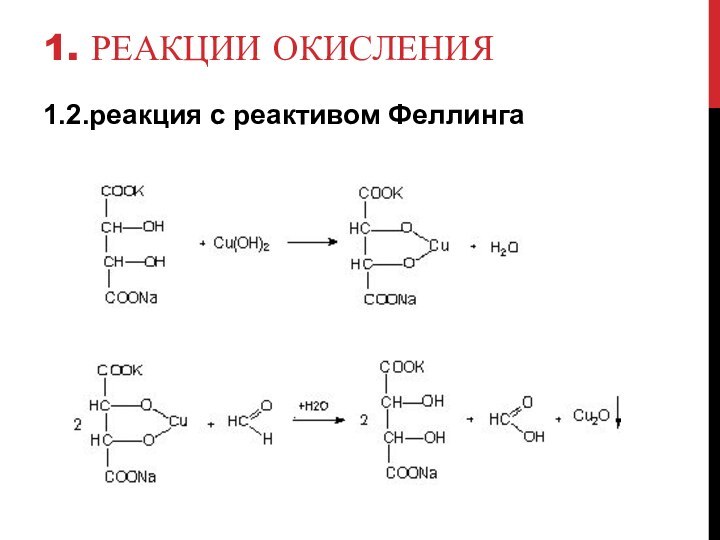
- 6. 1. Реакции окисления1.2.реакция с реактивом Феллинга
- 7. 2. Реакции присоединения
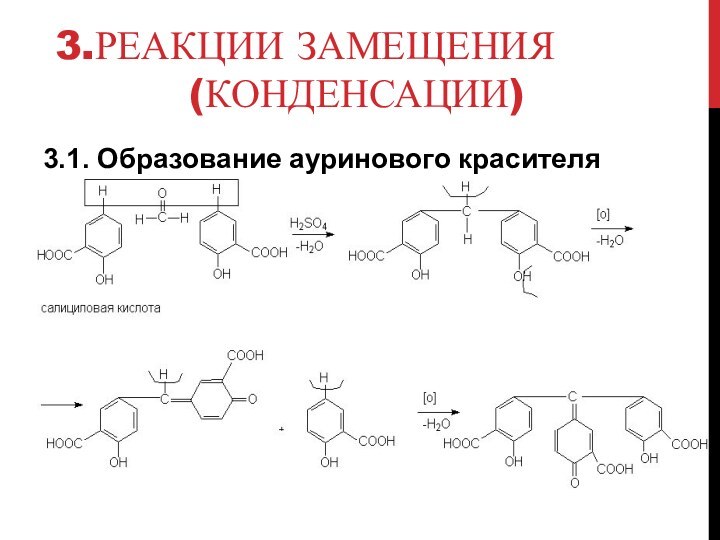
- 8. 3.Реакции замещения (конденсации)3.1. Образование ауринового красителя
- 9. 3.2. конденсация с аммиаком - образование гексаметилентетрамина
- 10. Представители
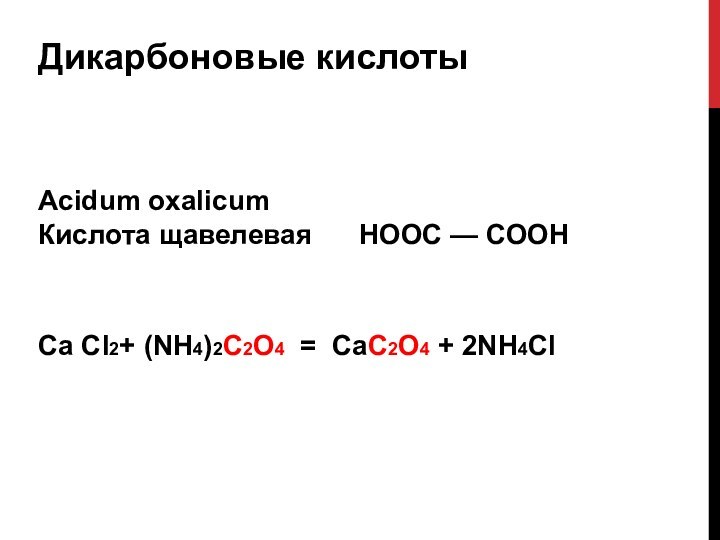
- 11. Карбоновые кислотыAcidum aceticum
- 12. Дикарбоновые кислотыCa Cl2+ (NH4)2C2O4 = CaC2O4 +
- 13. Высшие жирные кислоты
- 14. Скачать презентацию
- 15. Похожие презентации
Функциональная группа альдегидная (карбонильная) Альдегиды весьма реакционноспособные соединения, это обусловлено наличием в их молекуле поляризованной двойной связи




Слайд 2
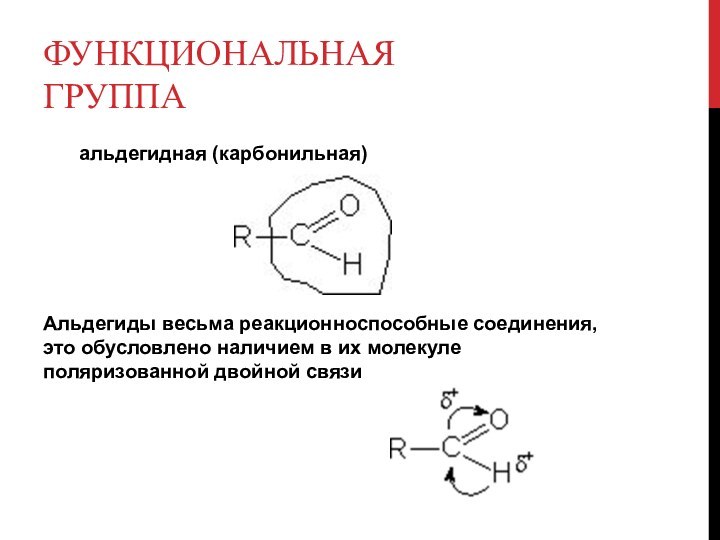
Функциональная группа
альдегидная (карбонильная)
Альдегиды весьма реакционноспособные соединения, это
обусловлено наличием в их молекуле поляризованной двойной связи
Слайд 3
Физические свойства
альдегиды могут быть
газообразными (формальдегид),
жидкими (низшие
альдегиды),
нерастворимые твердые (высшие альдегиды).
Альдегиды хорошо растворяются в спирте,
эфире. Низшие альдегиды имеют неприятный, удушливый запах.
Альдегиды с большой молекулярной массой – приятный цветочный
Слайд 7
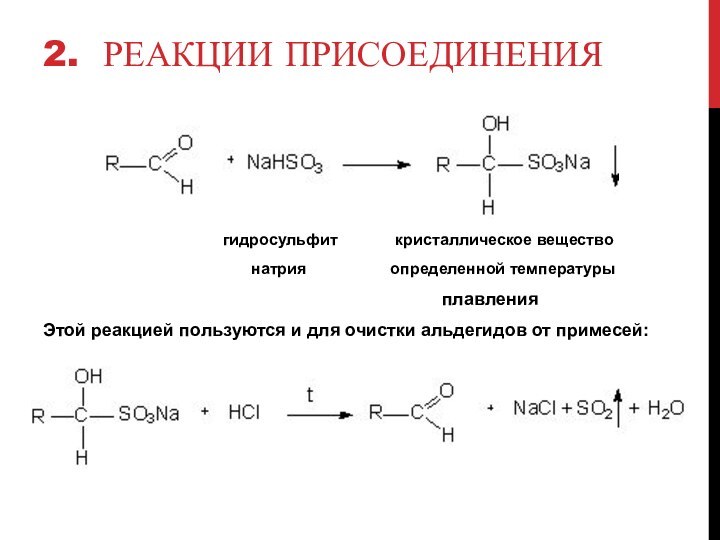
2. Реакции присоединения
гидросульфит кристаллическое вещество
натрия определенной температуры
плавления
Этой реакцией пользуются и для очистки альдегидов от примесей:
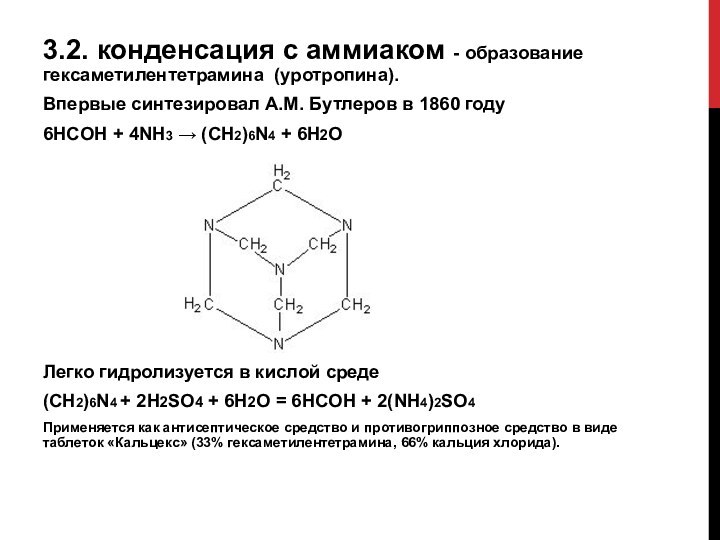
Слайд 9 3.2. конденсация с аммиаком - образование гексаметилентетрамина (уротропина).
Впервые синтезировал А.М. Бутлеров в 1860 году
6HCOH +
4NH3 → (CH2)6N4 + 6H2OЛегко гидролизуется в кислой среде
(CH2)6N4 + 2H2SO4 + 6H2O = 6HCOH + 2(NH4)2SO4
Применяется как антисептическое средство и противогриппозное средство в виде таблеток «Кальцекс» (33% гексаметилентетрамина, 66% кальция хлорида).
Слайд 10
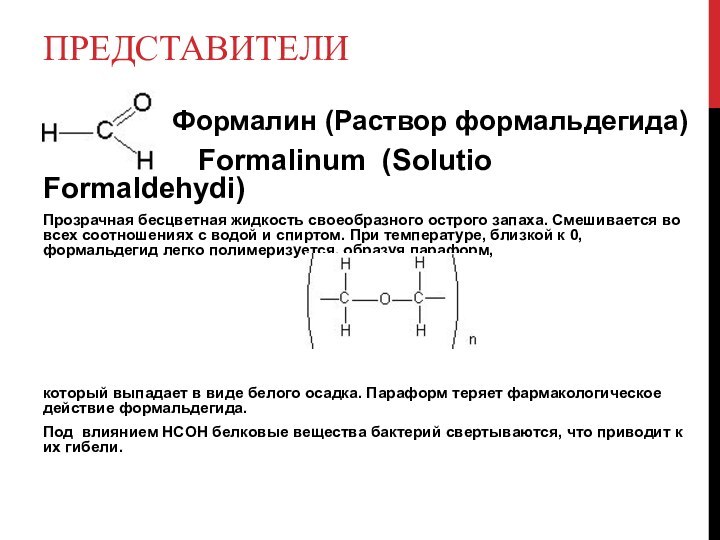
Представители
Формалин
(Раствор формальдегида)Formalinum (Solutio Formaldehydi)
Прозрачная бесцветная жидкость своеобразного острого запаха. Смешивается во всех соотношениях с водой и спиртом. При температуре, близкой к 0, формальдегид легко полимеризуется, образуя параформ,
который выпадает в виде белого осадка. Параформ теряет фармакологическое действие формальдегида.
Под влиянием HCOH белковые вещества бактерий свертываются, что приводит к их гибели.
Слайд 11
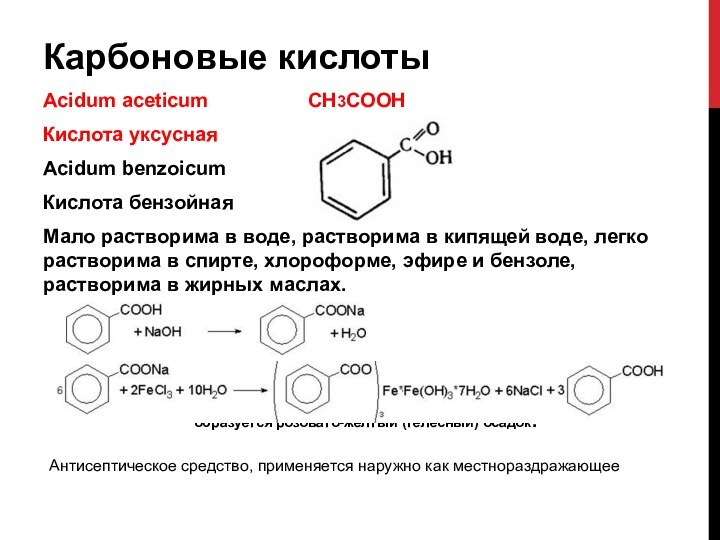
Карбоновые кислоты
Acidum aceticum
СН3СООН
Кислота уксусная
Acidum benzoicum
Кислота бензойная
Мало растворима
в воде, растворима в кипящей воде, легко растворима в спирте, хлороформе, эфире и бензоле, растворима в жирных маслах. образуется розовато-желтый (телесный) осадок.
Антисептическое средство, применяется наружно как местнораздражающее





























