Слайд 2
Печень: общие сведения
Печень — самый крупный орган в
организме человека и животных; у взрослого человека она весит
1,5 кг. Хотя печень составляет 2-3% массы тела, на нее приходится от 20 до 30% потребляемого организмом кислорода.
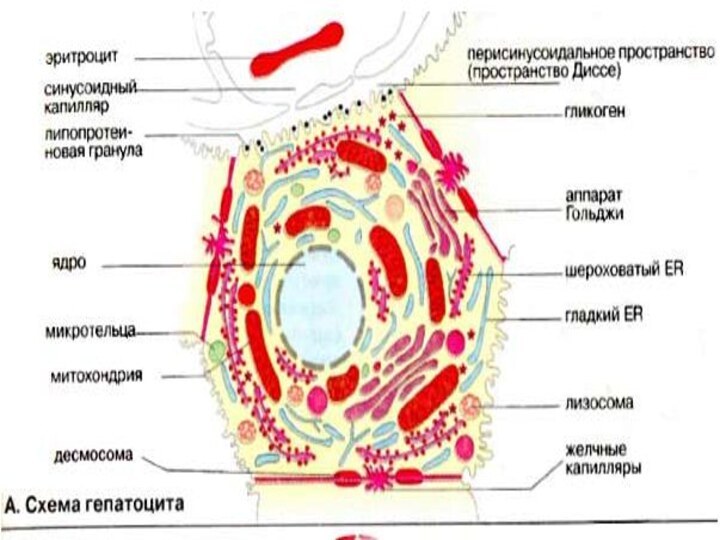
Печень состоит примерно из 300 млрд клеток, 80% из которых составляют гепатоциты. Клетки печени занимают центральное место в реакциях промежуточного метаболизма. Поэтому в биохимическом отношении гепатоциты являются как бы прототипом всех остальных клеток.
Слайд 4
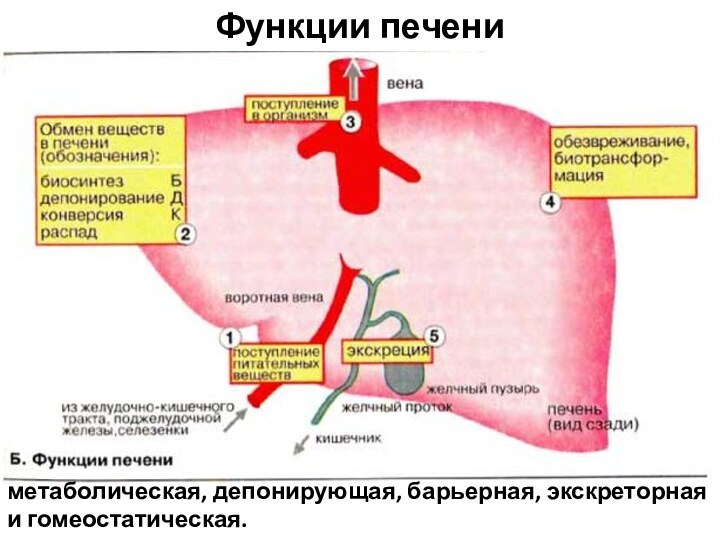
Функции печени
метаболическая, депонирующая, барьерная, экскреторная и гомеостатическая.
Слайд 5
Метаболическая (2Б, К).
Продукты расщепления питательных веществ поступают
в печень (1) из пищеварительного тракта через воротную вену.
В печени протекают сложные процессы обмена белков и аминокислот, липидов, углеводов, биологически активных веществ (гормонов, биогенных аминов и витаминов), микроэлементов, регуляция водного обмена. В печени синтезируются многие вещества (например, желчи), необходимые для функционирования других органов.
Слайд 6
Депонирующая (2Д).
В печени происходит накопление углеводов (например,
гликогена), белков, жиров, гормонов, витаминов, минеральных веществ. Из печени
в организм постоянно поступают макроэргические соединения и структурные блоки, необходимые для синтеза сложных макромолекул (3).
Барьерная (4).
В печени осуществляется обезвреживание (биохимическая трансформация) чужеродных и токсичных соединений, поступивших с пищей или образовавшихся в кишечнике, а также токсических веществ экзогенного происхождения (2К).
Слайд 7
Экскреторная (5).
Из печени различные вещества эндо- и
экзогенного происхождения либо поступают в желчные протоки и выводятся
с желчью (более 40 соединений), либо попадают в кровь, откуда выводятся почками.
Гомеостатическая (на схеме не приведена).
Печень выполняет важные функции по поддержанию постоянного состава крови (гомеостаза), обеспечивая синтез, накопление и выделение в кровь различных метаболитов, а также поглощение, трансформацию и экскрецию многих компонентов плазмы крови.
Слайд 8
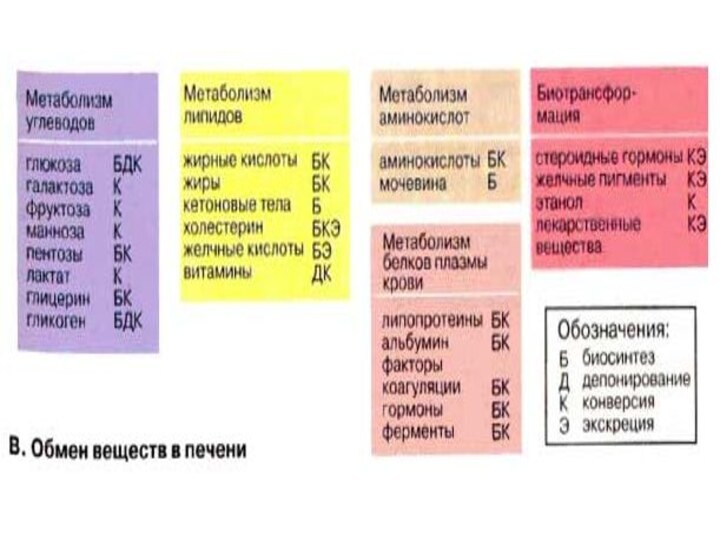
Обмен веществ в печени
Метаболизм углеводов.
Глюкоза и другие
моносахариды поступают в печень из плазмы крови. Здесь они
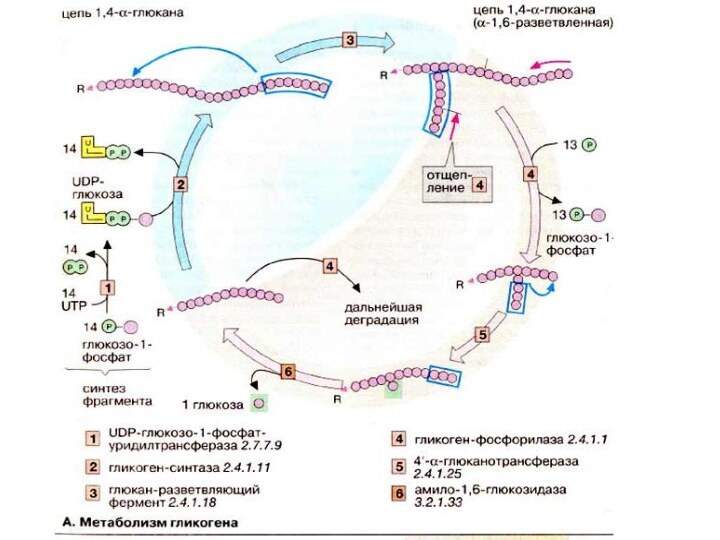
превращаются в глюкозо-6-фосфат и другие продукты гликолиза (см. с. 302). Затем глюкоза депонируется в виде резервного полисахарида гликогена или превращается в жирные кислоты. При снижении уровня глюкозы печень начинает поставлять глюкозу за счет мобилизации гликогена. Если запас гликогена оказывается исчерпанным, глюкоза может синтезироваться в процессе глюконеогенеза из таких предшественников, как лактат, пируват, глицерин или углеродный скелет аминокислот.
Слайд 11
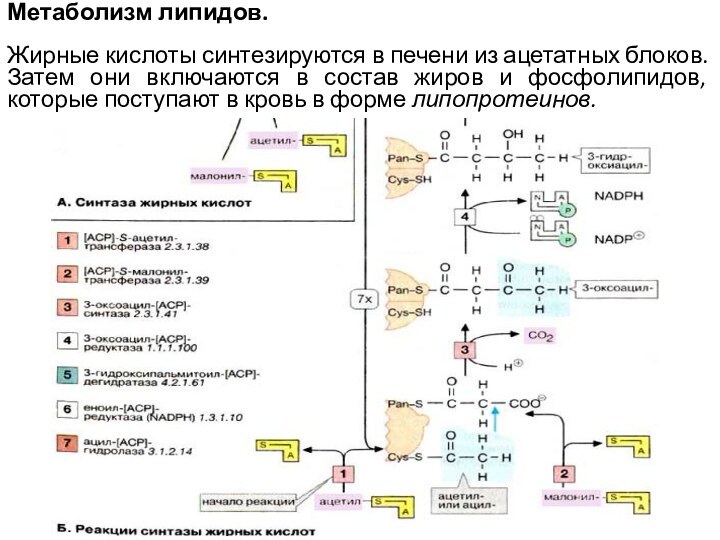
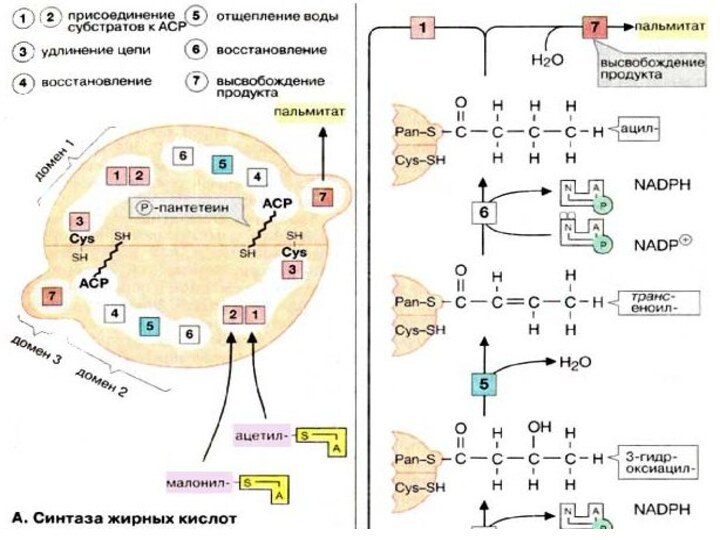
Метаболизм липидов.
Жирные кислоты синтезируются в печени из
ацетатных блоков. Затем они включаются в состав жиров и
фосфолипидов, которые поступают в кровь в форме липопротеинов.
Слайд 13
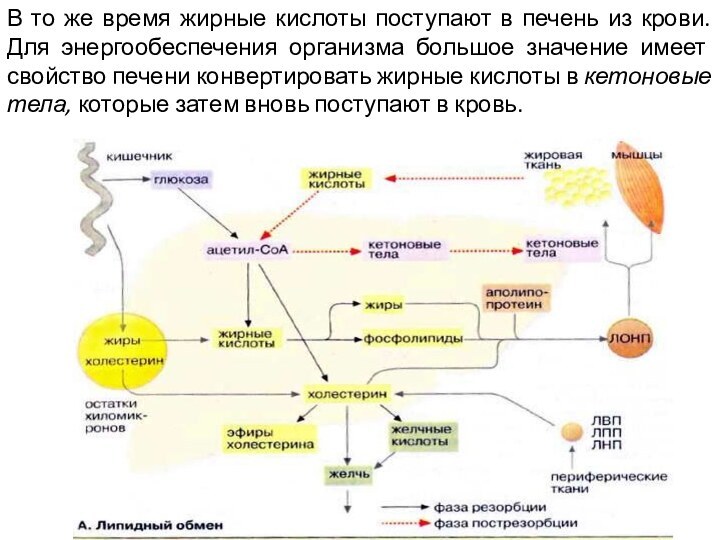
В то же время жирные кислоты поступают в
печень из крови. Для энергообеспечения организма большое значение имеет
свойство печени конвертировать жирные кислоты в кетоновые тела, которые затем вновь поступают в кровь.
Слайд 14
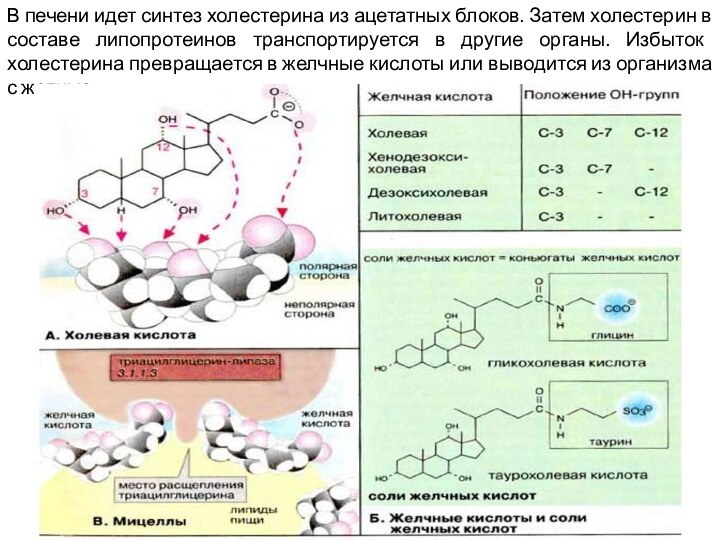
В печени идет синтез холестерина из ацетатных блоков.
Затем холестерин в составе липопротеинов транспортируется в другие органы.
Избыток холестерина превращается в желчные кислоты или выводится из организма с желчью.
Слайд 15
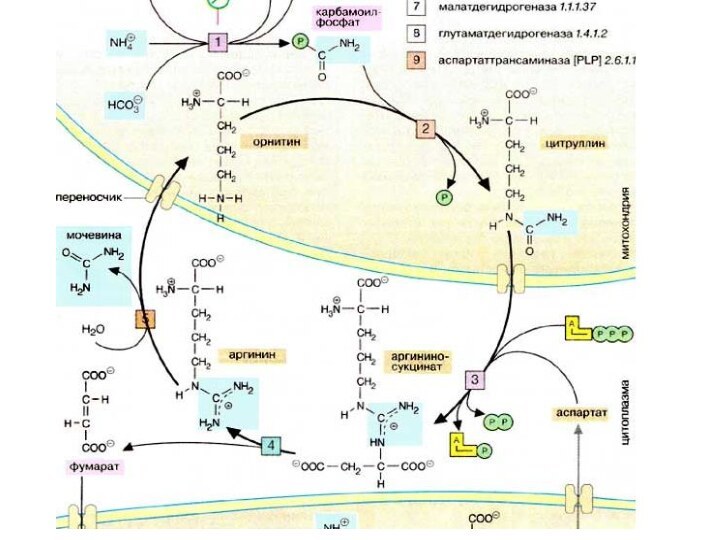
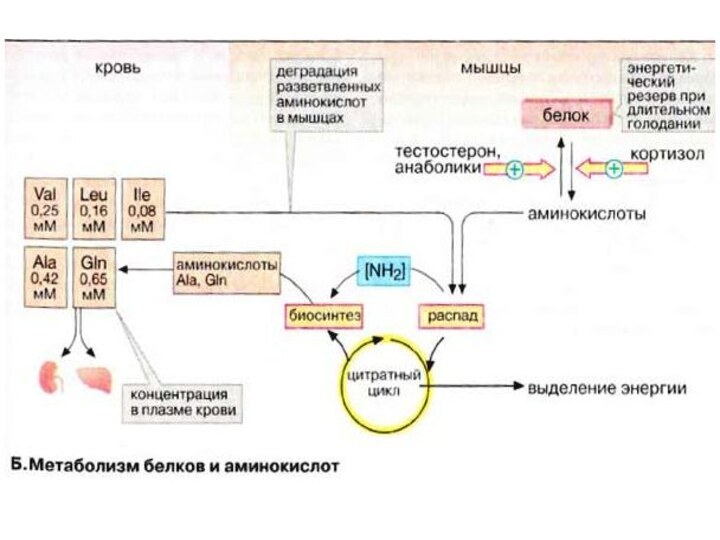
Метаболизм аминокислот и белков.
Уровень аминокислот в плазме
крови регулируется печенью. Избыточные аминокислоты расщепляются, аммиак связывается в
цикле мочевины (см. с. 184), мочевина переносится в почки. Углеродный скелет аминокислот включается в промежуточный метаболизм как источник для синтеза глюкозы (глюконеогенез) или как источник энергии. Кроме того, в печени осуществляется синтез и расщепление многих белков плазмы крови.
Слайд 17
Биохимическая трансформация.
Стероидные гормоны и билирубин, а также
лекарственные вещества, этанол и другие ксенобиотики поступают в печень,
где они инактивируются и конвертируются в высоко полярные соединения.
Слайд 19
Депонирование.
Печень служит местом депонирования энергетических резервов организма
(содержание гликогена может достигать 20% массы печени) и веществ-предшественников;
здесь также депонируются многие минеральные вещества, следовые элементы, ряд витаминов, в том числе железо (около 15% всего железа, содержащегося в организме), ретинол, витамины A, D, K, B12 и фолиевая кислота.
Слайд 22
Компенсаторные функции печени
Ткани высших организмов нуждаются в постоянном
притоке макроэргических веществ и предшественников для синтеза более сложных
макромолекул. Потребности организма обеспечиваются за счет питания, однако оно бывает нерегулярным и неравномерным. Перерывы в поступлении питательных веществ компенсируются печенью, которая вместе с другими тканями, прежде всего жировой тканью, выполняет компенсаторные и депонирующие функции.
В биохимии питания принято различать фазу резорбции и фазу пострезорбции которая охватывает состояния организма во время разгрузочных дней (в том числе при соблюдении поста) вплоть до полного голодания. Переход между этими двумя фазами определяется концентрацией макроэргических соединений в плазме крови и регулируется гормонами и вегетативной нервной системой.
Слайд 23
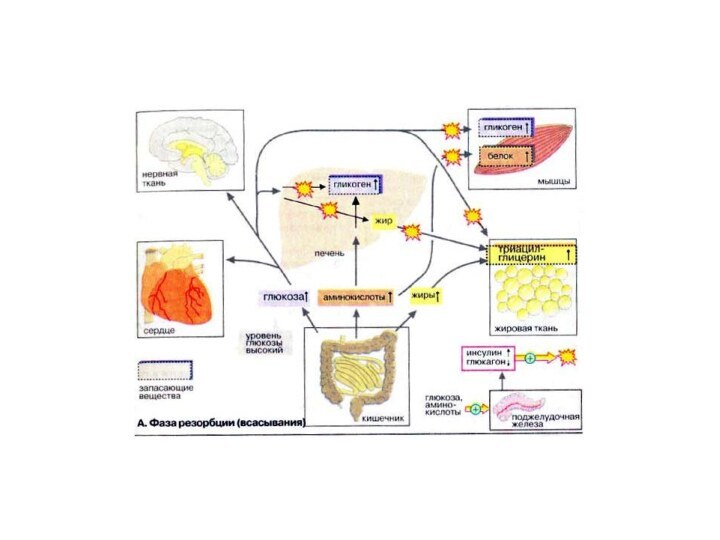
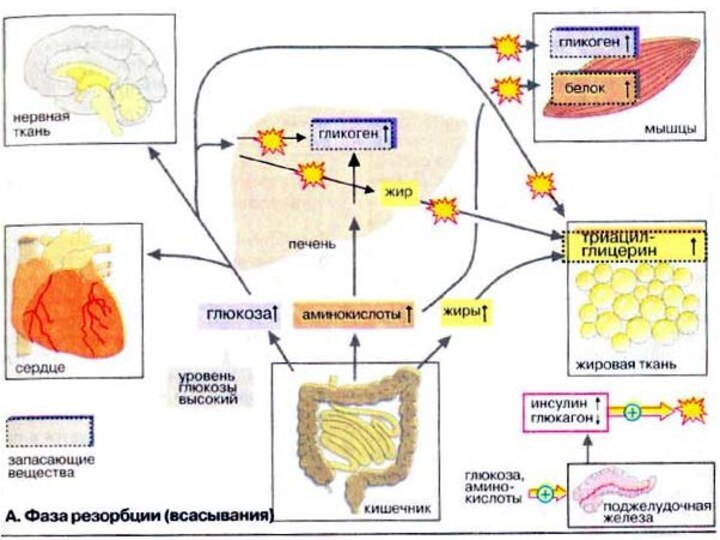
Фаза резорбции
Фаза резорбции (всасывания) начинается непосредственно с приемом
пищи и длится примерно 2-4 ч. За счет переваривания
пищи в плазме крови временно увеличивается концентрация глюкозы, аминокислот и жиров (триглицеринов).
Поджелудочная железа отвечает на это изменением выброса гормонов: увеличением секреции инсулина и уменьшением секреции глюкагона. Увеличение соотношения инсулин/гпюкагон в сочетании с богатыми энергией субстратами стимулирует переход тканей (особенно печени, мышечной и жировой тканей) в анаболическую фазу.
В печени из поступающих субстратов синтезируются гликоген и жиры. Гликоген депонируется в печени, жиры в виде липопротеинов очень низкой плотности [ЛОНП (VLDL)] поступают в кровь.
Слайд 25
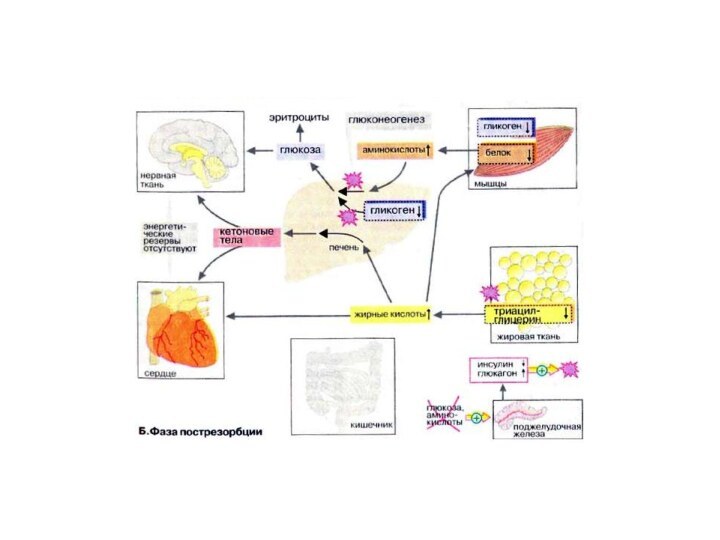
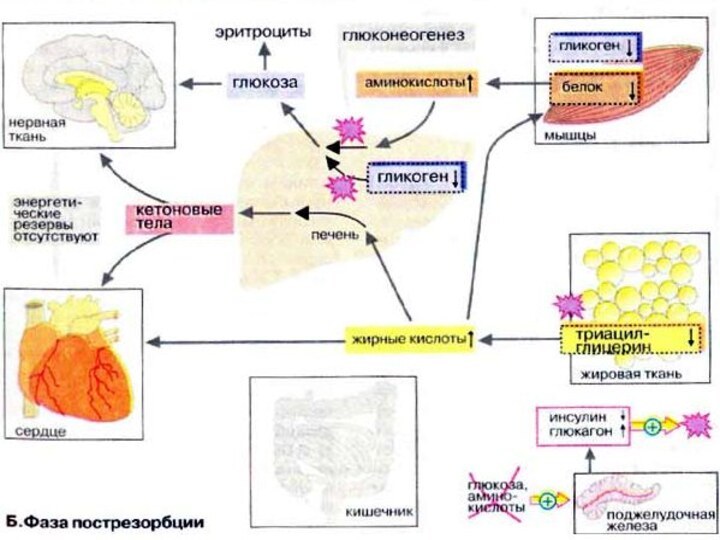
Фаза пострезорбции
При прекращении поступления пищи вскоре начинается фаза
пострезорбции. Эта стадия начинается с изменения секреции гормонов поджелудочной
железы: теперь А-клетки секретируют больше глюкагона, а В-клетки прекращают секрецию инсулина. Низкое соотношение инсулин/глюкагон в плазме крови запускает процесс промежуточного метаболизма в обратном направлении. Теперь организм должен вернуться к использованию собственных энергетических резервов. В организме начинается расщепление запасных веществ — гликогена, жиров, белков, и запускается производство макроэргических субстратов в печени.
Слайд 27
В печени происходит мобилизация гликогена (гликогенолиз, см. с.
158), Полученная глюкоза используется для обеспечения других тканей, прежде
всего мозга, коры надпочечников и эритроцитов, не располагающих собственными резервами глюкозы. Если спустя несколько часов резервы глюкозы в печени окажутся исчерпанными, усиливается процесс глюконеогенеза (см. с. 156). Субстраты поступают из мышц (аминокислоты) и жировой ткани (глицерин). Высвободившиеся жирные кислоты используются печенью для синтеза кетоновых тел (кетогенез, см. с. 304), которые направляются в кровь и служат важнейшим источником энергии в пострезорбционной фазе.
В мышцах разнообразные резервы глюкозы используются исключительно для собственных нужд (см. с. 238). Аминокислоты, образующиеся за счет медленного расщепления белков, поступают в печень и утилизируются в процессе глюконеогенеза.
Слайд 29
В жировой ткани гормоны инициируют липолиз с образованием
глицерина и жирных кислот. Жирные кислоты служат источником энергии
во многих тканях (за исключением мозга и эритроцитов). Важным приемником жирных кислот является печень, где они используются для синтеза кетоновых тел.
Слайд 30
Метаболизм углеводов
Глюкоза, наряду с жирными кислотами и кетоновыми
тепами, является важнейшим источников энергии. Уровень глюкозы в крови
поддерживается постоянным 4-6 мМ (0,8-1,0 г/л) благодаря тонкой регуляции процессов ее поступления и потребления. Глюкоза поступает из кишечника (за счет переваривания пищи), печени и почек. При этом печень выполняет функцию «глюкостата»: в фазе резорбции глюкоза поступает в печень из крови и накапливается в виде гликогена. При дефиците глюкозы (фаза пострезорбции, голодание) печень, напротив, поставляет глюкозу, которая образуется за счет процессов гликогенолиза и глюконеогенеза (см. с. 300).
Слайд 32
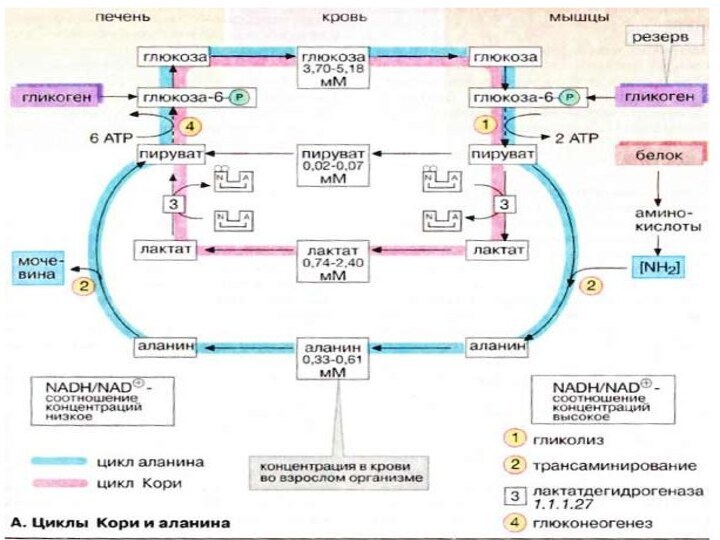
Печень обладает свойством синтезировать глюкозу из других сахаров,
например фруктозы и галактозы, или из других продуктов промежуточного
метаболизма. Превращение лактата в глюкозу в цикле Кори (см. с. 330) и аланина в глюкозу в цикле аланина (см. с. 330) играет особую роль в обеспечении эритроцитов и мышечных клеток.
Необходимыми условиями активного углеводного обмена в печени является обратимый транспорт сахаров через плазматическую мембрану гепатоцитов (при отсутствии контроля инсулином) и наличие фермента глюкозо-6-фосфатазы, высвобождающего глюкозу из глюкозо-6-фосфата.
Слайд 35
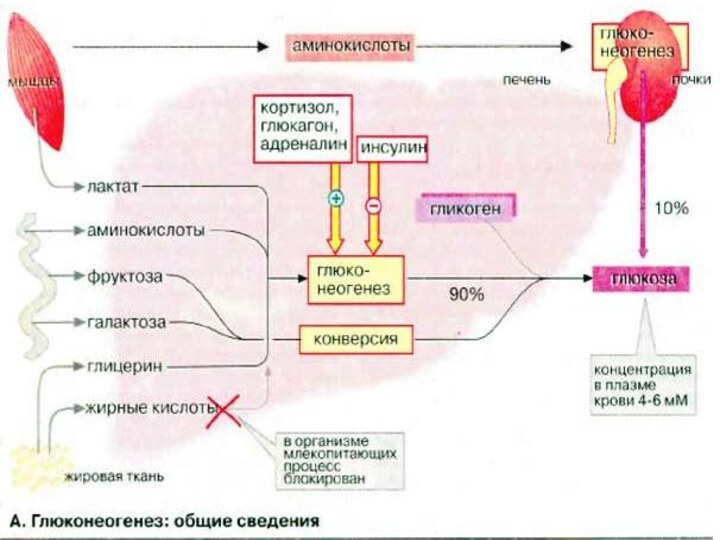
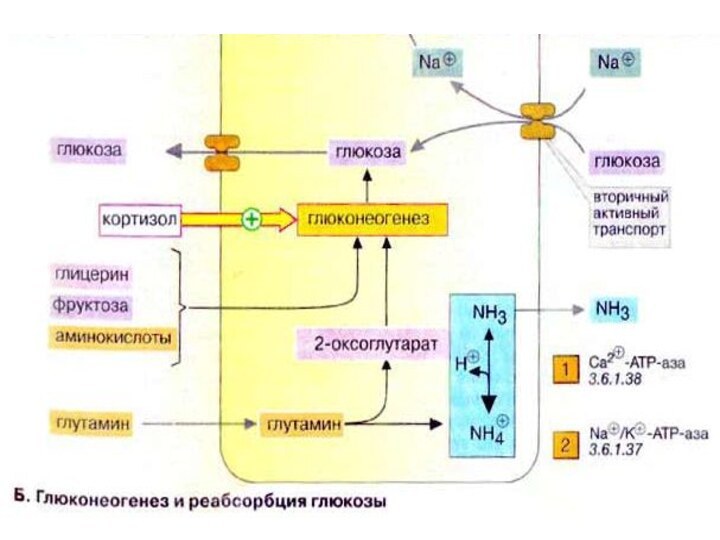
Глюконеогенез: общие сведения
Синтез глюкозы de novo (до 250
г в сутки) происходит в основном в печени. Процесс
глюконеогенеза может идти и в почках, однако из-за небольших размеров почек их вклад в синтез глюкозы составляет всего 10%.
Глюконеогенез контролируется гормонами. Кортизол, глюкагон и адреналин стимулируют этот процесс, а инсулин, напротив, подавляет.
При глюконеогенезе в печени наиболее важными субстратами являются лактат, поступающий из мышечной ткани и эритроцитов, аминокислоты из желудочно-кишечного тракта (глюкогенные аминокислоты) и мышц (аланин), а также глицерин из жировых тканей. В почках в качестве субстрата служат главным образом аминокислоты (см. с. 320).
Слайд 37
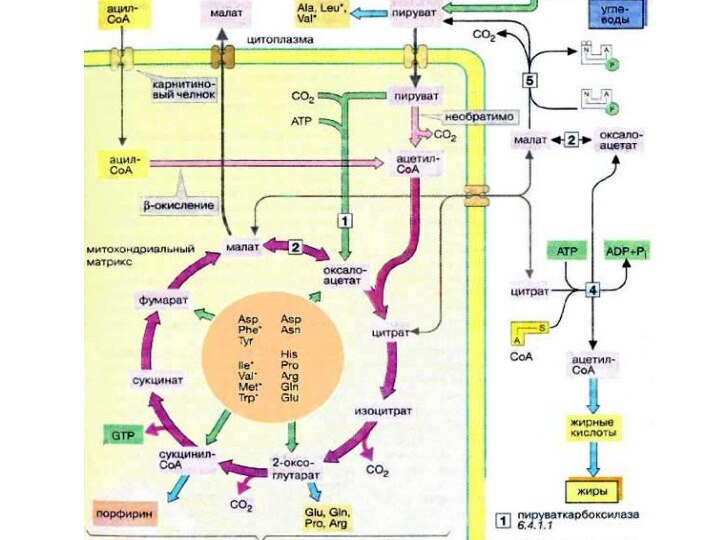
Жирные кислоты и другие источники ацетил-КоА не могут
использоваться в организме млекопитающих для биосинтеза глюкозы, поскольку ацетил-КоА,
образующийся при β-окислении в цитратном цикле (см. с. 140), полностью окисляется до СО2, в то время как в глюконеогенезе исходным продуктом является оксалоцетат.
Слайд 39
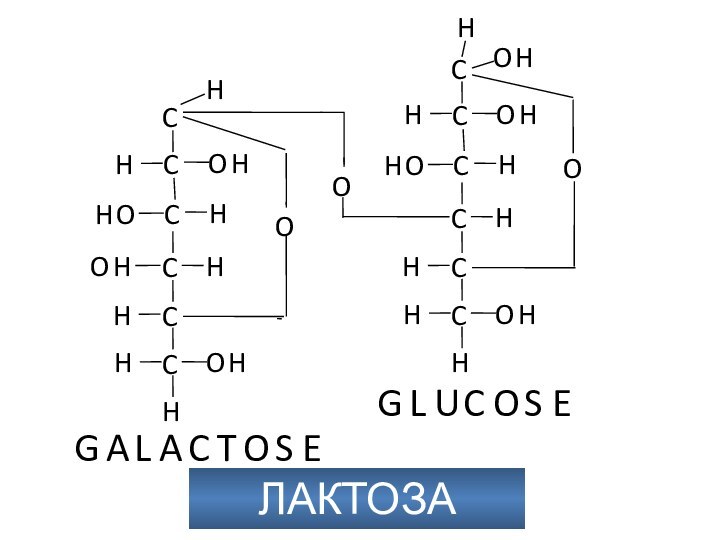
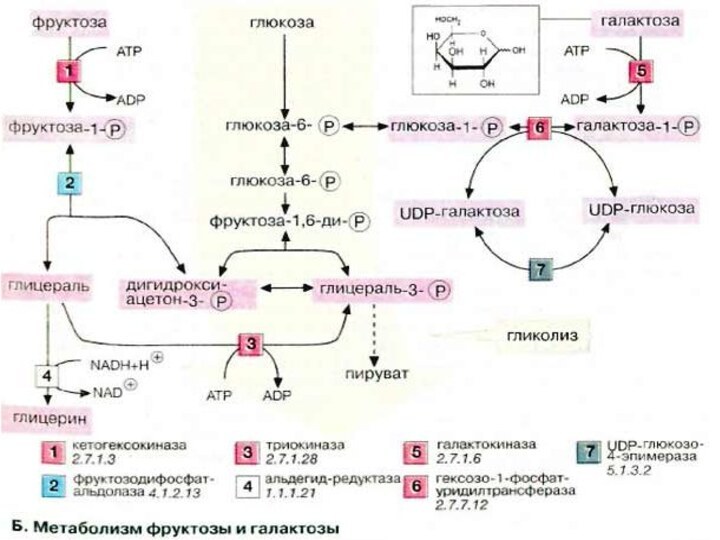
Метаболизм фруктозы и галактозы
Метаболизм фруктозы осуществляется превращением ее
в глюкозу (на схеме слева). Вначале фруктоза фосфорилируется при
участии фермента кетогексокиназы (фруктокиназы) [1] с образованием фруктозо-1-фосфата, который далее расщепляется альдолазой до глицеральдегида (глицераля) и дигидроксиацетон-3-фосфата [2]. Последний уже является промежуточным продуктом гликолиза (в центре схемы), а глицераль фосфорилируется в присутствии триокиназы, образуя глицераль-3-фосфат [3].
Затем глицеральдегид частично восстанавливается до глицерина [4] или окисляется до глицерата. После фосфорилирования оба соединения вновь включаются в гликолиз (на схеме не приведено). При восстановлении глицеральдегида [4]расходуется НАДН (NADH). Поскольку при конверсии этанола лимитирующим фактором является низкое соотношение концентраций НАД+/НАДН (NAD+/NADH). Этот процесс ускоряется в присутствии фруктозы (см. с. 312).
Слайд 41
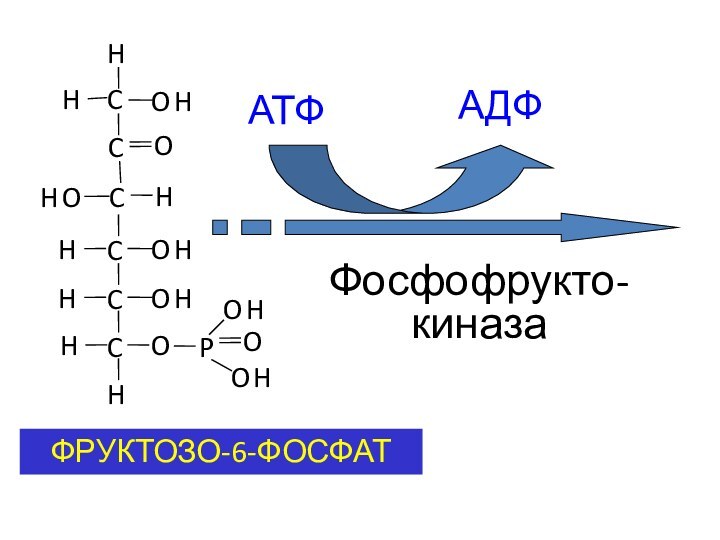
ФРУКТОЗО-6-ФОСФАТ
АТФ
АДФ
Фосфофрукто-киназа
Слайд 44
Метаболизм липидов
Печень является главным местом синтеза жирных кислот,
жиров, кетоновых тел и холестерина. Жиры могут также синтезироваться
в жировой ткани, однако ее основной функцией остается депонирование липидов.
Обмен липидов в печени тесно связан с превращением углеводов и аминокислот. При поступлении питательных веществ в фазе резорбции (см. с. 300) глюкоза через промежуточное образование ацетил-КоА (ацетил-СоА) конвертируется в жирные кислоты. Печень может также извлекать жирные кислоты из липопротеинов, поступающих из желудочно-кишечного тракта (в виде хиломикронов) и других тканей (см. с. 272). Жирные кислоты используются для биосинтеза триглицеринов и фосфолипидов. При связывании жиров с аполипопротеинами образуются липопротеиновые комплексы очень низкой плотности [ЛОНП (VLDL), см. с. 272]. Они попадают в кровь и переносятся в другие ткани, прежде всего в жировую и мышечную ткань.
Слайд 45
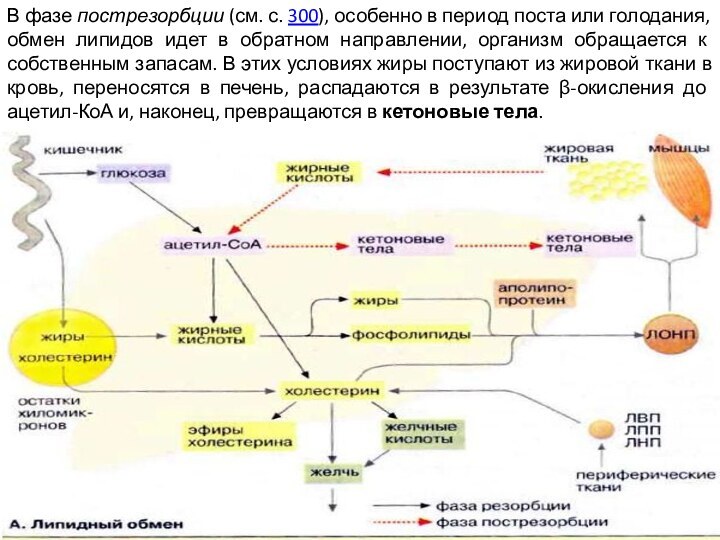
В фазе пострезорбции (см. с. 300), особенно в
период поста или голодания, обмен липидов идет в обратном
направлении, организм обращается к собственным запасам. В этих условиях жиры поступают из жировой ткани в кровь, переносятся в печень, распадаются в результате β-окисления до ацетил-КоА и, наконец, превращаются в кетоновые тела.
Слайд 46
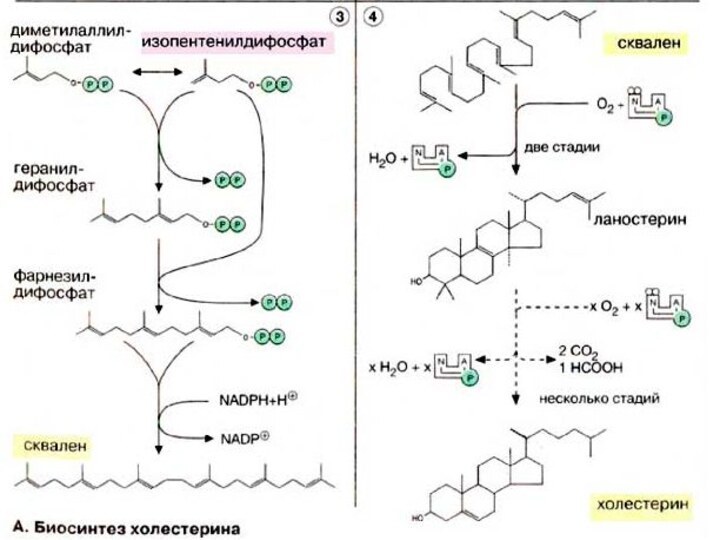
Холестерин поступает в организм из двух источников —
с пищей и за счет эндогенного синтеза, причем большая
часть холестерина синтезируется в печени. Биосинтез холестерина начинается с ацетил-КоА (см. с. 174). Полученный холестерин используется в синтезе желчных кислот (см. с. 306), встраивается в клеточные мембраны (см. с. 216), депонируется в жировых каплях в составе эфиров жирных кислот. Остальная часть поступает в кровь в составе липопротеиновых комплексов [ЛОНП (VLDL)] и переносится в другие ткани. Печень способствует обмену холестерина благодаря тому, что служит местом, худа поступают с кровью и где подвергаются расщеплению липопротеиновые комплексы [ЛВП, ЛПП, ЛНН (HDL, IDL, LDL), см. с. 272], содержащие холестерин и его эфиры с жирными кислотами.
Слайд 49
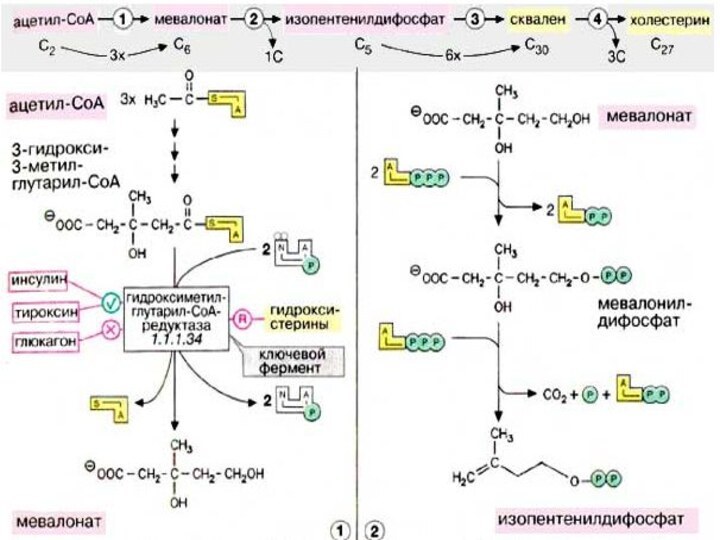
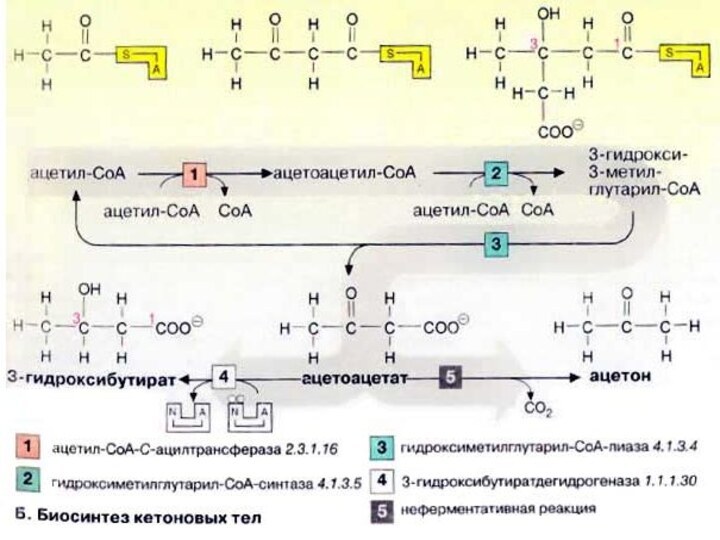
Биосинтез кетоновых тел
При высокой концентрации ацетил-КоА в митохондриях
гепатоцитов происходит конденсация двух молекул ацетил-КоА с образованием ацетоацетил-КоА
[1]. Присоединение еще одной ацетильной группы [2] приводит к 3-гидрокси-З-метилглутарил-КоА (ГМГ-КоА) [3], который после отщепления ацетил-КоА превращается в ацетоуксусную кислоту (ацетоацетат) (цикл Линена). При восстановлении последней получается 3-гидроксибутират [4], а при неферментативном декарбоксилировании — ацетон [5]. Все три соединения принято называть «кетоновыми телами», что не совсем правильно, поскольку в 3-гидроксимасляной кислоте отсутствует кетогруппа!
Слайд 51
Кетоновые тела поступают из печени в кровь, где
они хорошо растворимы. Концентрация кетоновых тел в крови возрастает
в фазе пострезорбции (фаза голодания). Наряду с жирными кислотами 3-гидроксибутират и ацетоацетат в этот период являются основными энергоносителями. Ацетон, не имеющий метаболической ценности, удаляется через легкие. После 1-2 недели голодания кетоновые тела начинают использоваться в качестве источника энергии нервными тканями. Однако при этом для обеспечения цитратного цикла необходимо минимальное количество глюкозы.
Слайд 52
Если биосинтез кетоновых тел превышает потребности организма, они
накапливаются в крови (кетонемия) и, наконец, выводятся с мочой
(кетонурия). Оба феномена наблюдаются во время длительного голодания (углеводная недостаточность) и при заболеваний диабетом (Diabetes mellitis). Хотя 3-гидроксимасляная кислота является слабой кислотой (рКа примерно 4), возрастание концентрации кетоновых тел вызывает изменение рН в крови (кетоацидоз, см. с. 280). Кетонурия и кетоацидоз могут быстро привести к электролитному сдвигу (нарушению ионного гомеостаза) и потери сознания (кетоацидозной коме) и, следовательно, опасны для жизни.
Слайд 53
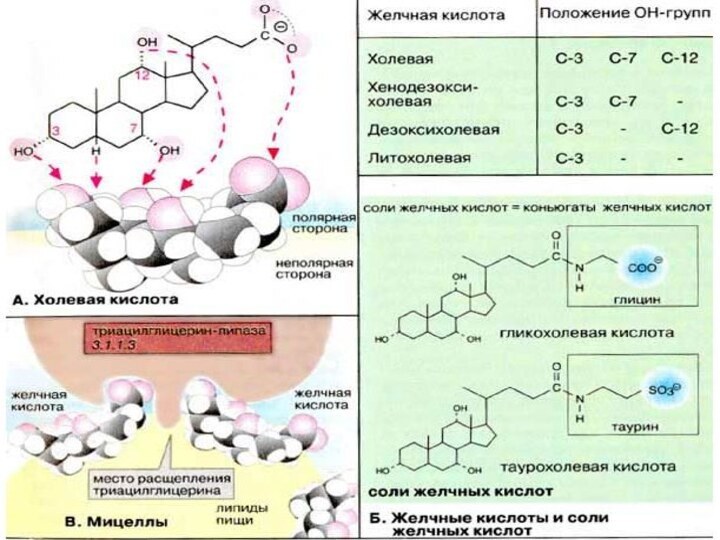
Желчные кислоты
Холевая кислота
В печени из холестерина образуются желчные
кислоты (см. с. 304). Эти стероидные соединения с 24
атомами углерода являются производные холановой кислоты, имеющими от одной до трех α-гидроксильных групп и боковую цепь из 5 атомов углерода с карбоксильной группой на конце цепи. В организме человека наиболее важна холевая кислота. В желчи при слабощелочном рН она присутствует в виде холат-аниона.
Слайд 54
Желчные кислоты и соли желчных кислот
Кроме холевой кислоты
в желчи содержится также хенодезоксихолевая кислота. Она отличается от
холевой отсутствием гидроксильной группы при С-12. Оба соединения принято называть первичными желчными кислотами. В количественном отношении это наиболее важные конечные продукты обмена холестерина.
Другие две кислоты, дезоксихолевая и литохолевая, называются вторичными желчными кислотами, поскольку они образуются путем дегидроксилирования по С-7 первичных кислот в желудочно-кишечном тракте. В печени образуются конъюгаты желчных кислот с аминокислотами (глицином или таурином ),связанные пептидной связью. Эти конъюгаты являются более сильными кислотами и присутствуют в желчи в форме солей (холатов и дезоксихолатов Na+ и К+, называемых солями желчных кислот).
Слайд 56
Мицеллы
В связи с наличием в структуре α-гидроксильных групп
желчные кислоты и соли желчных кислот являются амфифильными соединениями
и обладают свойствами детергентов (см. с. 34). Основные функции желчных кислот состоят в образовании мицелл, эмульгировании жиров и солюбилизации липидов в кишечнике. Это повышает эффективность действия панкреатической липазы и способствует всасыванию липидов (см. с. 264).
На рисунке показано, как молекулы желчных кислот фиксируются на мицелле своими неполярными частями, обеспечивая ее растворимость. Липаза агрегирует с желчными кислотами и гидролизует жиры (триацилглицерины), содержащиеся в жировой капле.
Слайд 57
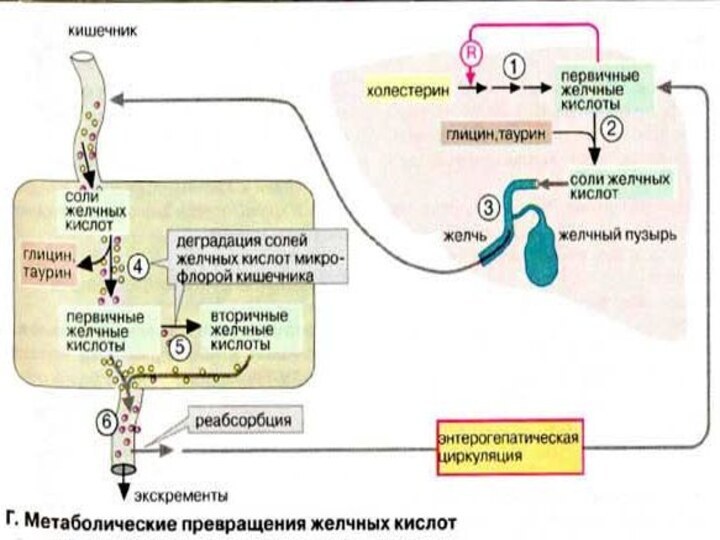
Метаболические превращения желчных кислот
Первичные желчные кислоты образуются исключительно
в цитоплазме клеток печени. Процесс биосинтеза (1) начинается с
гидроксилирования холестерина по С-7 и С-12, и эпимеризации по C-3, затем следует восстановление двойной связи в кольце В (см. рис. 63) и укорачивание боковой цепи на три углеродных атома.
Лимитирующей стадией является гидроксилирование по С-7 с участием 7α-гидроксилазы. Холевая кислота служит ингибитором реакции, поэтому желчные кислоты регулируют скорость деградации холестерина.
Коньюгирование желчных кислот проходит в две стадии. Вначале образуются КоА-эфиры желчных кислот, а затем следует собственно стадия конъюгации с глицином или таурином (2) с образованием, например, гликохолевой и таурохолевой кислот. Желчь дренируется во внутрипеченочные желчные протоки и накапливается в желчном пузыре (3).
Слайд 59
Кишечная микрофлора продуцирует ферменты, осуществляющие химическую модификацию желчных
кислот (4). Во-первых, пептидная связь гидролизуется (деконьюгирование), и, во-вторых,
за счет дегидроксилирования С-7 образуются вторичные желчные кислоты (5). Однако большая часть желчных кислот всасывается кишечным эпителием (6) и после попадания в печень вновь секретируется в составе желчи (энтерогепатическая циркуляция желчных кислот). Поэтому из 15-30 г солей желчных кислот, ежедневно поступающих в организм с желчью, в экскрементах обнаруживается только около 0,5 г. Это примерно соответствует ежесуточному биосинтезу холестерина de novo.
При неблагоприятном составе желчи отдельные компоненты могут кристаллизоваться. Это влечет за собой отложение желчных камней, которые чаще всего состоят из холестерина и кальциевых солей желчных кислот (холестериновые камни), но иногда эти камни включают и желчные пигменты.
Слайд 60
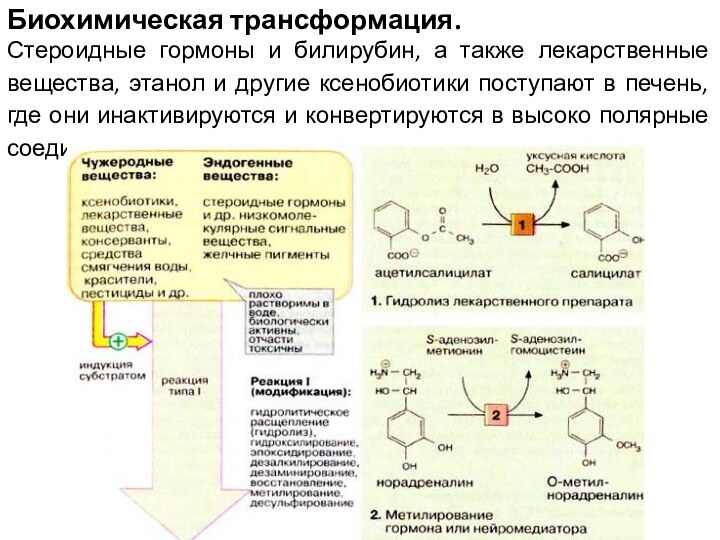
Биохимическая трансформация
В животные организмы чужеродные вещества попадают с
пищей или из окружающей среды через кожу и легкие.
Эти вещества могут быть природного происхождения (ксенобиотики) или продуктами жизнедеятельности человека. Многие из ник оказывают на организм токсическое действие, в особенности при высоких концентрациях. Однако организм располагает эффективным механизмом инактивации и выведения чужеродных веществ путем их биохимической трансформации. Механизм превращения чужеродных веществ в сущности аналогичен ферментативной модификации обычных эндогенных субстратов, таких, как желчные пигменты и стероиды. Биотрансформация происходит главным образом в печени.
Слайд 61
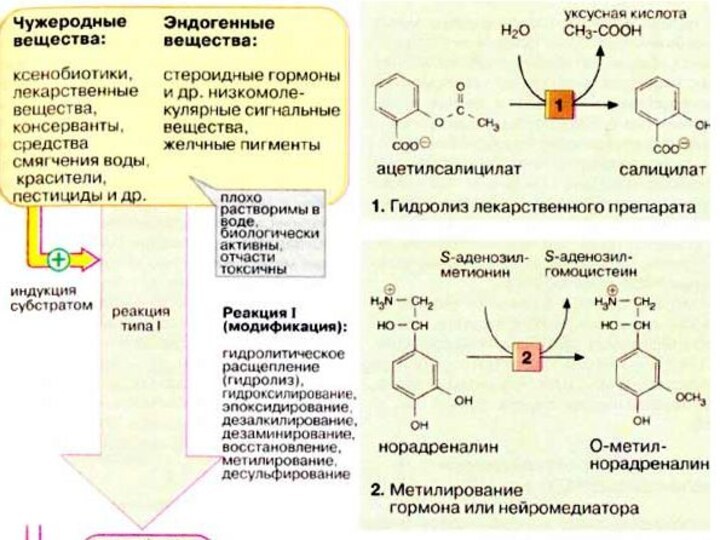
Реакция I (модификация). Реакции типа I осуществляются путем
введения в неполярную молекулу функциональных групп или модификации уже
имеющихся функциональных групп. Как правило, это влечет за собой увеличение полярности молекулы и уменьшение биологической активности или токсичности. Однако в ряде случаев чужеродные вещества (некоторые лекарственные вещества и канцерогены) приобретают биологическую активность именно в результате подобного рода модификаций.
Слайд 62
К наиболее важным реакциям типа I относятся следующие:
—гидролитическое
расщепление (гидролиз) эфиров и пептидов, в качестве примера на
схеме приводится гидролиз болеутоляющего средства, ацетилсалициловой кислоты (1);
—реакции окисления: гидроксилирование, введение эпоксидной группы, образование сульфоксидов, дезалкилирование, дезаминирование;
—реакции восстановления: восстановление карбонильной группы, азо- или нитросоединений, дегалогенирование;
—метилирование: в качестве примера приводится инактивация катехоламина норадреналина (2) (см. с. 342);
—десульфирование.
Реакции протекают в гепатоцитах на гладком эндоплазматическом ретикулуме. Реакции окисления катализируются системой цитохрома Р450 (см. с. 310). Эта система "индуцибельна", т. е. ее активность возрастает в присутствии субстратов, после чего она может осуществлять метаболическую трансформацию различных субстратов. Исключение составляют субстратспецифичные ферменты стероидного обмена (см. с. 364).
Слайд 65
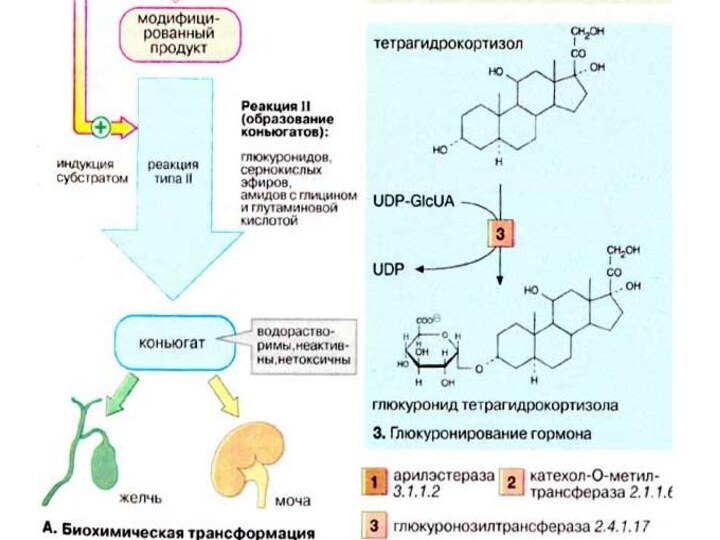
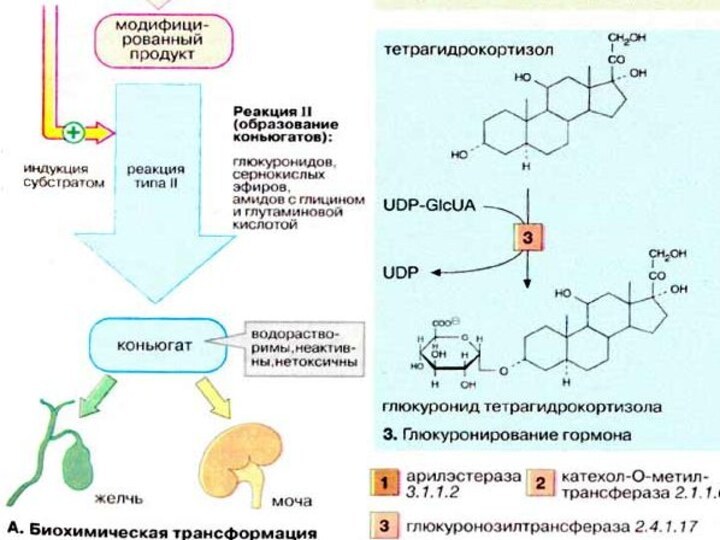
Реакция II (конъюгация). Реакции типа II заключаются в
связывании субстрата (билирубина, стероидного гормона, модифицированного ксенобиотика или лекарственного
вещества) с высокополярным соединением, несущим отрицательный заряд. Эти реакции катализируются исключительно трансферазами, а продукты реакции носят названия конъюгатов.
Чаще всего в качестве полярного соединения выступает глюкуроновая кислота (GlcUA), а продуктами реакции (конъюгатами) являются О- и N-глюкурониды. Коферментом в этих реакциях является уридиндифосфатглюкуроновая кислота (UDP-GlcUA), активная форма глюкуроновой кислоты (см. с. 112). Связывание с полярной молекулой глюкуроновой кислогы придает неполярным (гидрофобным) соединениям высокую растворимость, что облегчает их выведение из организма.
Слайд 66
Образование конъюгатов может осуществляться путем биосинтеза сернокислых эфиров
с участием фосфоаденозинфосфосульфата (3'-фосфо-5'-аденилилсульфата), поставляющего «активный сульфат» (см. с.
112), или путем образования амидов с глицином и глутамином.
По сравнению с исходными соединениями конъюгаты гораздо лучше растворимы в воде и легко экскретируются. Из печени конъюгаты выводятся рецепторзависимой экскрецией в желчные капилляры или попадают в кровь, откуда выводятся почками за счет фильтрации.
Дополнительная информация
Обезвреживание тяжелых металлов. В связывании и обезвреживании металлов (см. с. 350) принимает участие белок печени металлотионеин. Этот белок с высоким содержанием остатков цистеина обладает высоким сродством к ионам двухвалентных металлов, таким, как Cd2+, Cu2+, Hg2+ и Zn2+. Ионы таких металлов являются индукторами биосинтеза металлотионеина.
Слайд 67
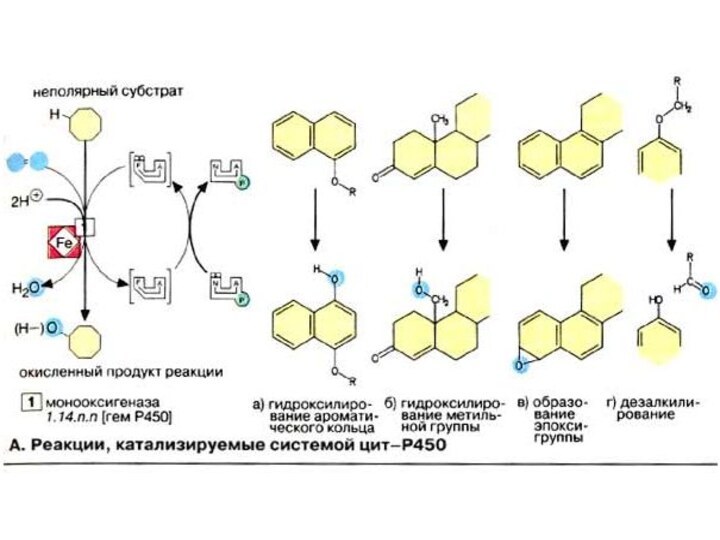
Система цитохрома Р450
На первой фазе биотрансформации менее реакционноспособные
соединения подвергаются ферментативному гидроксилированию. Такая модификация делает возможной последующую
конъюгацию с полярным веществом (см. с. 308). Вообще гидроксилирующие ферменты являются монооксигеназами, включающими в качестве кофермента железосодержащий гем (см. с. 108). Восстановленная форма гема связывает оксид углерода (СО) и приобретает характерное поглощение света при 450 нм. Поэтому такая группа ферментов носит название цитохромы Р450 (цитР450).
Система цитР450 принимает участие во многих процессах обмена веществ, например в биосинтезе стероидных гормонов (см. сс. 174, 364), желчных кислот (см. с. 306) и эйкозаноидов (см. с. 376), а также в образовании ненасыщенных жирных кислот (см. рис. 397).
Слайд 68
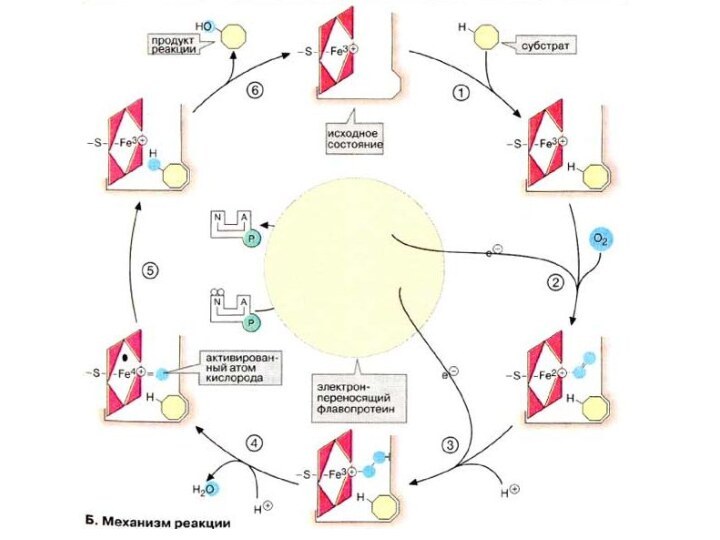
Реакции, катализируемые системой цитР450
ЦитР450-зависимые монооксигеназы катализируют расщепление веществ
разного типа с участием НАДФН и молекулярного кислорода (О2).
При этом один атом кислорода присоединяется к субстрату, а второй освобождается в составе молекулы воды. В реакции принимает участие флавопротеин, выполняющий функцию переносчика восстановительного эквивалента с кофермента НАДФН + Н+ на собственно монооксигеназу, которая переносит электроны на молекулярный кислород.
Слайд 69
В печени, а также в железах, продуцирующих стероидные
гормоны, и в других органах встречаются разные формы фермента
цитР450. Субстратная специфичность фермента печени невелика. Наиболее эффективно он катализирует окисление неполярных соединений с алифатическими или ароматическими кольцами. К ним относятся эндогенные субстраты организма, например стероидные гормоны, а также лекарственные вещества, инактивированные путем модификации. Превращение этилового спирта в печени также катализирует фермент цитР450 («микросомальная система окисления этанола», см. с. 312). Так как спирт и лекарственные вещества являются субстратами одной и той же ферментативной системы, их совместное воздействие на организм может быть опасным для жизни. Поэтому фермент цитР450 представляет особый интерес для фармакологии.
Слайд 72
МЕТАБОЛИЗМ ЭТАНОЛА
Содержание этанола в напитках
Поступление и всасывание
Метаболизм
Слайд 73
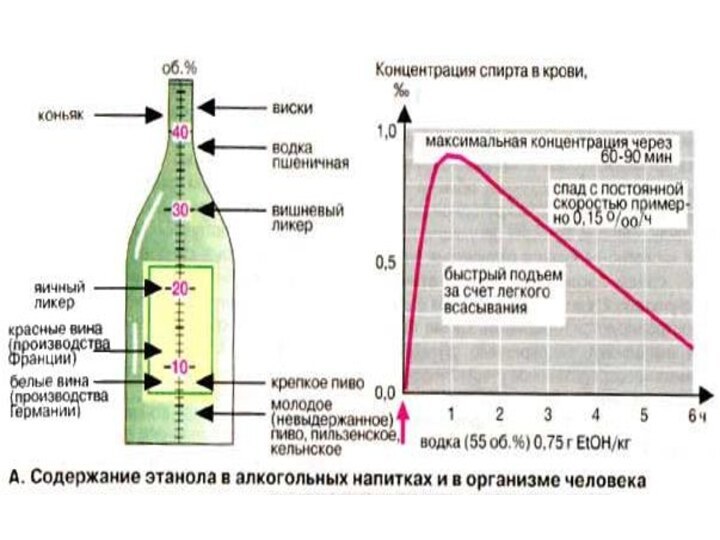
Содержание этанола в алкогольных напитках и в организме
человека
Следы этанола (EtOH, этиловый спирт) можно обнаружить во фруктах.
В алкогольных напитках этанол присутствует в существенно более высоких концентрациях. Содержание этанола принято указывать в объемных процентах. Нормы потребления этанола и концентрацию в крови целесообразно давать в граммах (плотность этанола 0,79 кг/л). Например, в одной бутылке пива (0,5 л, 4% EtOH) содержится 20 мл = 16 г этанола, в одной бутылке вина (0,7 л, 12% EtOH) — 84 мл = 66 г этанола.
Слайд 74
После поступления в организм этанол быстро всасывается за
счет диффузии; максимальная концентрация в крови достигается спустя 60-90
мин. Кроме того, скорость всасывания зависит от самых разных факторов. Так, пустой желудок, высокая температура напитка (например, грога), наличие сахара и углекислоты (например, в шампанском) стимулируют всасывание этанола. Напротив, всасывание этанола замедлено при обильной трапезе. В организме этанол очень быстро распределяется, поступая преимущественно в мышцы и мозг, существенно меньше в жировую и костную ткани, т. е. в ткани и органы, которые составляют примерно 70% общей массы тела. При быстром и полном всасывании этанола, содержащегося в одной бутылке пива (16 г), и массе тела 70 кг (этанол поступает в ткани организма, масса которых составляет 70 г х 0,7= 49 кг) в крови создается концентрации 16 г/49 кг = 0,33 промилле (7,2 мМ). Летальная концентрация составляет примерно 3,5 промилле (76 мМ).
Слайд 76
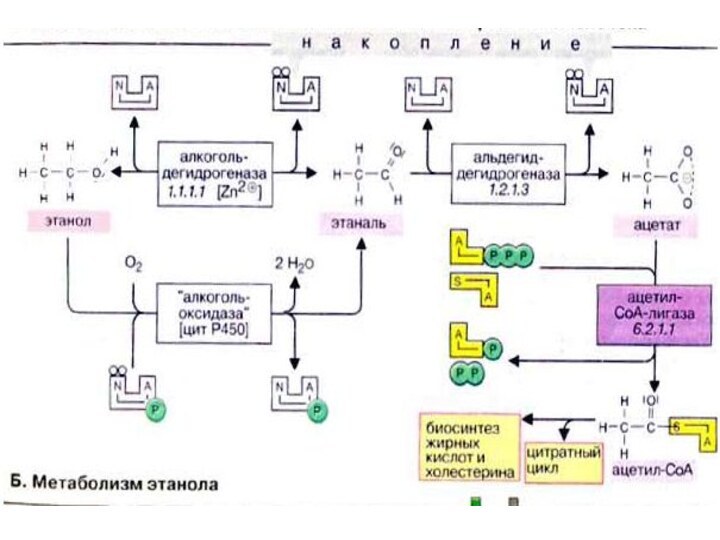
Метаболизм этанола
Основным местом метаболической трансформации этанола является печень,
в этом процессе может также принимать участие эпителий желудка.
Этанол дегидрируется алкогольдегидрогеназой в этаналь (ацетальдегид), а затем альдегиддегидрогеназой переводится в ацетат. Уксусная кислота в реакции, катализируемой ацетат-КоА-лигазой (тиокиназой) в присутствии АТФ, превращается в ацетил-КоА (ацетил-СоА). Следует отметить, что весь процесс промежуточного метаболизма хорошо согласован. Наряду с цитоплазматической алкогольдегидрогеназой в метаболизме этанола принимают ограниченное участие каталаза и "индуцибельная" микросомальная алкогольоксидаза
Слайд 77
Скорость трансформации этанола в печени лимитируется главным образом
активностью алкогольдегидрогеназы. Другим лимитирующим фактором является наличие НАД+. Максимальная
скорость реакции наблюдается даже при небольших концентрациях этанола. Поэтому уровень этанола в организме понижается с постоянной скоростью (расщепление этанола — реакция нулевого порядка).
Слайд 78
«Энергетическая ценность» этанола составляет 29,4 кДж/г (7 ккал/г).
Поэтому алкогольные напитки обеспечивают организм значительной частью энергоресурсов (особенно
при алкоголизме).
Хотя исследование механизма действия этанола на организм представляется крайне актуальным, этот вопрос все еще остается недостаточно изученным. Вместе с тем действие больших количеств этанола напоминает действие наркотика, что можно объяснить прямым воздействием этанола на мембраны нейронов.
Слайд 80
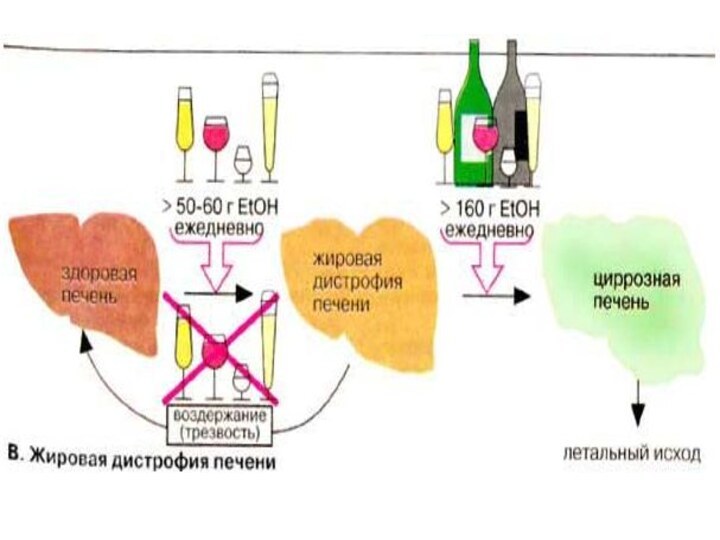
Жировая дистрофия печени
Предельная норма этанола для здорового человека
при ежедневном приеме составляет 60 г для мужчин и
50 г для женщин. Эта величина зависит от массы, состояния здоровья, а также от приема лекарственных препаратов. Повышенное потребление этанола в течение года вызывает заболевание печени. Из-за высокого уровня НАДН и ацетил-КоА, вызванных приемом этанола, в печени тормозится цитратный цикл и кетогенез, нарушается биосинтез нейтральных жиров и холестерина, наблюдается повышенное отложение жира (жировая дистрофия). Отложение жира (от 5 до 50% по сухой массе) чаще всего процесс обратимый. При гибели гепатоцитов из-за хронического алкоголизма наступает фиброз печени (избыточное развитие соединительной ткани). При циррозе печени заболевание переходит в необратимую форму, для которой характерно прогрессирующее отключение функций печени.