Слайд 2
Определение и факты
Оксид — бинарное соединение химического элемента с кислородом в степени окисления
−2, в котором сам кислород связан только с менее электроотрицательным элементом.
Весьма
распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще.
Оксидами называется класс минералов, представляющих собой соединения металла с кислородом
Слайд 3
Определение и факты
Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд
красителей.
Ржавчина - Fe(OН)3
Песок - SiO2
Вода -
H2O
Слайд 4
Номенклатура
Оксиды называют словом «оксид», после которого следует наименование
химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид
алюминия.
Если элемент имеет переменную степень окисления, то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия, например, Cu2О — оксид меди(I), CuO — оксид меди(II).
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д.
Слайд 5
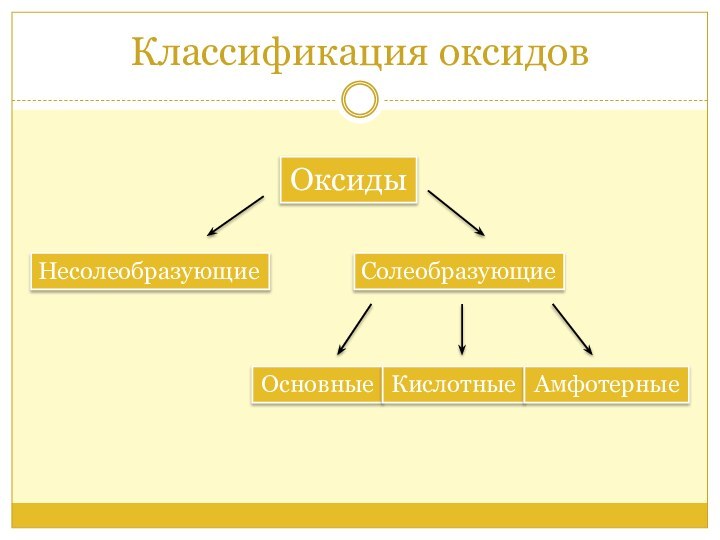
Классификация оксидов
Оксиды
Солеобразующие
Несолеобразующие
Слайд 6
Основные оксиды
Основные оксиды – это сложные химические вещества,
относящиеся к окидам, которые образуют соли при химической реакции
с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами.
Примеры: K2О, CaO, FeO
Слайд 7
Химические свойства основных оксидов
Взаимодействие с водой с образованием
основания (или щёлочи)
CaO+H2O = Ca(OH)2
Взаимодействие с кислотами с образованием
соли и воды (раствор соли в воде)
CaO+H2SO4 = CaSO4+ H2O
Взаимодействие с кислотными оксидами: образование соли
CaO+CO2= CaCO3
Слайд 8
Физические свойства основных оксидов
Образованы металлами с низким значением
степени окисления (+1, +2), например Nа2О, K2O, CaO, MgO.
Все
основные оксиды – твердые вещества.
CaO
K2О
Слайд 9
Кислотные оксиды
Кислотные оксиды - это сложные химические вещества,
относящиеся к окислам, которые образуют соли при химическом взаимодействии
с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Примеры: CO2 , P2O5 , SO3
Слайд 10
Химические свойства кислотных оксидов
Взаимодействие с водой с образованием
кислоты:
CO2 + H2O = H2CO3
Взаимодействие с
щелочами с образованием соли и воды:
SO2 + NaOH = Na2SO3 + H2O
Взаимодействие с основным оксидом с образованием соли:
CO2 + CaO = CaCO3
Слайд 11
Химические свойства кислотных оксидов
Если кислотный оксид является ангидридом многоосновной кислоты,
возможно образование кислых или средних солей:
Ca(OH)2
+ CO2 = CaCO3↓+ H2O
CaCO3 + H2O + CO2 = Ca(HCO3)2
Взаимодействие нелетучего оксида с солью с образованием новой соли и летучего оксида:
SiO2 + Na2CO3 = Na2SiO3 + CO2
Взаимодействие ангидрида кислоты с безводной кислородосодержащей кислотой:
2P2O5 + 4HClO4 = HPO3 + Cl2O7
Слайд 12
Физические свойства кислотных оксидов
Агрегатное состояние различное: твердое (Р2О5),
жидкое (SO3), газообразное (СО2).
Все кислотные оксиды, кроме SiO2, растворимы
в воде.
Имеют различный цвет.
Br2O
CrO3
Слайд 13
Способы получения оксидов
Взаимодействие простых веществ (за исключением инертных
газов, золота и платины) с кислородом:
2H2 +
O2 = 2H2O
2Cu + O2 = 2CuO
При горении в кислороде щелочных металлов (кроме лития), а также стронция и бария образуются пероксиды инадпероксиды:
2Na + O2 = Na2O2
K + O2 = KO2
Слайд 14
Способы получения оксидов
Обжиг или горение бинарных соединений в кислороде:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Cs2
+ 3O2 = CO2 + SO2
2PH3 + 4O2 = P2O5 + 3H2O
Термическое разложение солей:
CaCO3 = CaO + CO2
2FeSO4 = Fe2O3 + SO2 + SO3
Термическое разложение оснований или кислот:
2Al(OH)3 = Al2O3 + 3H2O
4HNO3 = 4NO2 + O2 + 2H2O
Слайд 15
Способы получения оксидов
Окисление низших оксидов в высшие и
восстановление высших в низшие:
4FeO + O2 =
2Fe2O3
Взаимодействие некоторых металлов с водой при высокой температуре:
Zn + H2O = ZnO + H2
Взаимодействие солей с кислотными оксидами при сжигании кокса с выделением летучего оксида:
Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5Ca
Слайд 16
Способы получения оксидов
Взаимодействие металлов с кислотами-оксилителями:
Zn +
4HNO3 = Zn(NO3)2 + 2NO2↑ + 2H2O
При действии водоотнимающих
веществ на кислоты и соли:
2KClO4 + H2SO4 = K2SO4 + Cl2O7 + H2O
Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами:
NaHCO3 + HCl = NaCl + H2O + CO2↑