- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Виды генной терапии
Содержание
- 2. ГенотерапияЛечение заболеваний с помощью генов получило название
- 3. Разработке программы генной терапии предшествуют тщательный анализ
- 4. Апробацию процедуры генокоррекции наследственного заболевания проводят на
- 5. В генотерапии используют два основных подхода, различающихся
- 6. Фетальная генотерапия
- 7. При этом виде терапии генетическую конструкцию вводят
- 8. При эмбриональной генной терапии доставка терапевтического гена
- 9. Подобные манипуляции широко используются в клинике и почти полностью безопасны для зародыша и матери.
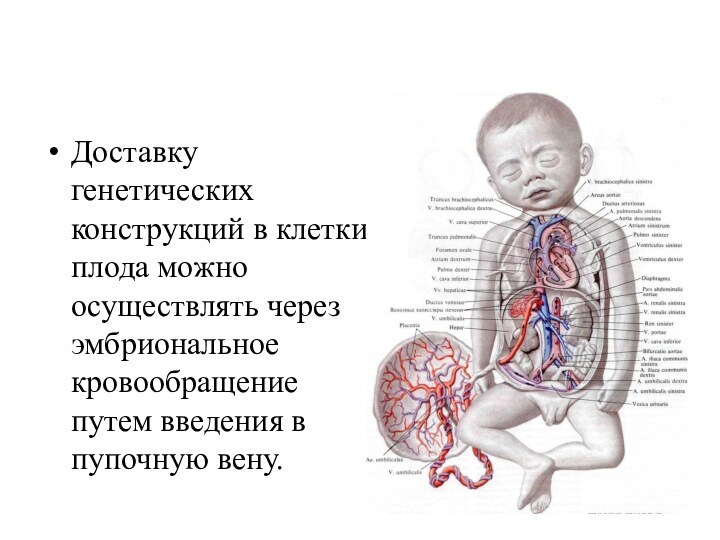
- 10. Доставку генетических конструкций в клетки плода можно
- 11. В настоящее время уже введена в клинику
- 12. Большинство методов фетальной генотерапии разработаны на трансгенных
- 13. Затем яйцеклетки имплантировали в матку приемной матери.
- 14. В подобных экспериментах была получена важная информация
- 15. Более того, из-за случайного встраивания чужеродной ДНК
- 16. Таким образом, фетальная генотерапия пока недостаточно разработана
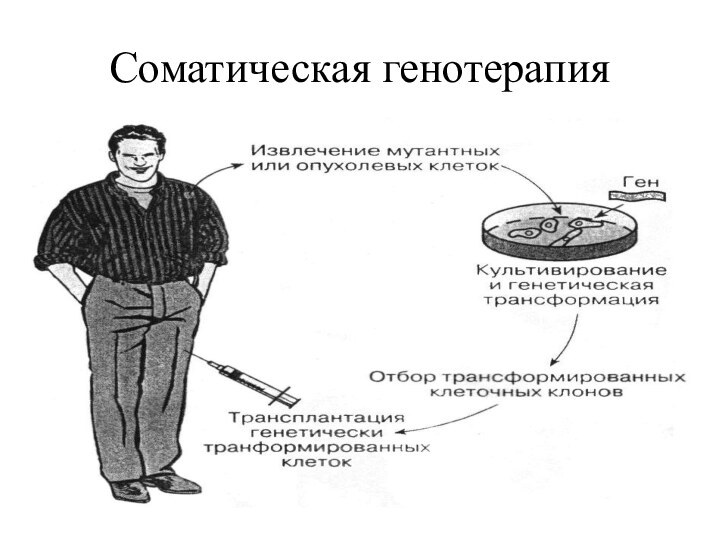
- 17. Соматическая генотерапия
- 18. При данном подходе генетический материал вводят только в соматические клетки, и он не передается половым клеткам.
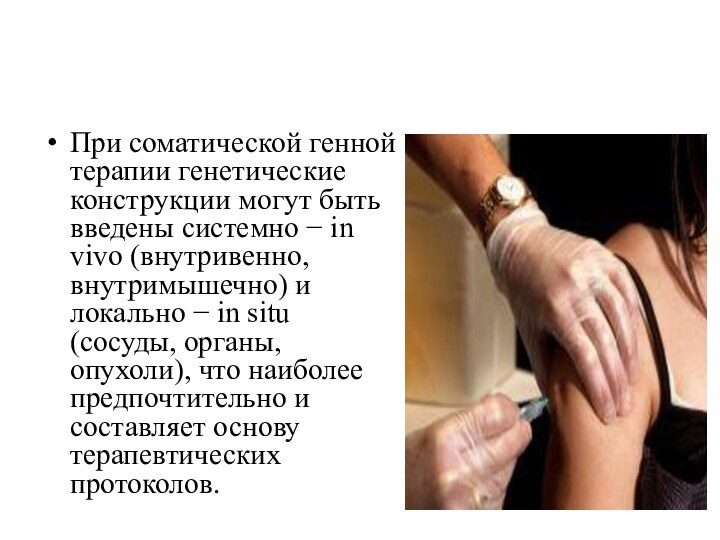
- 19. При соматической генной терапии генетические конструкции могут
- 20. Скачать презентацию
- 21. Похожие презентации
ГенотерапияЛечение заболеваний с помощью генов получило название генотерапии. Сейчас в мире насчитывается порядка 400 проектов, посвященных лечению с помощью генотеропии.