- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по гистологии по теме Гистотехника
Содержание
- 2. Организация и оснащение патогистологической лабораторииРабочие помещения:Комната для вырезки материала (секционного, биопсийного, экспериментального)Рабочая комната для лаборантовАппаратурнаяМоечная
- 3. Современное оборудованиеМикротомысанныйротационныйКриостат
- 4. ГистобаняДиспенсерТермостаты на 37°С и 58°С
- 5. Аппарат гистологической обработки (проводки) тканей.Станция для заливки в парафинТканевый гистологический процессор закрытого типа
- 6. УЧЕТНАЯ ДОКУМЕНТАЦИЯ Правильное ведение учетной документации позволяет
- 7. Основные этапы приготовления гистологического препаратавзятие материала;фиксация;обезвоживание и уплотнение;заливка;приготовление срезов;окрашивание;заключение срезов.
- 8. Основные требования при взятии материалаСвежесть биоматериалаМинимальное травмированиеСоблюдение
- 9. Разновидности биопсии: эксцизионная – забор материала проводится иссечением
- 10. Техника вырезания материала.Биопсийный материал S=2-3 см, толщина
- 11. Общие принципы фиксацииРезультат зависит от:рН фиксатораКонцентрации фиксатораТемпературыПродолжительности
- 12. Правила фиксации Взятый из органа маленький образец
- 13. Правила фиксации Кусочки тонкостенных органов (кишечник, желудок)
- 14. Завершение фиксацииФиксация закончена, когда жидкость полностью пропитала
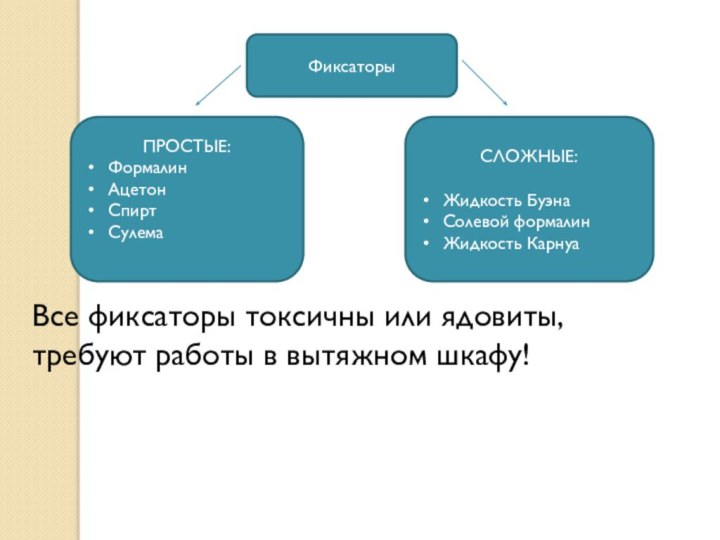
- 15. ФиксаторыПРОСТЫЕ:ФормалинАцетонСпиртСулемаСЛОЖНЫЕ:Жидкость БуэнаСолевой формалинЖидкость КарнуаВсе фиксаторы токсичны или ядовиты, требуют работы в вытяжном шкафу!
- 16. Виды фиксаторовПростые фиксаторы:формалин (наиболее распространенная и универсальная
- 17. Виды фиксаторовПростые фиксаторы:этанол (96%) – спирт обладает
- 18. Виды фиксаторовСложные фиксирующие жидкости: Спирт-формалинжидкость Буэна (для
- 19. Декальцинация Используют для костной ткани. Проводят для
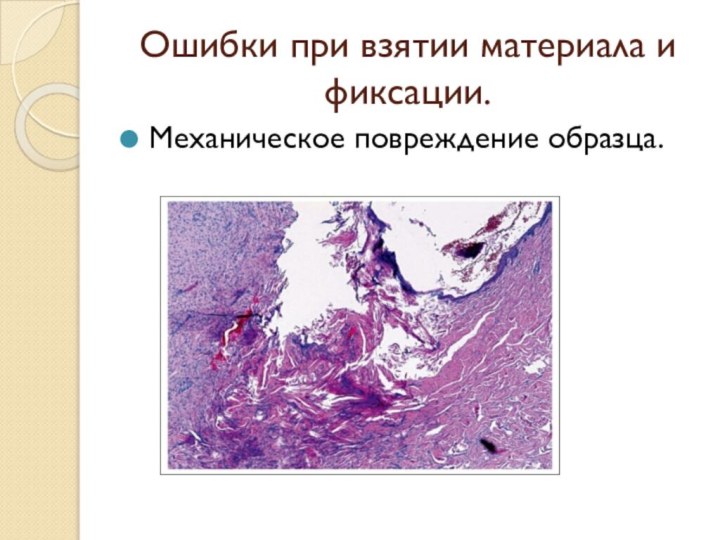
- 20. Ошибки при взятии материала и фиксации.Механическое повреждение образца.
- 21. Ошибки при взятии материала и фиксации.Охлаждение материала.
- 22. Высыхание ткани без фиксатора
- 23. Помарки на флаконах или контейнерах
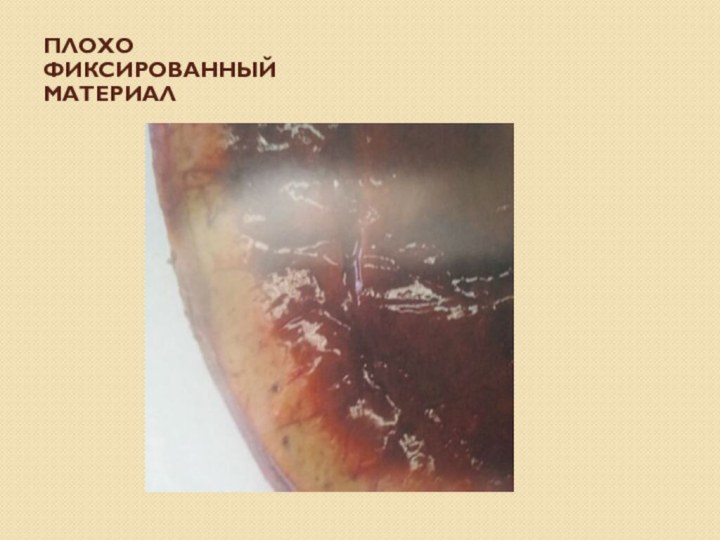
- 24. плохо фиксированный материал
- 25. Формалиновый пигмент Пигмент проявляется в виде чёрных
- 26. Замена формалина на чистый
- 27. Большой кусочек при вырезке
- 28. Промывание объектаНекоторые фиксаторы закрепляют структуру объекта, но
- 29. Обезвоживание материалаЦЕЛЬ – удаление воды для подготовки
- 30. Недостаточное обезвоживание
- 31. Заливка материала.В большинстве случаев зафиксированный и обезвоженный
- 32. Заливка материала.Промежуточные среды для заливки материала:ХлороформКсилолБензолТолуолГексан и
- 33. Заливка материала.ПарафинЦеллоидинСрезы тонкие, пригодные для световой микроскопии
- 34. Схема заливки в парафин Кусочек ткани проводят
- 35. Кассеты для заливки в парафин
- 36. Ошибки при заливкеВытекание парафина из кассетыНеадекватно подобранная кассета
- 37. Ошибки при заливкеПреждевременное застывание парафинаНераспределённый парафин
- 38. Изготовление срезов и монтировка на стеклоПриготовление срезов происходит
- 39. Расплавление срезов на водяной бане
- 40. Монтаж среза на стекло
- 41. Ошибки при резке (разрыв ткани)
- 42. Повреждение среза дефектом ножа
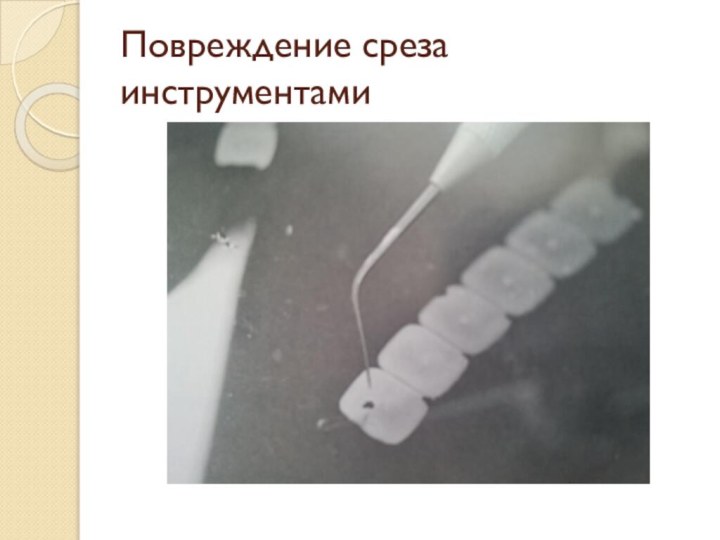
- 43. Повреждение среза инструментами
- 44. ДепарафинизацияЦЕЛЬ – удаление парафина для последующего восприятия
- 45. Неполная депарафинизация
- 46. Окрашивание препаратовОкрашивание срезов (в световой микроскопии) или напыление
- 48. Обзорное окрашиваниеГистохимические окрашиванияГематоксилин-эозинГематоксилин ЭрлихаЖелезный гематоксилин ГейденгайнаЖелезный гематоксилин
- 49. Прогрессивное окрашивание - это процесс при котором
- 50. Правила окрашивания: Перед применением красители необходимо их
- 51. Окрашивание гематоксилином и эозином. Окраска гематоксилин и
- 52. Окраска гематоксилин-эозин (общий фон умеренно розовато-желтого цвета, ядра четко контурируются)
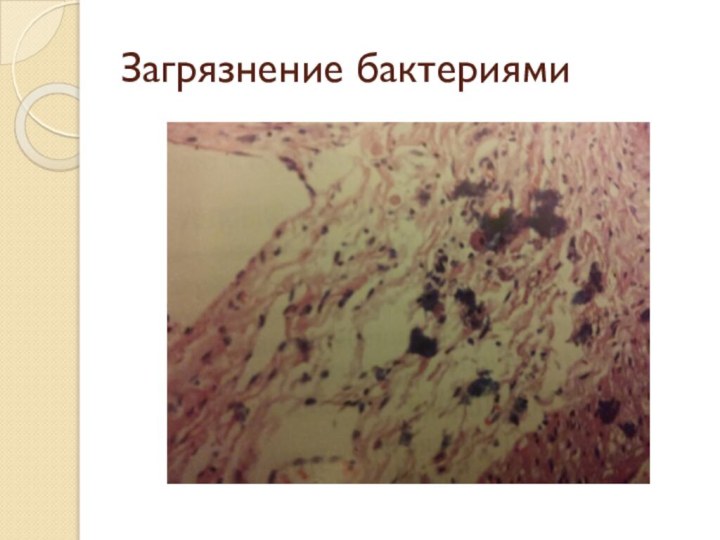
- 53. Загрязнение бактериями
- 54. Перекрашивание среза
- 55. Дегидратация ЦЕЛЬ – обезвоживание окрашенного препарата и
- 56. Капельки воды в ткани
- 57. Правила заключения срезов в оптически-прозрачную среду ЦЕЛЬ
- 58. Заключение окрашенного среза в бальзам
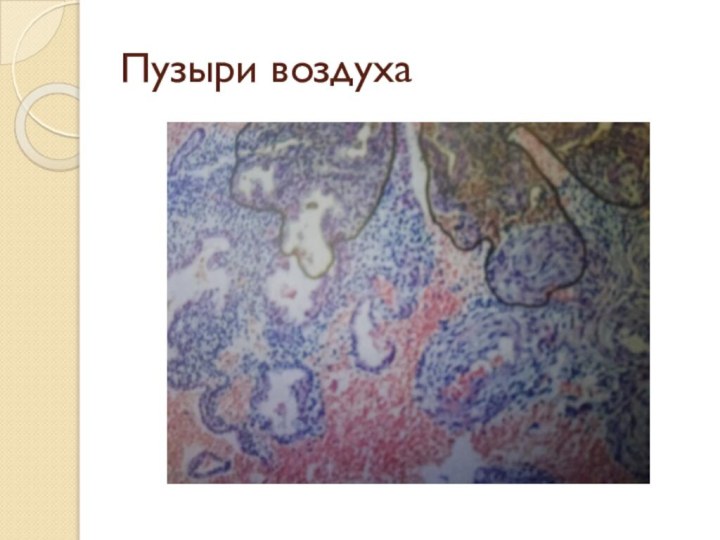
- 59. Пузыри воздуха
- 60. Методика окраски Г+ЭДепарафинирование срезов и помещение их
- 61. Методы проведения анализа Методы гистологического исследования различаются
- 62. АрхивированиеВ патолого-анатомическом бюро (отделении) формируется архив, который
- 63. Сроки хранения в архиве патолого-анатомического бюро (отделения)
- 64. Выдача микропрепаратов, тканевых образцов в парафиновых блоках
- 65. Порядок сроков хранения и выдачи патологоанатомической документации.Протоколы
- 66. Утилизация Большая часть отходов ПАО относится к
- 67. Порядок сроков хранения, выдачи и утилизации аутопсийного
- 68. Основные ошибки гистологической техники и дефекты, появляющиеся
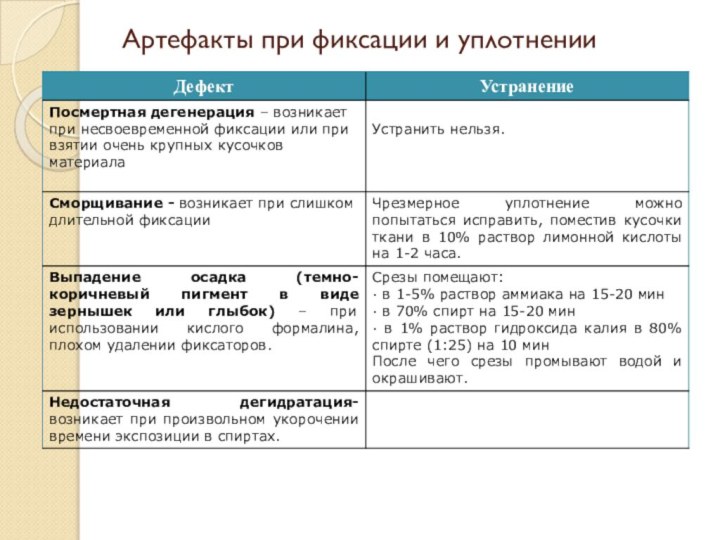
- 69. Артефакты при фиксации и уплотнении
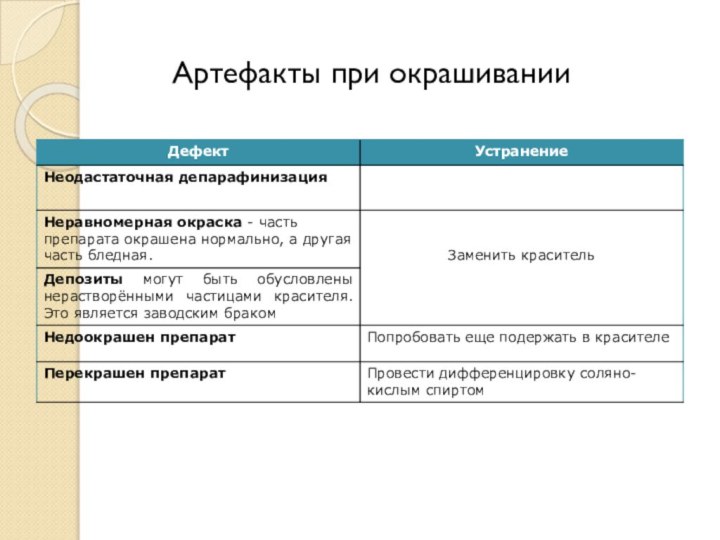
- 70. Артефакты при изготовлении срезов
- 71. Скачать презентацию
- 72. Похожие презентации
Организация и оснащение патогистологической лабораторииРабочие помещения:Комната для вырезки материала (секционного, биопсийного, экспериментального)Рабочая комната для лаборантовАппаратурнаяМоечная
























































Слайд 2
Организация и оснащение патогистологической лаборатории
Рабочие помещения:
Комната для вырезки
материала (секционного, биопсийного, экспериментального)
Слайд 5
Аппарат гистологической обработки (проводки) тканей.
Станция для заливки в
парафин
Тканевый гистологический процессор закрытого типа
Слайд 6
УЧЕТНАЯ ДОКУМЕНТАЦИЯ
Правильное ведение учетной документации позволяет сотрудникам
патогистологической лаборатории эффективно использовать рабочее время и облегчает работу
с архивным материалом.К документации, ведение которой является обязательным, относятся:
алфавитный журнал для регистрации биопсийного и операционного материала;
журнал регистрации выдачи биопсийного;
журнал регистрации секционного материала;
направления на патогистологическое исследование.
У старшего лаборанта должны быть:
книги учета спирта,
книга учета медикаментов
книга учета химических реактивов, по которому легко находят нужный для работы реактив.
Слайд 7
Основные этапы приготовления гистологического препарата
взятие материала;
фиксация;
обезвоживание и уплотнение;
заливка;
приготовление
срезов;
окрашивание;
заключение срезов.
Слайд 8
Основные требования при взятии материала
Свежесть биоматериала
Минимальное травмирование
Соблюдение правил
сохранения при доставке
Адекватная фиксация
Виды гистологического материала:
Прижизненный (биопсийный) материал
2.
Трупный (аутопсийный) материал.
Слайд 9
Разновидности биопсии:
эксцизионная – забор материала проводится иссечением при
оперативном лечении всего патологического образования, или органа;
инцизионная – иссечение
части патологического образования или органа;пункционная – забор материала для исследования путем прокола органа или ткани иглой;
аспирационная – забор материала тонкой иглой путем отсасывания из органов и образований, имеющих полости, заполненные содержимым;
трепан-биопсия – при помощи специальной толстой иглы этим способом проводится забор костных материалов;
щипцевая – материал собирается «скусыванием» из органов и тканей (при гастросокпии, колоноскопии и т.д.);
путем кюретажа – внутренних стенок (матки, полостей).
Слайд 10
Техника вырезания материала.
Биопсийный материал S=2-3 см, толщина 7
мм (секционный материал может быть объемнее)
Вырезанный кусочек погружают сразу
в фиксатор (операционный материал сразу помещают в бюкс, смачивают поверхность физ. раствором и срочно доставляют в лабораторию)Маркировка (этикетка) сопроводительная в бюксе или в фиксаторе.
Кусочки вырезают на границе нормальной и измененной ткани
Сосуды сворачивают в трубочку «рулон»
Полые органы (кишечник, желчный пузырь, вена и др.) в ванночке с фиксатором фиксируют булавками
Легкие погружают в фиксатор с «грузилом»
Кусочки органов вырезают только острым ножом или бритвой
Нельзя сдавливать кусочки, скоблить или протирать их поверхность
Головной мозг из области черепа извлекают очень аккуратно, без давления на те области, которые необходимы для гистологического исследования
Недопустимо обмывание кусочков водой перед фиксацией, если отмыть материал от крови используют изотонический раствор хлорида натрия или раствор Рингера.
Слайд 11
Общие принципы фиксации
Результат зависит от:
рН фиксатора
Концентрации фиксатора
Температуры
Продолжительности фиксации.
Обеспечивает
стабилизацию тканевых структур и их уплотнение.
Под действием фиксатора
в тканях и органах происходят сложные физико-химические изменения. Наиболее существенным из них является процесс необратимой коагуляции белков, вследствие которого жизнедеятельность прекращается, а структуры становятся мертвыми, фиксированными. Фиксация приводит к уплотнению и уменьшению объема кусочков, а также к улучшению последующей окраски клеток и тканей. Выбор фиксатора зависит от задачи исследования (например, при выявлении гликогена объекты фиксируются в этаноле, а не в формалине).
Слайд 12
Правила фиксации
Взятый из органа маленький образец либо
погружают в фиксатор, либо подвергают термической обработке.
Толщина кусочков не
должна превышать 4-5мм.Объем фиксирующей жидкости должен превышать объем кусочков не менее чем в 10 раз.
Кусочки в фиксаторе не должны слипаться и прилипать ко дну емкости (фильтровальная бумага на дно, повесить объект на нитке)
При фиксации в формалине не желательно охлаждение, т.к. замедляется проникновение фиксатора в ткани.
Проводят фиксацию обычно при комнатной температуре.
Слайд 13
Правила фиксации
Кусочки тонкостенных органов (кишечник, желудок) и
оболочки (мозговые, серозные) перед фиксацией надо растянуть и закрепить
нитками на картоне, пробке или тонкой дощечке.Кусочки легкого помещают в фиксатор завернув его в марлю с грузиком.
Фиксатор не используют повторно.
Слайд 14
Завершение фиксации
Фиксация закончена, когда жидкость полностью пропитала объект.
При завершении фиксации ткань имеет равномерную окраску и одинаковую
консистенцию на поверхности разреза.
Слайд 15
Фиксаторы
ПРОСТЫЕ:
Формалин
Ацетон
Спирт
Сулема
СЛОЖНЫЕ:
Жидкость Буэна
Солевой формалин
Жидкость Карнуа
Все фиксаторы токсичны или ядовиты,
требуют работы в вытяжном шкафу!
Слайд 16
Виды фиксаторов
Простые фиксаторы:
формалин (наиболее распространенная и универсальная жидкость,
хорошо проникает в ткани и может применяться для фиксации
крупных объектов, подходит для консервации органов.)В чистом виде представляет 40% раствор формальдегида. Применяется в виде 10-20% водного раствора. Ткани пропитываются формалином со скоростью до 1мм/ч (при толщине не более 0,5см). Время фиксации формалином не меньше 24 часов при комнатной температуре для объектов толщиной от 1 мм до 5 мм, а для объектов 5-7 мм - 48-72 часа
Хранение формалина в темной плотно закрывающейся стеклянной посуде при температуре не ниже 9 градусов.
Формалин сильно раздражает слизистые! Работа в перчатках!
Чаще материал в лабораторию приходит уже в формалине. Но материал заливается свежей порцией формалина.
Слайд 17
Виды фиксаторов
Простые фиксаторы:
этанол (96%) – спирт обладает меньшей
проницаемой способностью, чем формалин (кусочки не более 0,5см). Пригоден
для гистохимических исследований.Под кусочки ткани обязательно слой ваты.
Время фиксации: для тонких пленок 15-30 мин., для кусочков толщиной 3-4мм – 2-4 часа.
Слайд 18
Виды фиксаторов
Сложные фиксирующие жидкости:
Спирт-формалин
жидкость Буэна (для фиксации
всех тканей кроме ткани почки)
жидкость Карнуа (применяется при быстрой
фиксации и ускоренной проводки – хорошо сохраняет структуру ядра клетки)этанол – уксусная кислота и метанол – уксусная кислота (для объектов, в которых планируется выявлять аргентофильные белки ядрышкового организатора)
Фиксаторы, содержащие сулему: В5, жидкость Ценкера, Максимова, Гелли и «Суза» Гейденгайна
Слайд 19
Декальцинация
Используют для костной ткани. Проводят для
полной фиксации ткани, при этом необходима тщательная промывка материала
1-3 часа в слабощелочных растворах.Объем декальцинирующей жидкости должен превышать объем объекта в 10-20 раз.
Твердые компоненты, имеющиеся в ткани (кость, хитин, отложения извести и др.), размягчают воздействием кислот или с помощью постоянного электрического тока — так называемая электролитическая декальцинация и после удаления из ткани кислоты приступают к изготовлению препаратов.
Слайд 21
Ошибки при взятии материала и фиксации.
Охлаждение материала. Как
нагрев, так и охлаждение приводит к повреждению тканей. Ткани
не фиксированные не следует охлаждать и тем более, замораживать. Медленно замерзая в клетках, начинают образовываться кристаллы воды, которые рвут стенки клеток.Высушивание ткани. Не стоит откладывать фиксацию после операции или аутопсии. Поскольку на воздухе материал высыхает, обветривается и начинает разлагаться.
Слайд 25
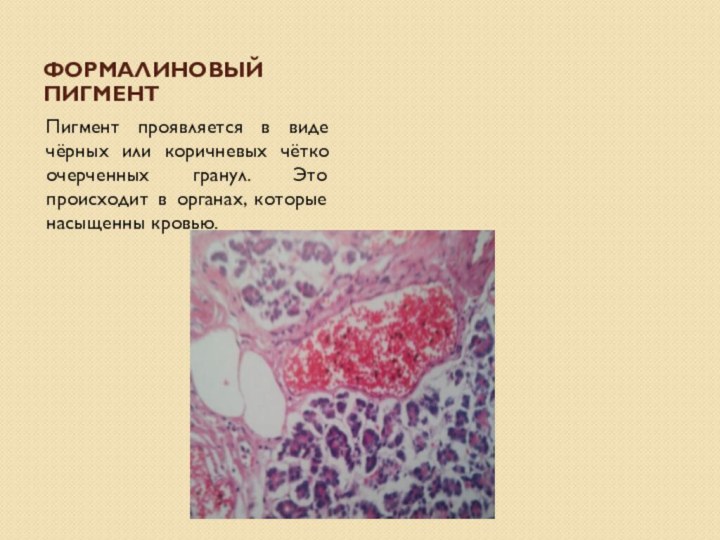
Формалиновый пигмент
Пигмент проявляется в виде чёрных или
коричневых чётко очерченных гранул. Это происходит в органах, которые
насыщенны кровью.
Слайд 28
Промывание объекта
Некоторые фиксаторы закрепляют структуру объекта, но мешают
другим процедурам приготовления препаратов или образуют осадки, поэтому должны
быть удалены из материала. Промывание обычно проводят в дистиллированной воде или в фосфатных буферах с определенными значениями рН. Промывают в проточной воде до 24 ч и подсушивают на фильтровальной бумаге.
Слайд 29
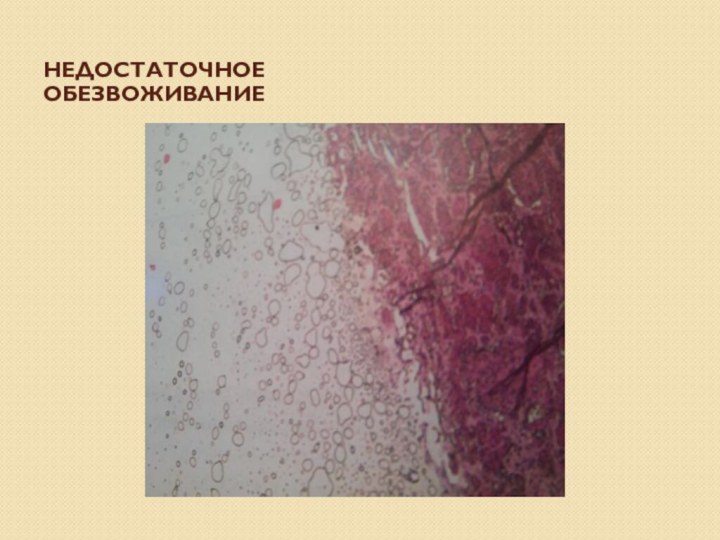
Обезвоживание материала
ЦЕЛЬ – удаление воды для подготовки материала
к пропитке с последующей резкой на различных микротомах.
Используют батарею
спиртов восходящей концентрации, начинающейся с 50-80% этанола до абсолютного этанола (ацетон, изопропанол, диоксан). Нельзя сразу после промывки помещать материал в 96% спирт. Продолжительность пребывания объектов обусловлена размерами кусочков и задачами исследования. Продолжительность процесса обезвоживания в спиртах в среднем 48 ч.
При обезвоживании по спиртовой батарее вручную их осторожно промокают фильтровальной бумагой или салфеткой из марли, что позволяет реже менять спирты в батарее.
Спирты не должны быть мутными. Нельзя долго повторно использовать.
Слайд 31
Заливка материала.
В большинстве случаев зафиксированный и обезвоженный объект
все же остается мягким и нежным. Из такого материала
сделать тонкие срезы невозможно. Поэтому его необходимо пропитать затвердевающими веществами.Фиксированную ткань обезвоживают и пропитывают одним из этих веществ, проводя ее через промежуточный растворитель.
Слайд 32
Заливка материала.
Промежуточные среды для заливки материала:
Хлороформ
Ксилол
Бензол
Толуол
Гексан и др.
ЗАЛИВКА
может быть в:
Парафин
Целлоидин
Желатин
Пропитку парафином проводят в термостате с температурой
58°С.Все более широкое применение находят для заливки тканей синтетические смолы (аралдит, эпон и другие), особенно при изготовлении срезов для электронной микроскопии.
Слайд 33
Заливка материала.
Парафин
Целлоидин
Срезы тонкие, пригодные для световой микроскопии срезы
(от 5—8 мкм и до 1—2 мкм).
Можно сделать
серии срезовБыстрая заливка
Действие высокой температуры
Нужно удалять его из среза
Срезы легко режутся на микротоме и хорошо окрашиваются большинством красителей
Толщина их больше, чем у парафиновых срезов
Не нужно удалять его из среза
Нет воздействия высокой температуры на срез
Длительность заливки
Трудно сделать серии срезов
Слайд 34
Схема заливки в парафин
Кусочек ткани проводят через
ряд растворов:
смесь 100 % спирта и ксилола (1
: 1)ксилол (две порции)
смесь ксилола с парафином (1:1, при t° 37°)
в чистый парафин (две порции, при t° 55—56°).
Парафин быстро охлаждают, кусочек ткани с окружающим его парафином вырезают в виде так называемого блока.
Слайд 38
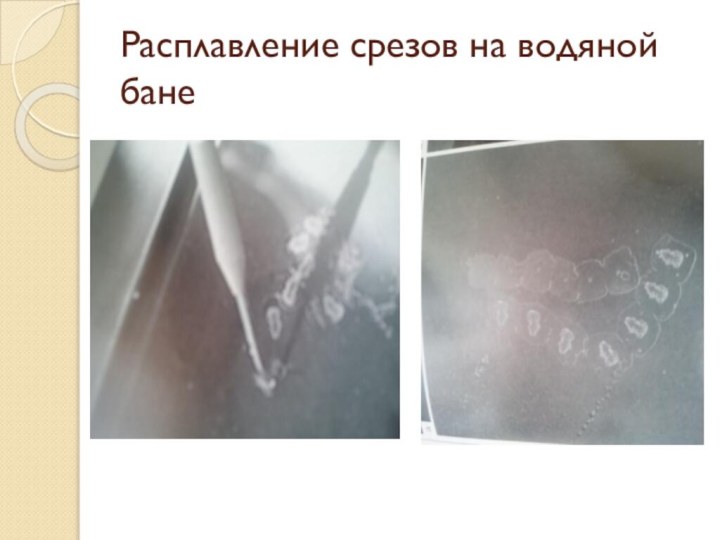
Изготовление срезов и монтировка на стекло
Приготовление срезов происходит на
специальных приборах — микротомах. В гистологической технике чаще всего употребляются
микротомы, которые делятся на санные, ротационные и замораживающие.Требования к изготовлению среза:
Получение тонких (5-6 мкм) срезов
Получение серийный срезов
Использование одноразовых лезвий или лезвий без дефектов
Срезы с ножа снимать препаровальными иглами
После снятия срезы помещают в водяную баню для расправления
Помещают срезы на воду (предметное стекло) обязательно поверхностью, прилежащей к ножу, определить которую можно по характерному блеску (верхняя сторона всегда матовая)
Монтировка среза на стекло под углом 45°
После расправления среза на стекле аккуратно удалить излишки воды фильтровальной бумагой
Высушить монтированные срезы на гистологическом столике с температурой 37°С
Перед наклеиванием срезов предметные стекла должны быть подготовлены (обезжирены) и быть обработаны специальными адгезивными средствами.
Слайд 44
Депарафинизация
ЦЕЛЬ – удаление парафина для последующего восприятия красителей
и для постановки гистохимических реакций.
Депарафинирование осуществляют в гистологических стаканчиках
(бюксах) или стеклянных кюветах с пазами для стёкол с плотно притёртыми крышками. Схема депарафинирования:
Ксилол I
Ксилол II
Абсолютный этанол
95% этанол
70 % этанол
Вода дистиллированная
После каждой кюветы стекло промокать фильтровальной бумагой.
Слайд 46
Окрашивание препаратов
Окрашивание срезов (в световой микроскопии) или напыление их
солями металлов (в электронной микроскопии) применяют для увеличения контрастности
изображения отдельных структур при рассматривании их в микроскопе.
Слайд 48
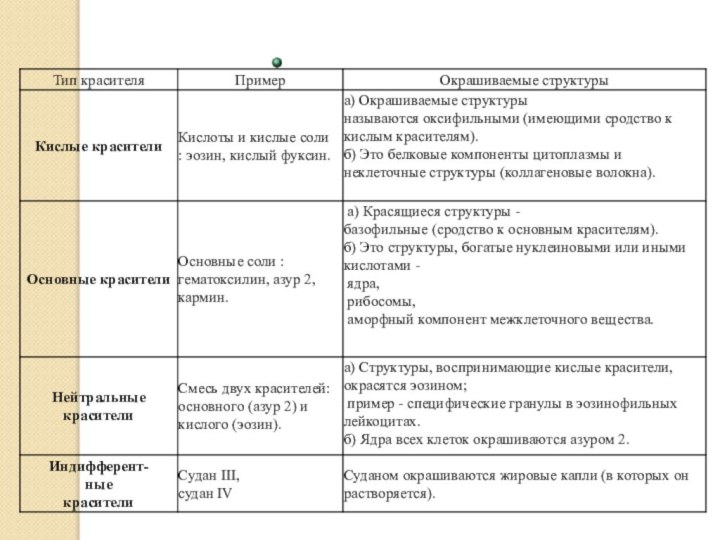
Обзорное окрашивание
Гистохимические окрашивания
Гематоксилин-эозин
Гематоксилин Эрлиха
Железный гематоксилин Гейденгайна
Железный гематоксилин Вейгерта
Квасцовый
кармин
Сафранин
Азур-2-эозин
Железный гематоксилин-пикрофуксин по Ван-Гизону
Специальные методы окраски для изучения
структур клеточного ядраМетоды окраски соединительной ткани
Методы окраски нервной ткани
Методы окраски костной ткани
Выявление включений амилоида
Выявление металлов
Выявление гемоглобинсодержащих пигментов
Выявление нейтрального жира
Выявление углеводов
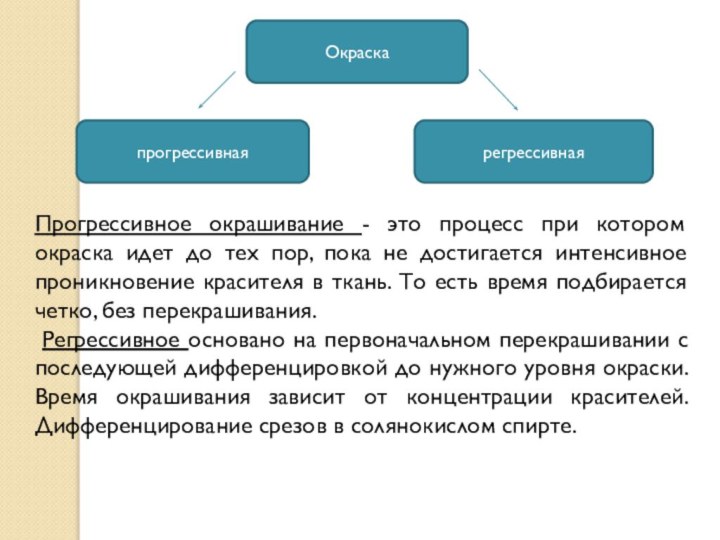
Слайд 49 Прогрессивное окрашивание - это процесс при котором окраска
идет до тех пор, пока не достигается интенсивное проникновение
красителя в ткань. То есть время подбирается четко, без перекрашивания.Регрессивное основано на первоначальном перекрашивании с последующей дифференцировкой до нужного уровня окраски. Время окрашивания зависит от концентрации красителей. Дифференцирование срезов в солянокислом спирте.
Окраска
прогрессивная
регрессивная
Слайд 50
Правила окрашивания:
Перед применением красители необходимо их профильтровать
При окрашивании
в течение длительного времени красителями низкой концентрации достигается лучшие
результаты, чем при окраске в течение короткого времени красителями высокой концентрацииБолее четкая окраска достигается регрессивным методом с дифференцировкой
После дифференцировки (под микроскопом)необходимо тщательно отмыть срез иначе дифференцирующее вещество быстро обесцветит препарат.
Слайд 51
Окрашивание гематоксилином и эозином.
Окраска гематоксилин и эозин
- наиболее распространенный метод окрашивания срезов.
Эта окраска является
двойной: гематоксилин - основной краситель - окрашивает ядра клеток (фиолетовый цвет), эозин - кислый краситель - красит цитоплазму клеток (розовый цвет) и в меньшей степени - различные неклеточные структуры. Гематоксилин представляет собой экстракт древесины кампешевого дерева, произрастающего в Америке.
Эозин - искусственная краска.
Растворы красителей должны быть приготовлены заранее.
Гематоксилин сам по себе не является красящим веществом. Для того чтобы приготовить краску, гематоксилин подвергают окислению, в результате чего он превращается в красящее вещество - гематеин. В соединении с некоторыми солями гематеин дает четкое окрашивание ядер.
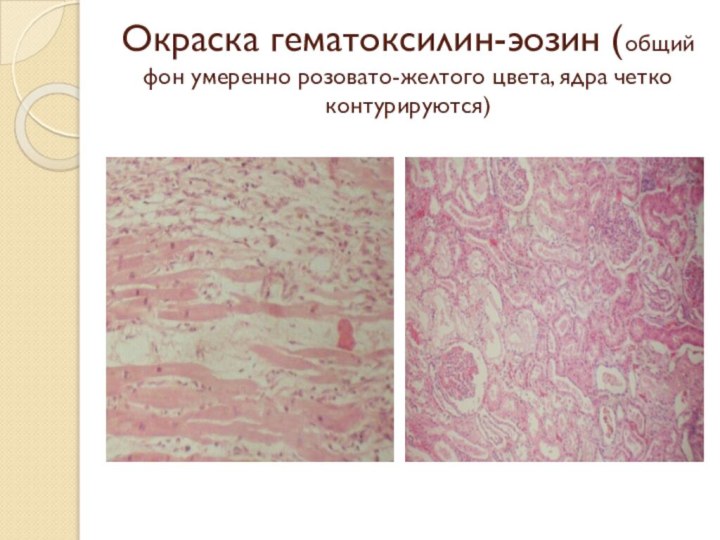
Слайд 52 Окраска гематоксилин-эозин (общий фон умеренно розовато-желтого цвета, ядра
четко контурируются)
Слайд 55
Дегидратация
ЦЕЛЬ – обезвоживание окрашенного препарата и обесцвечивание
для преломления света при микроскопии.
После окраски проводят дегидратацию препаратов
проводя их через серию спиртов возрастающей концентрации: 70% этанол
80% этанол
95% этанол
100% этанол (бутанол)
Ксилол 1
Ксилол 2
Слайд 57
Правила заключения срезов в оптически-прозрачную среду
ЦЕЛЬ –
получение пригодных для микроскопии и хранения препаратов.
Нанести на предметное
стекло каплю Канадского бальзама и приставить к ней ребром покровное стекло. Препаровальной иглой осторожно опустить покровное стекло.
Препаровальными иглами выжать пузырьки воздуха из под покровного стекла.
Следить за достаточным количеством бальзама под покровными стеклами.
Сушить препараты в термостате при 37°С (до суток и более), можно при комнатной температуре.
Слайд 60
Методика окраски Г+Э
Депарафинирование срезов и помещение их в
дистиллированную воду
Окрашивание срезов гематоксилином (время подбирается индивидуально)
Споласкиваем в дистиллированной
водеПогружаем в проточную воду до посинения – 30 мин
Дифференцирование срезов (1-2сек) в солянокислом спирте
Споласкиваем дистиллированной водой для прекращения дифференцировки
Опускаем в проточную воду до посинения
Производим контроль качества дифференцировки под микроскопом.
Споласкиваем срезы дистиллированной водой
Докрашиваем срезы эозином (15-20 сек)
Споласкиваем 96 градусным спиртом (70 градусным, если срезы слишком яркие)
Обезвоживаем срезы в спиртах возрастающей концентрации
Просветляем срезы в 2 порциях ксилола
Заключаем в канадский бальзам
Слайд 61
Методы проведения анализа
Методы гистологического исследования различаются по
способу микроскопии:
Световая — просвечивание в видимой части спектра.
Фазово-контрастная,
позволяющая изучать клетки без окрашивания. Разновидностью этого метода является темнопольная микроскопия, дающая негативное изображение. Интерференционная микроскопия, которая дает возможность определять концентрацию вещества в клетке и проводить количественные морфологические измерения.
Поляризационная, позволяющая определять характер расположения молекул в клетке.
Люминесцентная (флуоресцентная), при которой клетки окрашиваются специальными красителями, заставляющими их светиться во флуоресцентном освещении.
Ультрафиолетовая — просвечивание в ультрафиолетовой части спектра.
Электронная, при которой для просвечивания используется не свет, а направленный пучок электронов.
Радиоавтография — исследование, предполагающее использование изотопных меток, позволяет оценить скорость обменных процессов в клетке.
Цитоспектрофотометрия — изучение химического состава клетки.
Слайд 62
Архивирование
В патолого-анатомическом бюро (отделении) формируется архив, который включает
следующие материалы:
- Направления;
- Протоколы;
- Журналы;
- микропрепараты;
- тканевые образцы в парафиновых блоках;
- тканевые образцы в 10%-ном растворе нейтрального формалина;
- материалы, полученные по результатам патолого-анатомических вскрытий, указанные в пункте 34 порядка проведения патолого-анатомических вскрытий, утвержденного приказом Министерства здравоохранения Российской Федерации от 6 июня 2013 г. № 354н.
Слайд 63 Сроки хранения в архиве патолого-анатомического бюро (отделения) биопсийных
(операционных) материалов и документов, оформленных в рамках патолого-анатомических исследований:
тканевые образцы в 10%-ном растворе нейтрального формалина при наличии опухолевого или опухолеподобного процесса — не менее одного года с даты оформления протокола, в прочих случаях - не менее чем до окончания оформления протокола;
микропрепараты и тканевые образцы в парафиновых блоках - в течение срока хранения медицинской документации пациента;
направления и протоколы — в течение срока хранения медицинской документации пациента.
Слайд 64 Выдача микропрепаратов, тканевых образцов в парафиновых блоках и
копий направлений и протоколов (далее - архивные материалы) пациенту
либо его законному представителю фиксируется в журнале с указанием следующих сведений:дата выдачи архивных материалов;
сведения о пациенте (фамилия, имя, отчество и дата рождения);
регистрационный номер патолого-анатомического исследования;
сведения о лице, которому выданы архивные материалы, и его подпись;
сведения о работнике, который произвел выдачу архивных материалов, и его подпись;
отметка о возврате ранее выданных микропрепаратов, тканевых образцов в парафиновых блоках в архив патолого-анатомического бюро (отделения).
Слайд 65
Порядок сроков хранения и выдачи патологоанатомической документации.
Протоколы патологоанатомических
вскрытий хранятся постоянно (бессрочно).
Журнал учета приема и выдачи
трупов патологоанатомической организации (подразделения); валовая и алфавитная книги (журналы) патологоанатомических вскрытий; хранятся постоянно (бессрочно). Корешки бланков медицинских (врачебных) свидетельств о смерти и журнал их учета хранятся 1 год после календарного года, в котором выдано свидетельство и уничтожаются комиссионно, с составлением акта в соответствии с действующими нормативными документами.
Прочая документация патологоанатомической организации (подразделения) хранится 3 года (уничтожается без составления акта), если иное не предусмотрено действующими нормативными документами.
Слайд 66
Утилизация
Большая часть отходов ПАО относится к отходам
класса Б :
влажный архив или нефиксированный материал после биопсийных
и аутопсийных исследований, гистологические препараты и блоки, подлежащие уничтожению после временного хранения,
материалы и инструменты.
1. Дезинфекция отходов классов Б и В производится в соответствии с действующими нормативными документами.
Дезинфекция производится в пределах медицинского подразделения, где образуются отходы данного класса.
2. Все отходы, класса Б после дезинфекции (если они не были фиксированы в формалине и других фиксирующих жидкостях) собираются в одноразовую герметичную упаковку. Гистологические препараты (стекла), иглы, ножи и др. (после дезинфекции) собираются в отдельную одноразовую твердую тару.
3. Герметичная одноразовая тара с отходами класса Б в дальнейшем утилизируется путем кремации (термическое обезвреживание). Твердые острые предметы (гистологические препараты) утилизируются централизованно, после дезинфекции вывозятся на полигон твердых бытовых отходов.
Слайд 67
Порядок сроков хранения, выдачи и утилизации аутопсийного материала.
«Влажный»
архив (в 10% нейтральном формалине) патологоанатомического вскрытия может быть
уничтожен по окончании гистологического исследования и установления патологоанатомического диагноза или сохранен по распоряжению врача-патологоанатома, производившего вскрытие или руководителя патологоанатомическим организациям (подразделением).Гистологические препараты и парафиновые блоки материалов патологоанатомического вскрытия хранятся 3 года. Уничтожаются без составления акта.
Уничтожение (утилизация) биоматериалов – «влажного» архива, кусочков ткани после переплавки блоков и др., осуществляется в соответствии с действующими нормативными и распорядительными документами о порядке утилизации биологических отходов.
Выдача гистологических препаратов и парафиновых блоков материала патологоанатомических вскрытий производится только по письменным запросам и только медицинских организаций, правоохранительных органов с регистрацией в журнале выдачи.
Гистологические препараты и их блоки после изучения подлежат возврату в патологоанатомическую организацию (подразделение).
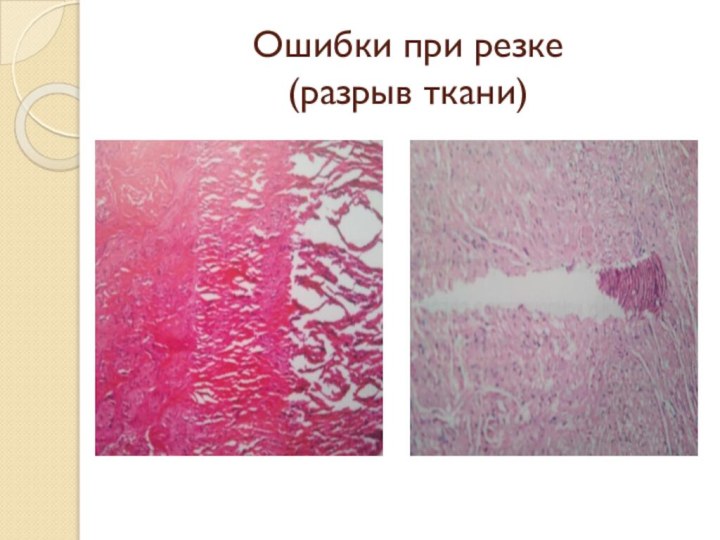
Слайд 68 Основные ошибки гистологической техники и дефекты, появляющиеся в
их результате.
1. Дефекты аналитического этапа :
Ошибки, допущенные при фиксации;
Некачественная
проводка;Ошибки при заливке;
Дефекты микротомии;
Неадекватная окраска.
2. Артефакты постаналитического этапа:
Высыхание ;
Вода в срезе;
Выцветание препарата.