- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Аминокислоты и белки
Содержание
- 2. Аминокислоты Соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой.
- 6. Незаменимые аминокислоты Незаменимыми называются аминокислоты, которые не могут
- 7. Незаменимые аминокислоты Следующие аминокислоты принято считать незаменимыми для
- 8. Кислотно-основные свойства
- 9. Кислотно-основные свойства не ионная форма; идеализированная аминокислота цвиттер-ион; аминокислота в твердом состоянии
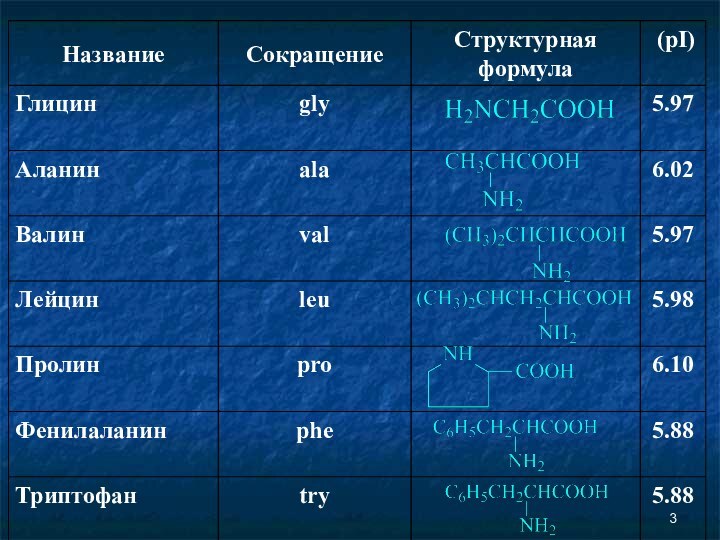
- 10. Изоэлектрическая точка (рI) Изоэлектрической точкой называется такое
- 11. Способы получения аминокислот Аминирование α-галогензамещенных кислот
- 12. Способы получения аминокислот Бромирование при помощи малоновой кислоты
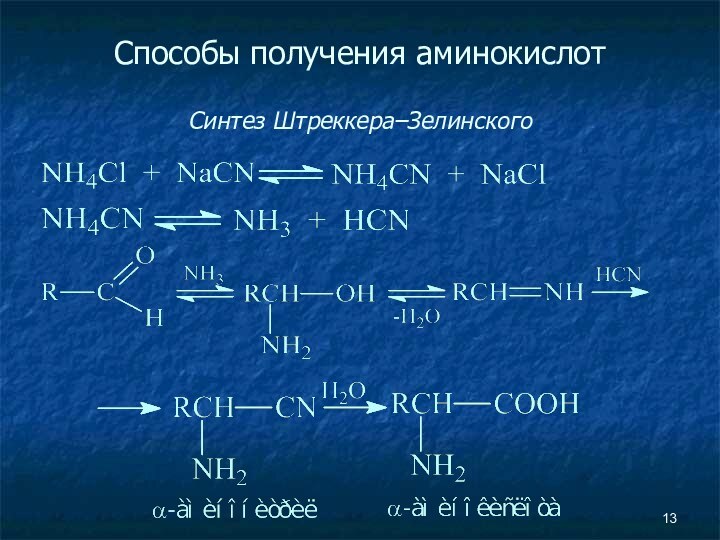
- 13. Способы получения аминокислот Синтез Штреккера–Зелинского
- 14. Способы получения аминокислот Алкилирование N-замещенных
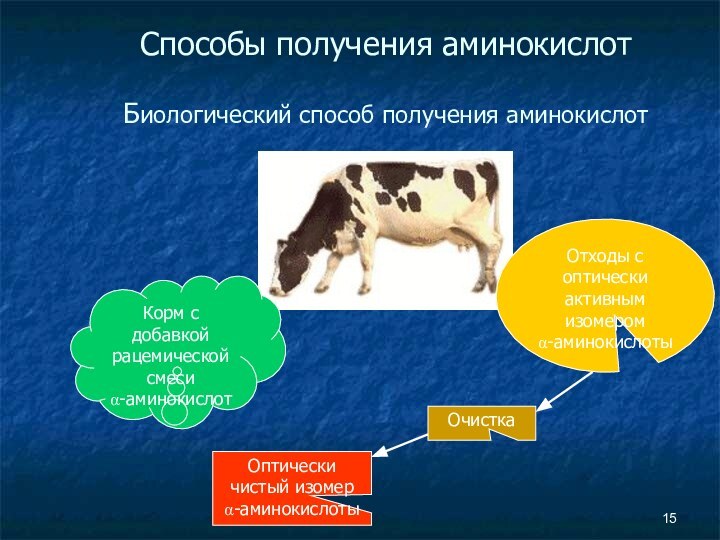
- 15. Способы получения аминокислот Биологический способ получения
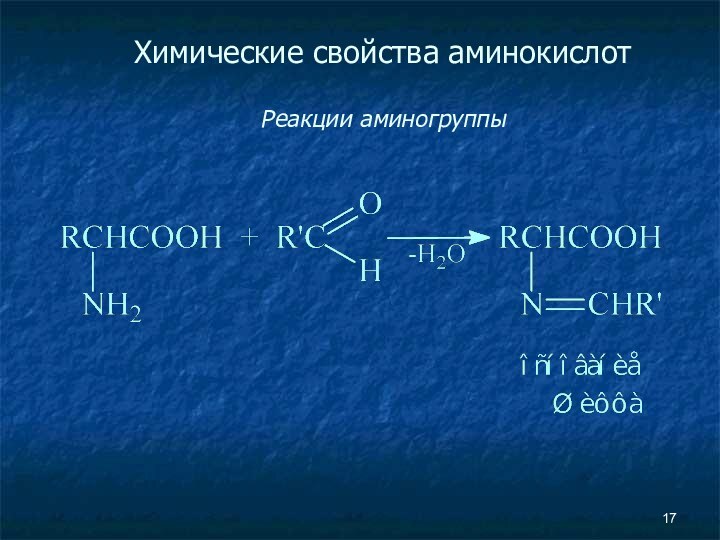
- 16. Химические свойства аминокислот Реакции аминогруппы Метод Ван-Слайка
- 17. Химические свойства аминокислот Реакции аминогруппы
- 18. Химические свойства аминокислот Реакции карбоксильной группы
- 19. Химические свойства аминокислот Реакции карбоксильной группы
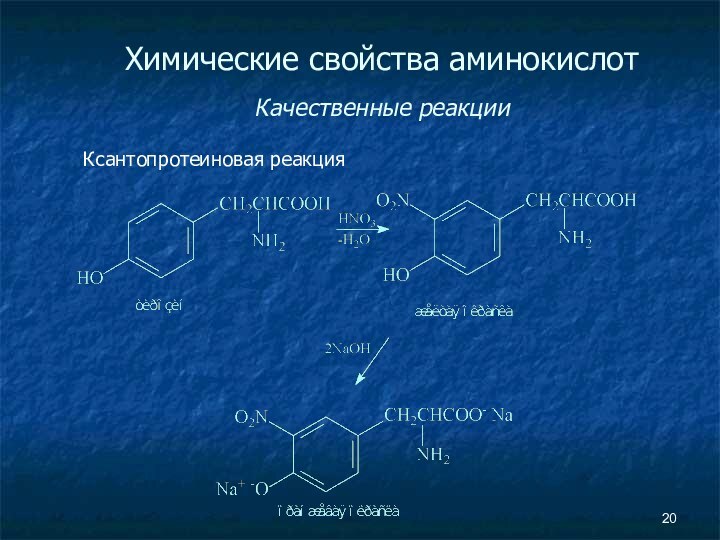
- 20. Химические свойства аминокислот Качественные реакции Ксантопротеиновая реакция
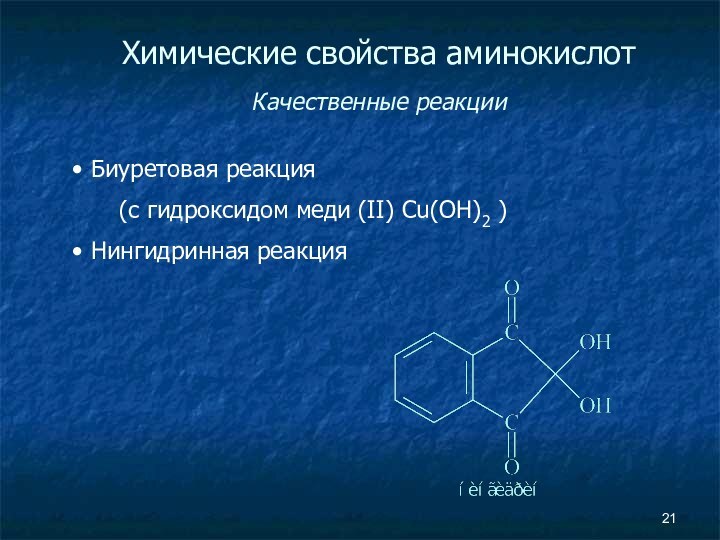
- 21. Химические свойства аминокислот Качественные реакции Биуретовая реакция (с гидроксидом меди (II) Cu(OH)2 ) Нингидринная реакция
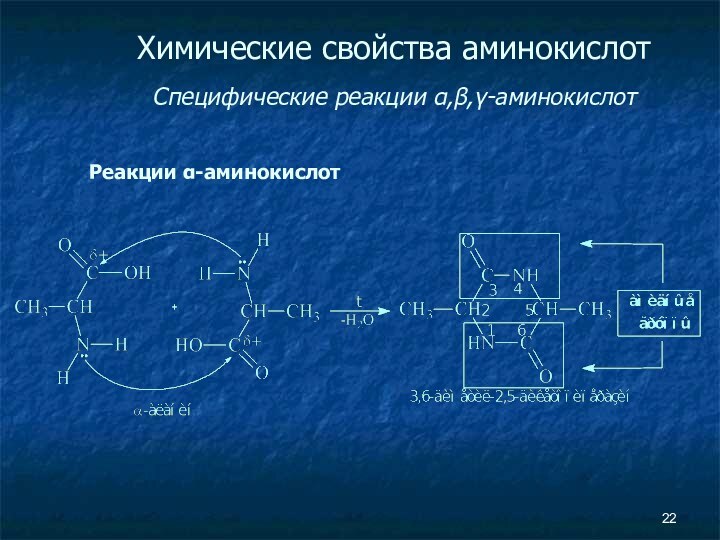
- 22. Химические свойства аминокислот Специфические реакции α,β,γ-аминокислот Реакции α-аминокислот
- 23. Химические свойства аминокислот Специфические реакции α,β,γ-аминокислот Реакции β-аминокислот
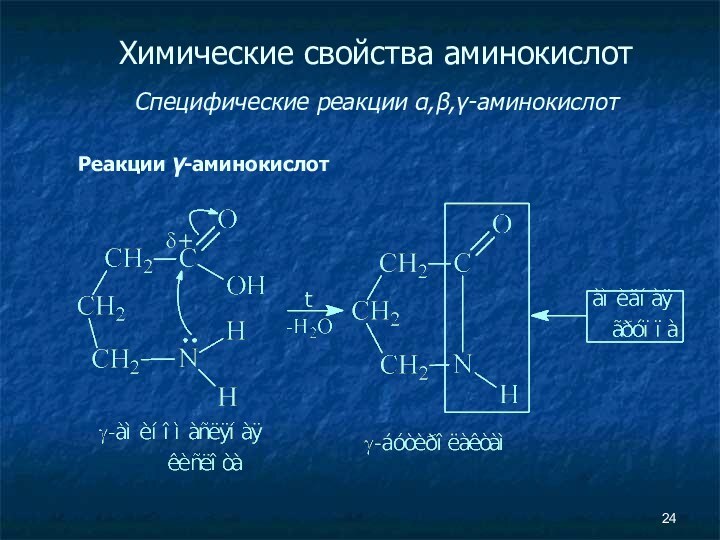
- 24. Химические свойства аминокислот Специфические реакции α,β,γ-аминокислот Реакции γ-аминокислот
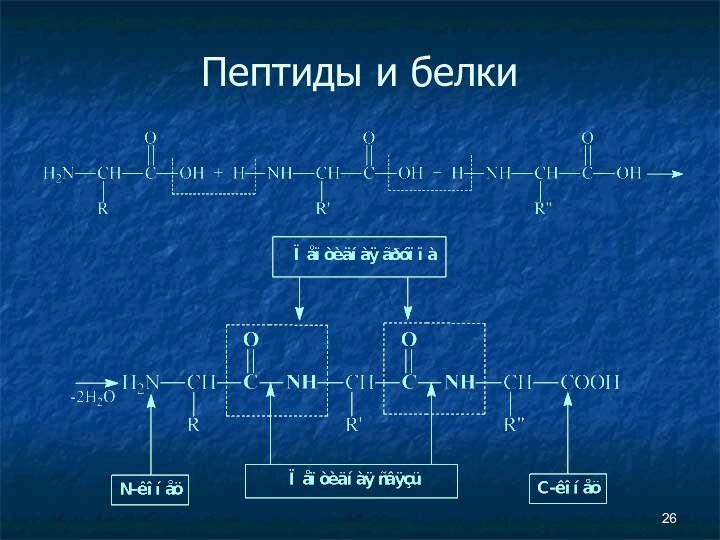
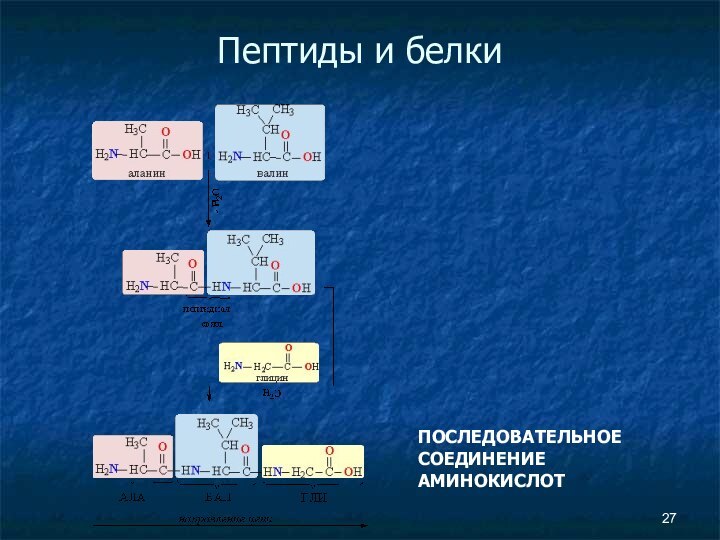
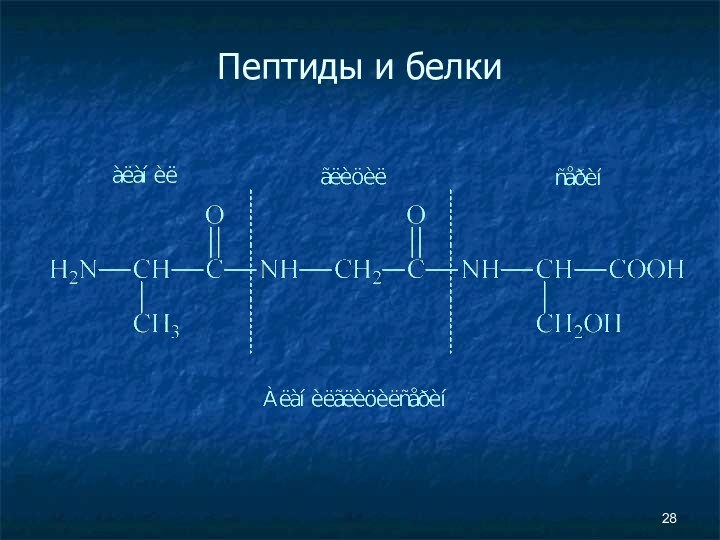
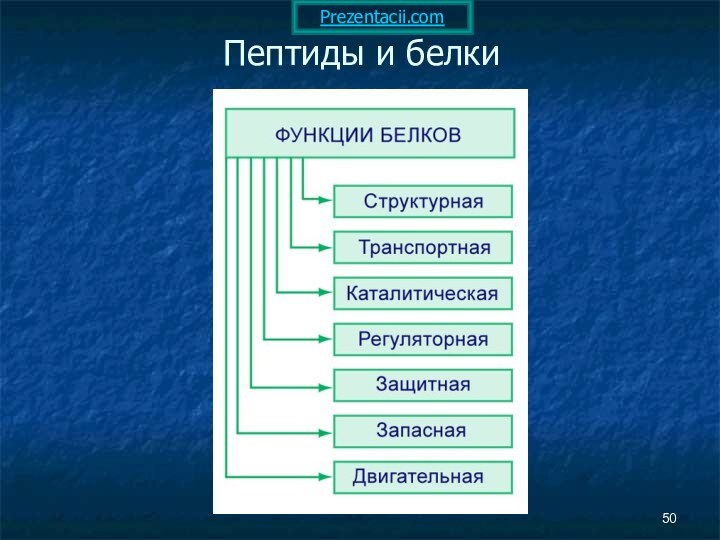
- 25. Пептиды и белки Пептиды — соединения, построенные из нескольких остатков α-аминокислот, связанных амидной (пептидной) связью.
- 26. Пептиды и белки
- 27. Пептиды и белки ПОСЛЕДОВАТЕЛЬНОЕ СОЕДИНЕНИЕ АМИНОКИСЛОТ
- 28. Пептиды и белки
- 29. Пептиды и белки Первичная структура белка инсулина.
- 30. Пептиды и белки Структура белков
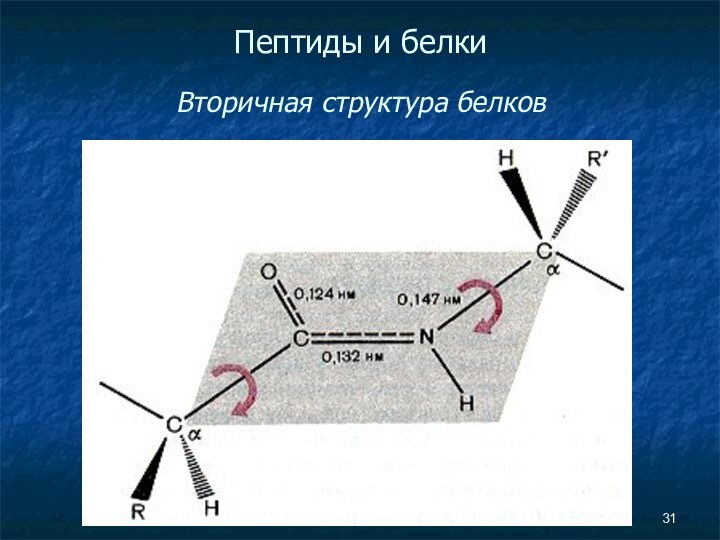
- 31. Пептиды и белки Вторичная структура белков
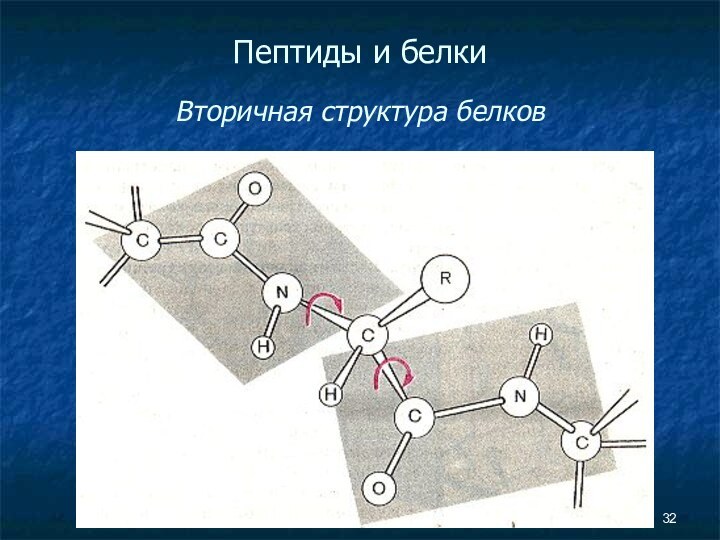
- 32. Пептиды и белки Вторичная структура белков
- 33. Пептиды и белки Вторичная структура
- 34. Пептиды и белки Вторичная структура
- 35. Пептиды и белки Вторичная структура белков α-спираль молекулы белка
- 36. Пептиды и белки Вторичная структура белков ПАРАЛЛЕЛЬНАЯ β-СТРУКТУРА, состоящая из трех полипептидных молекул
- 37. Пептиды и белки Вторичная структура белков АНТИПАРАЛЛЕЛЬНАЯ β-СТРУКТУРА, состоящая из трех полипептидных молекул
- 38. Пептиды и белки Вторичная структура белков ОБРАЗОВАНИЕ β-СТРУКТУРЫ внутри одной полипептидной цепи
- 39. Пептиды и белки Вторичная структура белков β-структура белка
- 40. Пептиды и белки Вторичная
- 41. Пептиды и белки Вторичная
- 42. Пептиды и белки Третичная структура
- 43. Пептиды и белки Ионные взаимодействия
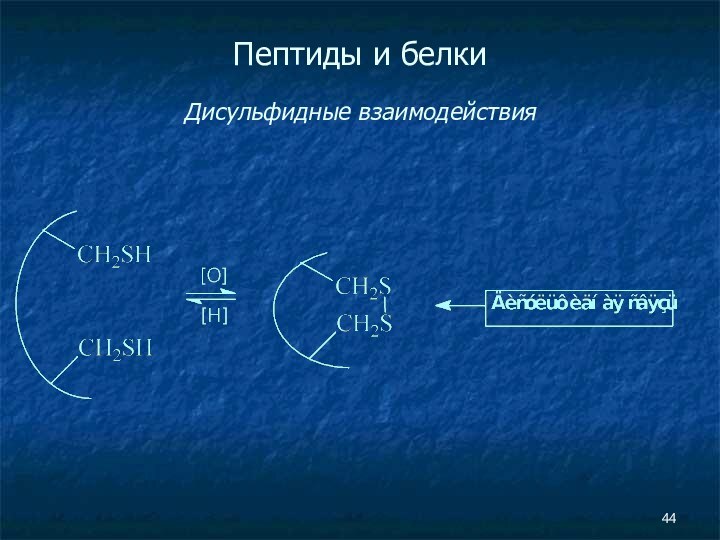
- 44. Пептиды и белки Дисульфидные взаимодействия
- 45. Пептиды и белки Глобулярные белкиГЛОБУЛЯРНАЯ
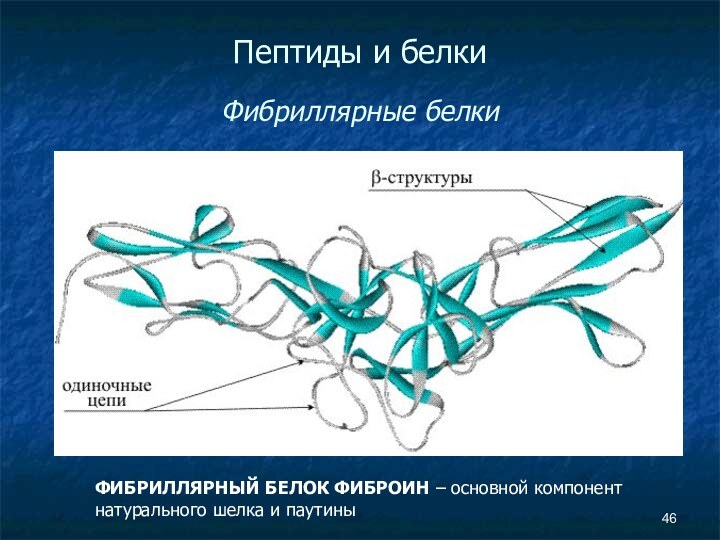
- 46. Пептиды и белки Фибриллярные белкиФИБРИЛЛЯРНЫЙ
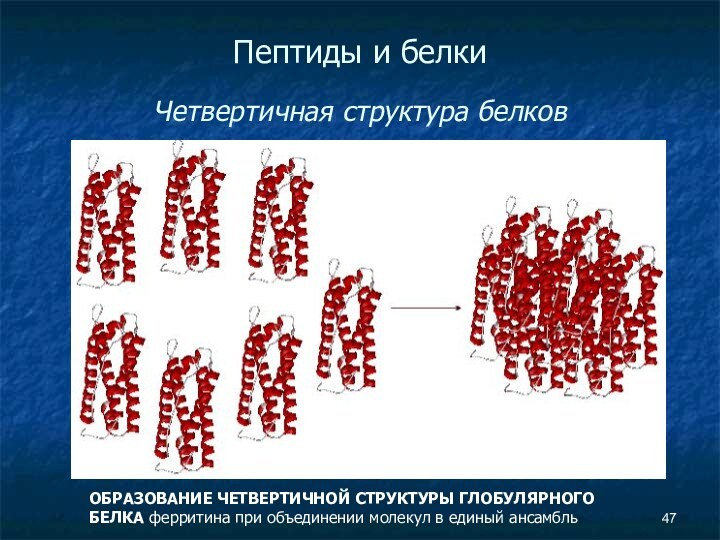
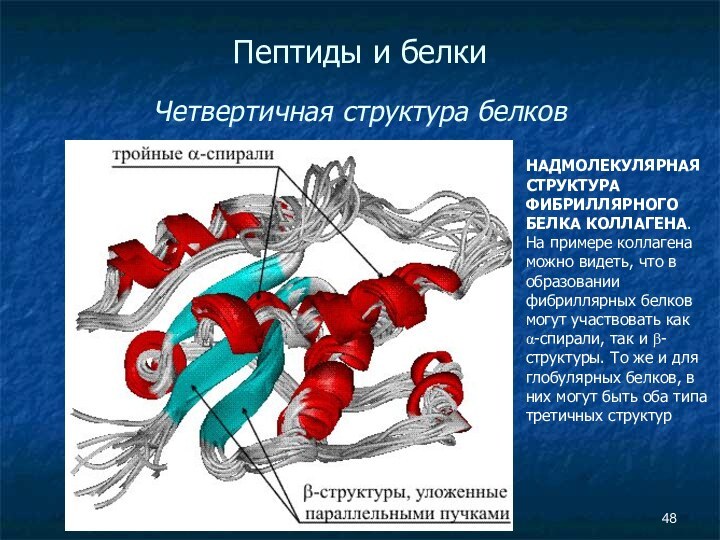
- 47. Пептиды и белки Четвертичная структура
- 48. Пептиды и белки Четвертичная структура
- 49. Пептиды и белки Денатурация белковДенатурация
- 50. Скачать презентацию
- 51. Похожие презентации
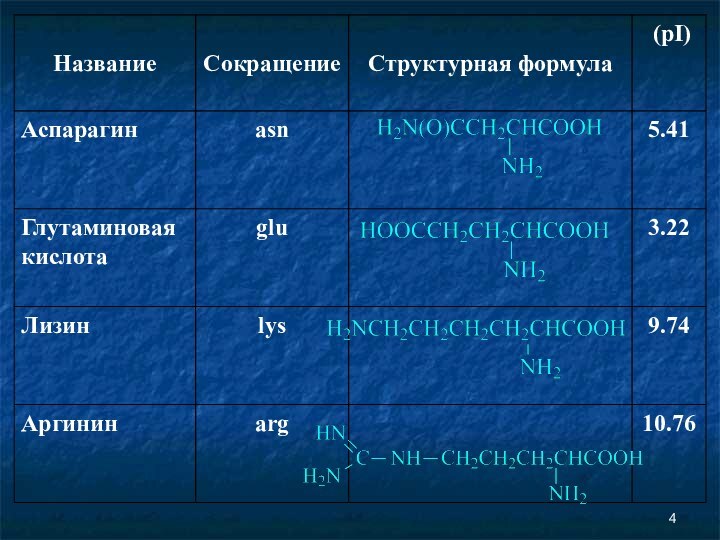
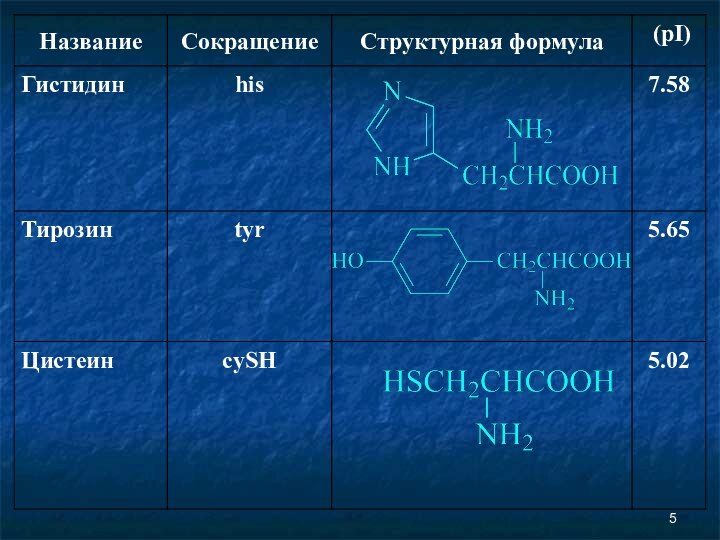
Аминокислоты Соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой.




















Слайд 2
Аминокислоты
Соединение, которое содержит одновременно и кислотную функциональную группу,
и аминогруппу, является аминокислотой.
Слайд 6
Незаменимые аминокислоты
Незаменимыми называются аминокислоты, которые не могут быть
синтезированы организмом из веществ, поступающих с пищей, в количествах,
достаточных для того, чтобы удовлетворить физиологические потребности организма.
Слайд 7
Незаменимые аминокислоты
Следующие аминокислоты принято считать незаменимыми для организма
человека:
изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и
валин.
Слайд 9
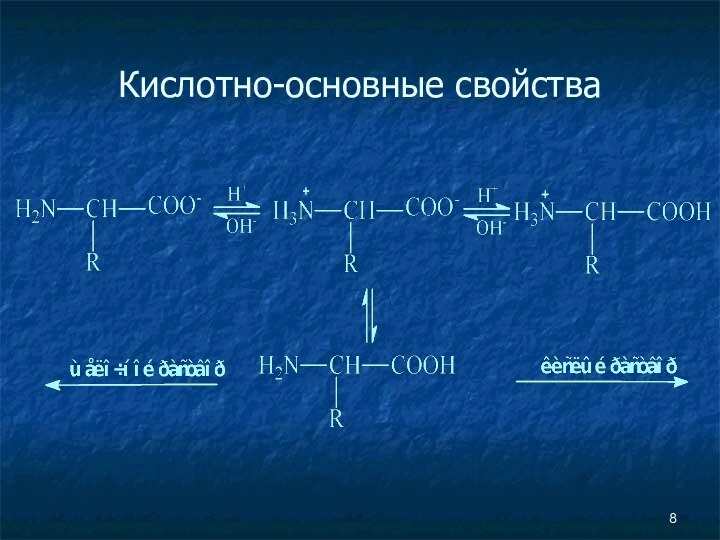
Кислотно-основные свойства
не ионная форма;
идеализированная аминокислота
цвиттер-ион;
аминокислота в
твердом состоянии
Слайд 10
Изоэлектрическая точка (рI)
Изоэлектрической точкой называется такое значение
pH, имеющее определенное значение для каждой аминокислоты, при котором
содержание диполярного иона (цвиттер-иона) максимально
Слайд 14
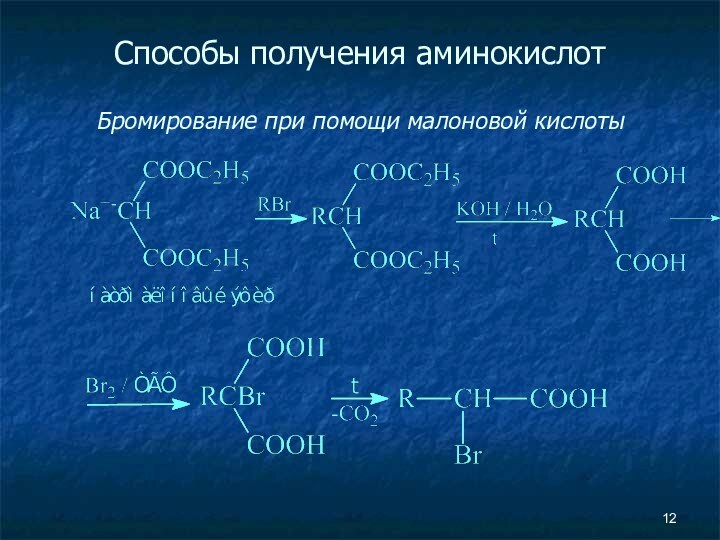
Способы получения аминокислот
Алкилирование N-замещенных аминомалоновых эфиров
Аминирование эфиров
α-галоген-замещенных кислот (с помощью фталимида калия)
Слайд 15
Способы получения аминокислот
Биологический способ получения аминокислот
Корм с добавкой
рацемической смеси
α-аминокислот
Отходы с оптически активным изомером
α-аминокислоты
Очистка
Оптически чистый
изомер
α-аминокислоты
Слайд 21
Химические свойства аминокислот
Качественные реакции
Биуретовая реакция
(с гидроксидом
меди (II) Cu(OH)2 )
Нингидринная реакция
Слайд 22
Химические свойства аминокислот
Специфические реакции α,β,γ-аминокислот
Реакции α-аминокислот
Слайд 23
Химические свойства аминокислот
Специфические реакции α,β,γ-аминокислот
Реакции β-аминокислот
Слайд 24
Химические свойства аминокислот
Специфические реакции α,β,γ-аминокислот
Реакции γ-аминокислот
Слайд 25
Пептиды и белки
Пептиды — соединения, построенные из
нескольких остатков α-аминокислот, связанных амидной (пептидной) связью.
Слайд 30
Пептиды и белки
Структура белков
Первичная структура пептидов
и белков — это последовательность аминокислотных остатков в полипептидной
цепи.
Слайд 33
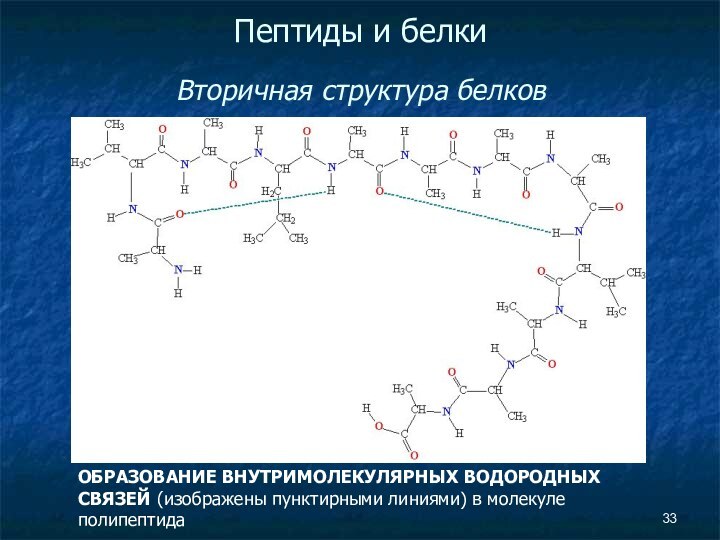
Пептиды и белки
Вторичная структура белков
ОБРАЗОВАНИЕ ВНУТРИМОЛЕКУЛЯРНЫХ
ВОДОРОДНЫХ СВЯЗЕЙ (изображены пунктирными линиями) в молекуле полипептида
Слайд 34
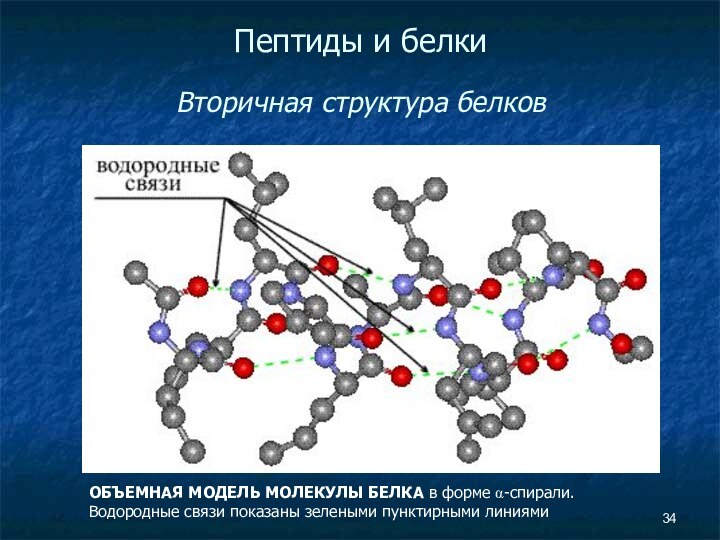
Пептиды и белки
Вторичная структура белков
ОБЪЕМНАЯ МОДЕЛЬ
МОЛЕКУЛЫ БЕЛКА в форме α-спирали. Водородные связи показаны зелеными
пунктирными линиями
Слайд 36
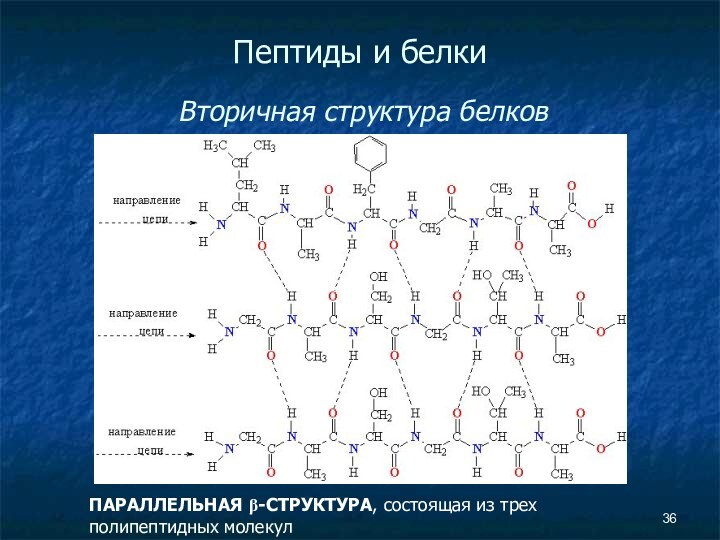
Пептиды и белки
Вторичная структура белков
ПАРАЛЛЕЛЬНАЯ
β-СТРУКТУРА, состоящая из трех полипептидных молекул
Слайд 37
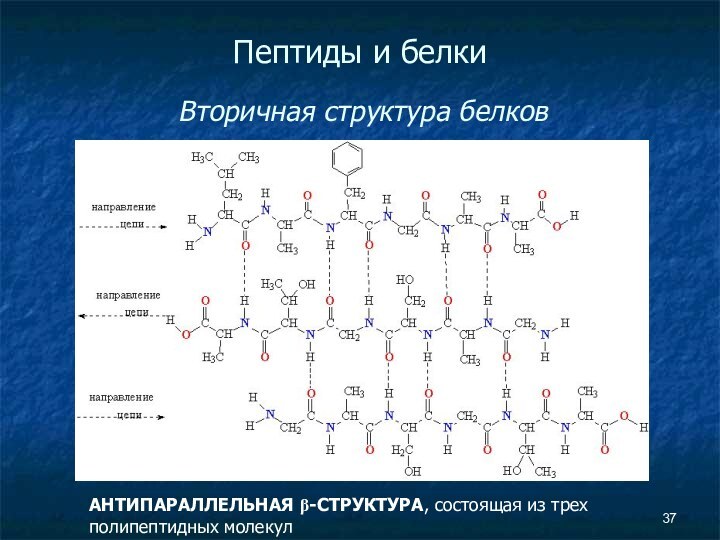
Пептиды и белки
Вторичная структура белков
АНТИПАРАЛЛЕЛЬНАЯ
β-СТРУКТУРА, состоящая из трех полипептидных молекул
Слайд 38
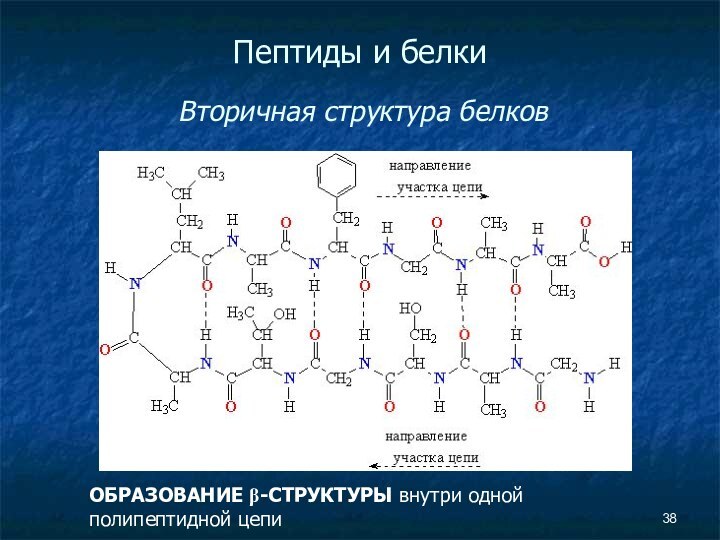
Пептиды и белки
Вторичная структура белков
ОБРАЗОВАНИЕ
β-СТРУКТУРЫ внутри одной полипептидной цепи
Слайд 40
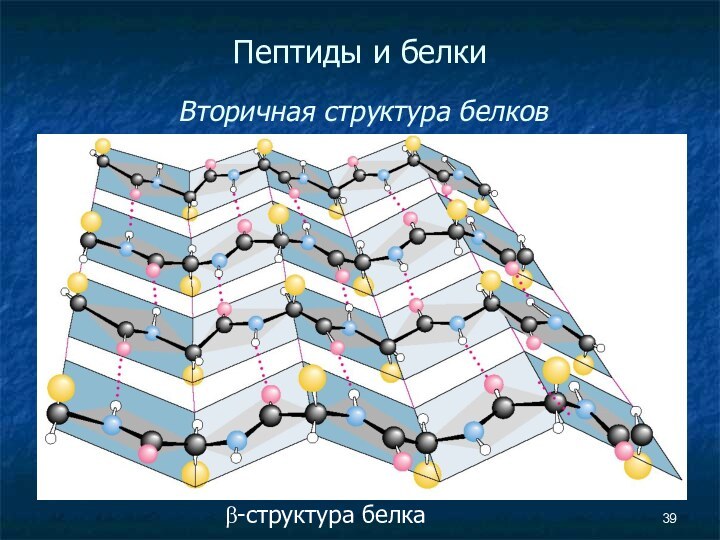
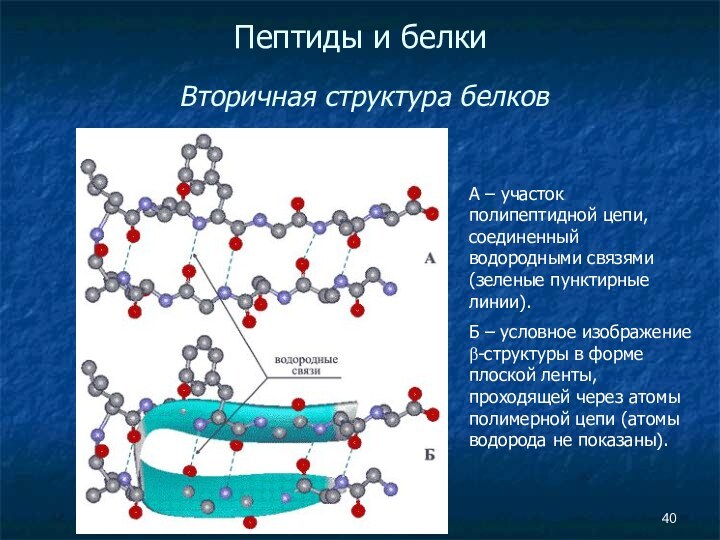
Пептиды и белки
Вторичная структура белков
А
– участок полипептидной цепи, соединенный водородными связями (зеленые пунктирные
линии).Б – условное изображение β-структуры в форме плоской ленты, проходящей через атомы полимерной цепи (атомы водорода не показаны).
Слайд 41
Пептиды и белки
Вторичная структура белков
Вторичная
структура белка — это более высокий уровень структурной организации,
в котором закрепление конформации происходит за счет водородных связей между пептидными группами.
Слайд 42
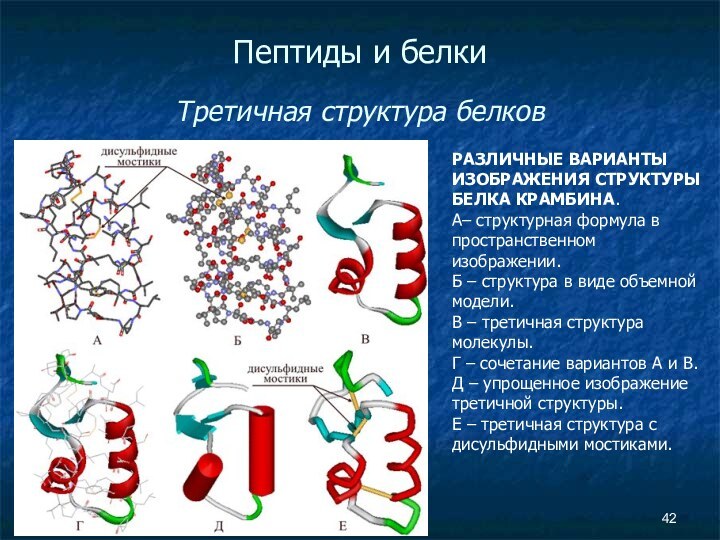
Пептиды и белки
Третичная структура белков
РАЗЛИЧНЫЕ ВАРИАНТЫ
ИЗОБРАЖЕНИЯ СТРУКТУРЫ БЕЛКА КРАМБИНА.
А– структурная формула в пространственном
изображении. Б – структура в виде объемной модели.
В – третичная структура молекулы.
Г – сочетание вариантов А и В.
Д – упрощенное изображение третичной структуры.
Е – третичная структура с дисульфидными мостиками.